水稻土中紫色光合细菌沿纬度梯度的空间分异特征
俎千惠,王保战,贾仲君,林先贵,冯有智,*
1 中国科学院南京土壤研究所,土壤与农业可持续发展国家重点实验室, 南京 210008 2 中国科学院大学研究生院, 北京 100049
水稻土中紫色光合细菌沿纬度梯度的空间分异特征
俎千惠1,2,王保战1,贾仲君1,林先贵1,冯有智1,*
1 中国科学院南京土壤研究所,土壤与农业可持续发展国家重点实验室, 南京 210008 2 中国科学院大学研究生院, 北京 100049
紫色光合细菌由于其代谢途径的多样性,在环境中广泛分布,是生态系统中碳循环的参与者和推动者之一。但是,水稻土中紫色光合细菌群落结构的空间分异却鲜有报道。基于此,沿我国温度梯度带(纬度梯度:28.38° N—47.43° N),采集了8个典型水稻土,利用PCR-DGGE指纹图谱和系统发育树分析揭示不同地点水稻土中紫色光合细菌群落的组成;结合多个环境因子,利用生物信息学,典范对应分析(Canonical Correspondence Analysis, CCA)和最小判别效应分析(Cladogram, LDA)明确水稻土中紫色光合细菌的空间分异规律。研究发现我国8个典型水稻土中紫色光合细菌主要由变形菌门(Proteobacteria)的α和β这两个分支组成,主要为紫色非硫细菌;pH和纬度都是驱动水稻土中紫色光合细菌群落结构分异的关键因子。该认知不仅有助于更好地揭示稻田关键功能微生物群的生物地理学分布,还有助于进一步探究我国稻田生态系统有机质转化的时空差异。
水稻土;紫色光合细菌;PCR-DGGE指纹图谱;典范对应分析;群落组成空间分异
光合微生物是一类地球上最早出现的具有原始光能合成体系的原核生物。紫色光合细菌是光合微生物的重要组成部分,也是生态系统中一类重要的微生物[1]。紫色光合细菌具有极其多样的碳源代谢能力,它们可以代谢几乎所有的发酵产物、CO2、小分子有机酸、甚至CH4[2]。CO2是紫色光合细菌平衡氧化还原电位所必需的电子受体,也是紫色光合细菌可利用的碳源之一。大部分紫色光合细菌以Calvin-Benson循环吸收CO2,少部分利用C4循环[3]。此外,有机物也是影响紫色光合细菌生长的一个重要因素:紫色光合细菌的环式光合磷酸化需要外源性的有机物或硫化物补充电子以合成NAD(P)H;同时,有机物又是紫色光合细菌的主要碳源。紫色光合细菌喜好的有机物为各类小分子有机酸,如甲酸、乙酸、丙酮酸、苹果酸等。极其多样的碳源代谢能力使紫色光合细菌广泛存在于各个生态系统中,并成为碳循环的主要参与者和推动者[4];同时,紫色光合细菌具有固氮能力,可以给生态系统提供氮素,进而提高土壤肥力[5]。
目前对于紫色光合细菌的研究多集中在海洋生态系统,主要以编码光吸收系统中保守性蛋白的结构基因为生物标记物对紫色光合细菌进行研究,例如厦门大学焦念志等利用pufM基因对中国沿海水域进行研究,发现海水样本中含有丰富的pufM基因型,主要为类γ-变形菌纲pufM基因型(34.5%)[6]。随后,焦念志等又利用pufM基因全面研究了太平洋、大西洋和印度洋中紫色光合细菌的丰度和多样性变化[7],发现各大洋水体中都有丰富的资源,并且其海水营养状态和其丰度成正相关,而与其多样性成负相关。Karr等[8]利用pufM基因对南极湖水中紫色光合细菌研究发现湖水中存在丰富的紫色非硫细菌资源,并沿水体深度呈现不同的群落结构。相对于水生生态系统,陆地生态系统中紫色光合细菌的研究相对较少。其部分原因是紫色光合细菌是厌氧微生物,很少存活在有氧环境中,且不能发挥生态功能。但是,紫色光合细菌仍可以在陆地生态系统中合适的环境下生长。例如本研究组利用pufM基因对北极地区33个土壤样品进行紫色光合细菌多样性的研究,发现由于常年处于冰封的环境,北极土壤中也含有丰富的紫色光合细菌资源,主要为紫色非硫细菌[9]。此外,水稻土也是紫色光合细菌喜好的生存场所。稻田土壤富含有机质,同时由于其耕作方式而饱含水分,因此水稻土中含有数量众多,多样性丰富的紫色光合细菌[10]。在水稻土中,紫色光合细菌由于自身含有多种生物类激素,能够作为一种生物肥料促进水稻的增产[11]。此外,紫色光合细菌还参加水稻土中多个元素的循环过程。Byrne等[12]发现紫色光合细菌,Rhodopseudomonas作为铁氧化细菌而参与铁的氧还过程。本课题组前期的研究发现水稻土中紫色光合细菌驱动着一个自下而上的微生物食物网络,通过该食物网络,土壤微生物驱动着C、N等物质循环过程[13]。然而,目前对水稻土中紫色光合细菌群落特性,特别是大尺度下的其地理学分布的认识还严重不足。而该认知能够帮助人们更好的揭示微生物所驱动的稻田生态系统养分和物质循环过程。
我国地域辽阔,从南到北呈现明显的温度梯度带,且土壤类型众多,决定了我国土壤碳含量及其转化功能存在巨大的时空变异[14-15]。土壤中有机质降解和转化由土壤微生物参与和驱动,因此在我国温度梯度带上,参与土壤有机质降解和转化的微生物群落结构和功能也必将存在分异和不同。本课题组前期的研究已经发现,处于稻田生态系统碳循环末端的产甲烷古菌在地理学分布已呈现一定的规律性变化[16]。这也预示着同为稻田生态系统碳循环末端的紫色光合细菌群落结构也将存在时空分异。基于以上认知和前期的工作结果,本研究沿我国纬度梯度变化,从北向南采集了8种典型水稻土(黑龙江海伦、江苏扬州、江苏常熟、四川资阳、浙江嘉兴、湖南古市、湖南桃源和江西鹰潭),利用PCR-DGGE指纹图谱和系统发育分析揭示不同地点水稻土中紫色光合细菌群落组成,结合环境因子,利用生物信息学,典范对应分析(Canonical Correspondence Analysis, CCA)和最小判别效应分析(Cladogram, LDA)明确紫色光合细菌群落组成的空间分异规律。
1 材料和方法
1.1 供试土壤信息
采集我国不同纬度的海伦、扬州、常熟、资阳、嘉兴、古市、桃源和鹰潭地区8个典型水稻土,如表1所示。每个地区水稻种植年限都超过50a。于2011年在鹰潭、桃源、古市、嘉兴和资阳晚稻收获期后一周内采样,海伦、扬州和常熟为水稻季收获期后一周内采样。每个采样点相隔20 m,共采样3处。各个采样点随机取6个0—5 cm的水稻土,去除其中的植物残体、根系和石头后充分混匀。用于分子实验的土壤样品于-40℃保藏,用于土壤理化性质测定的土壤样品经自然风干后过20目(0.90 mm孔径)分样筛备用。
1.2 土壤理化性质的测定
利用酸度计测定土壤的pH值(水土比2.5∶1);分别利用靛酚蓝比色法、镀铜镉还原-重氮化偶合比色法和凯氏定氮法测定土壤的铵态氮、硝态氮、总氮含量;土壤有机质含量采用H2SO4-K2Cr2O7氧化-容量法进行测定[17];各样点年平均温度参考各地方气象台信息。
1.3 土壤总DNA提取
土壤总DNA采用FastDNA SPIN Kit for Soil (MP Biomedicals, Santa Ana, CA)试剂盒和Fast PrepTMFP120核酸提取仪提取。按照试剂盒说明书提取DNA,并将提取到的DNA溶解于75 μL的ddH2O,保存于-20℃。
1.4 PCR-DGGE指纹图谱分析1.4.1 PCR扩增
紫色光合细菌光反应中心蛋白M亚基编码基因片段pufM基因的特异性引物对pufM557F (5″-CGCACCTGGACTGGAC- 3″),pufM750R (5″-CCCATGGTCCAGCGCCAG AA- 3″)进行pufM基因扩增[18]。PCR反应用试剂盒PremixTaq® Version 2.0 Kit (TaKaRa),50 μL的PCR体系添加50 ng的DNA模板量。PCR反应条件:94℃ 3 min;94℃ 30 s,56℃ 30 s,72℃ 30 s,30个循环;72℃ 10 min。PCR扩增产物在1.2% (W/V) Tris-acetate- EDTA (TAE)琼脂糖凝胶中电泳验证。PCR产物保存于4℃。
1.4.2 变性梯度凝胶电泳(DGGE)
采用BIO-RAD Dcode系统(Bio-Rad, CA, USA)对紫色光合细菌pufM基因片段PCR产物进行DGGE指纹图谱电泳。使用8%聚丙烯酰胺凝胶,电泳缓冲液为1×TAE,变性梯度为45%—70%;PCR产物上样量为200 ng DNA;电压80 V,60℃,电泳13 h;用SYBR Green I (Invitrogen) (1:10000,V/V)染色30 min,后用Gel DocTMEQ imager (Bio-Rad)成像拍照[19]。
将DGGE特征条带割胶,放入含有40 μL去离子水的1.5 mL的离心管中,置于4℃冰箱过夜。以此溶液为模板,再次使用pufM基因引物对其进行扩增。PCR扩增体系和反应条件如上。将扩增后的PCR产物进行DGGE验证,以确定各个pufM基因型的位置和纯度。如不符,继续切带、扩增和验证。
1.5 克隆测序和构建系统发育树
将验证后的pufM基因片段PCR扩增产物连接到pMD 18-T vector (TaKaRa),并转化到EscherichiacoliDH5α感受态细胞中,在含有X-gal、IPTG和氨苄青霉素的LB培养基上培养过夜。挑取具有氨苄青霉素抗性的白色转化子,采用T载体通用引物M13进行菌落PCR,扩增产物经1.2% (W/V)琼脂糖凝胶电泳检测是否为阳性克隆。将含有正确克隆子的细胞扩大液交由上海Invitrogen公司进行测序。将测序得到的序列在National Center for Biotechnology Information (NCBI)网站上BLAST比对,进行同源性检索。利用Cluster W软件对本实验获得的产甲烷古菌基因序列以及NCBI中亲缘性最高的基因序列进行多重序列比对,根据N-J(Neighbor-Joining)法,利用MEGA 4.0软件构建系统发育树。
1.6 统计分析
运用SPSS 13.0进行统计分析,并使用Tukey检验进行多重比较(P<0.05)。用Quantity One 4.4.0(Bio-Rad)对紫色光合细菌DGGE指纹图谱进行数字化分析;利用软件Canoco for Windows(version 4.5)进行紫色光合细菌群落组成分异和各个环境因子变化相关性的典范对应分析(Canonical Correspondence Analysis, CCA);在http://huttenhower.sph.harvard.edu/galaxy/网站上进行最小判别效应分析。
2 实验结果
2.1 土壤理化性质分析
8个地区土壤样品的理化性质如表1所示:资阳的pH和硝态氮含量最高,而pH最低的是桃源地区,硝态氮最低的是鹰潭;铵态氮、全氮和有机质的分布相似,最高值都出现在古市,最低值则出现在海伦;而在碳氮比方面,海伦的比值最大,嘉兴和资阳的比值最小。
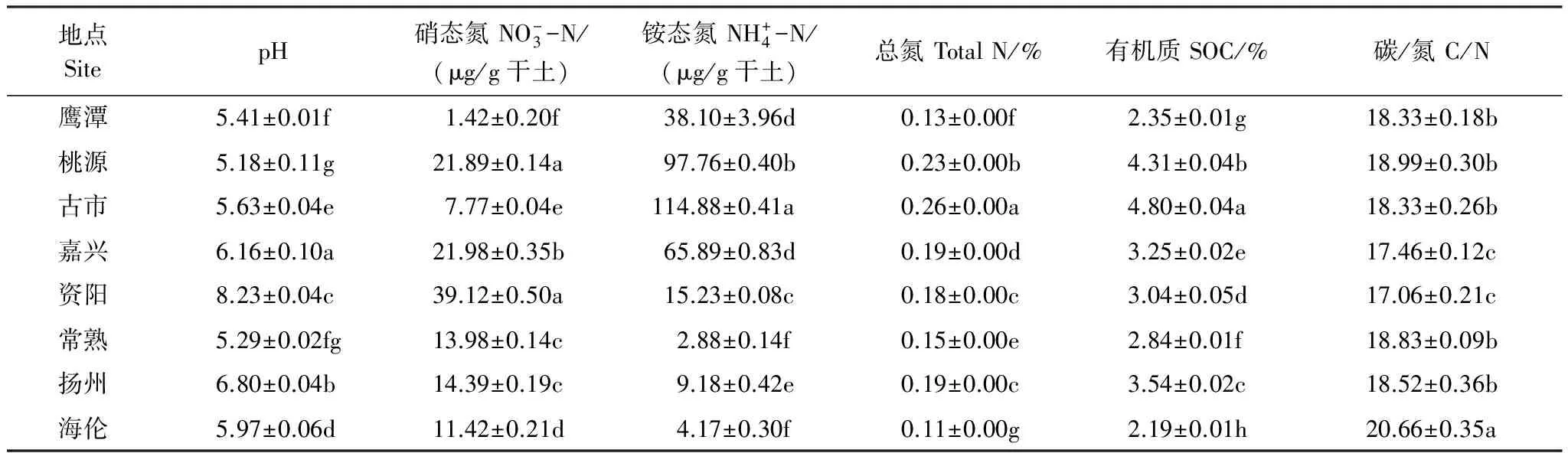
表2 8个地区水稻土化学特性
数据为3个重复均为平均值±标准差,不同字母显示数据差异显著性(P<0.05)
2.2 8个地区水稻土中紫色光合细菌群落组成的DGGE指纹图谱
PCR-DGGE指纹图谱用于分析8个地区水稻土中紫色光合细菌群落组成的差异(图1)。通过比较8个地区样品的条带数量和光密度值可以看出各个地区的条带数量和强度(丰度)差异明显。其中资阳地区的条带数量最丰富,共有28个优势条带,而鹰潭地区的条带数量最少,优势条带只有7个。此外,不同条带在各个样品间的分布和强度也不尽相同,例如条带18是8个地区的共有条带;而条带1是海伦地区所特有的,条带2是资阳地区所特有的,条带3为海伦、扬州、常熟、嘉兴和古市所共有的。在条带的光密度上,条带4、8、14、24在扬州的丰度最高,条带5、11、22、23、26、28在资阳的丰度最高,条带6、7、15在海伦的丰度最高,条带9、12、17、18、20、21、25、27在常熟的丰度最高,条带10在桃源的丰度最高,条带13在鹰潭的丰度最高,条带16在古市的丰度最高。
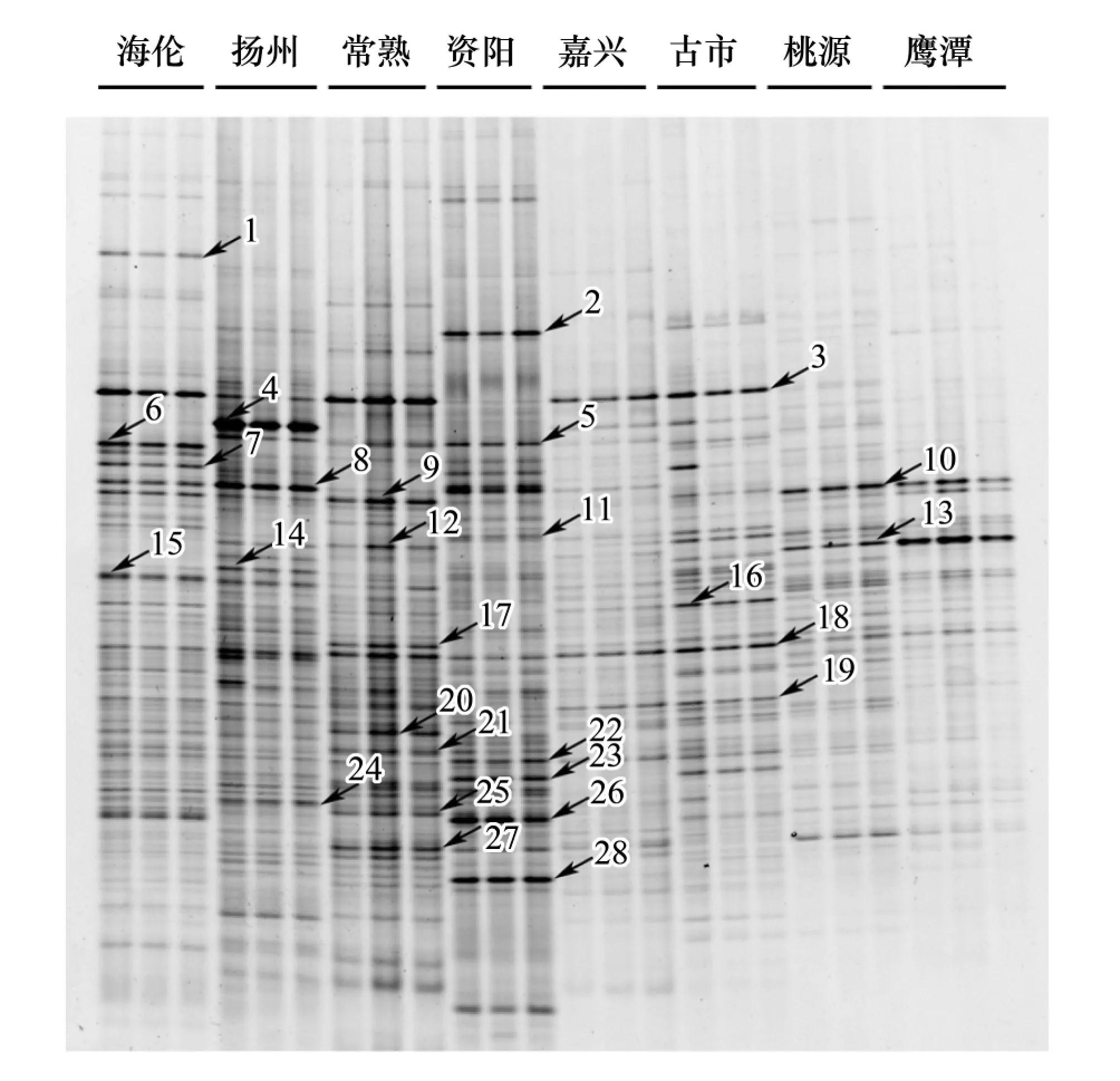
图1 pufM基因片段的DGGE指纹图谱Fig.1 DGGE fingerprinting profiles of pufM genes
2.3 紫色光合细菌多样性指数分析
根据DGGE指纹图谱中展示的条带,对8个样品中光合细菌群落的多样性进行Shannon和Richness指数分析,结果如图2所示。从图中可以看出,8个样品的Shannon多样性指数存在差异,其中常熟和扬州的Shannon多样性最高,桃源和鹰潭最低;与之相类似,Richness多样性指数也呈现出相同规律,其中常熟和扬州的Richness多样性指数最高,而桃源和鹰潭最低。Shannon和Richness多样性指数与所有环境因子均无相关性。
2.4 紫色光合细菌系统发育分析
从系统发育分析可以看出,8个地区的紫色光合细菌主要隶属于变形菌门(Proteobacteria)的α和β的这两个分支上,紫色非硫细菌主导水稻土中紫色光合细菌。其中,8个地区所共有的条带18隶属于Roseivivax;海伦、扬州、常熟、嘉兴和古市所共有的条带3与Rhizobiales的亲缘性最高,同时,海伦地区所特有的条带1,以及资阳地区所特有的条带2都与Rhizobiales的亲缘性最高。出现在中纬度地区的条带26和28分别隶属于Rhodobacter和Rhodovulum。
2.5 8个地区水稻土中紫色光合细菌群落结构的CCA分析
利用8个地区的紫色光合细菌群落结构的DGGE图谱条带和8个主要的环境因子做CCA分析(图4)。从图中可以看出,在横坐标上pH是主要的影响因素,贡献率为29.8%;纵坐标上C/N是主要的影响因素,贡献率为20.5%。温度、硝态氮与全氮对紫色光合细菌的影响方向一致,与纬度因子的影响方向相反。根据紫色光合细菌群落组成的相似性,从主要相关因素pH因子上看,pH值较高的资阳地区位于左侧,pH值较低的桃源和鹰潭位于右侧。C/N较高的海伦、扬州位于下部,比值较低的资阳位于图中的上部。纬度较高的鹰潭、桃源、嘉兴和古市聚在一起,纬度较低的常熟、海伦和扬州聚在一起。

图2 紫色光合细菌Shannon和Richness多样性指数分析Fig.2 Purple photosynthetic bacteria Shannon and Richness diversity indices

图3 8个地区水稻土中优势紫色光合细菌pufM基因片段的系统发育树Fig.3 Phylogenetic analysis showing the relationships of pufM genes in DGGE fingerprinting profiles to the closest relatives in GenBankThe numbers at the nodes indicate the percentages of occurrence in 1000 bootstraped trees. The GenBank accession number of each strain is indicated in parentheses and the scale bar represents 5% sequences difference
2.6 最小判别效应分析
将8个地区的物种信息进行最小判别效应分析,结果如图5所示。在8个地区中海伦、桃源和鹰潭地区的紫色光合细菌物种差异最显著,其中,鹰潭地区由于具有14个Unclassified species的优势条带而与其他地区相区别,海伦地区具有较多的隶属于Rhizobiales门的优势条带而与其他地区相区别,而桃源地区由于缺少隶属于Rhodobacterales门的优势条带和其他地区不同。
3 讨论
目前,关于紫色光合细菌的研究主要集中在水生生态系统,对于陆地生态系统特别是稻田生态系统的关注较少。基于以上原因,本文开展了相关研究。首先,通过PCR-DGGR指纹图谱,展示出我国8个典型水稻土样品中紫色光合细菌的群落组成(图1),以及各自优势物种在数量和多样性的差异(图2)。8个地区的紫色光合细菌主要隶属于变形菌门(Proteobacteria)的α和β的这两个分支上,为紫色非硫细菌(图3)。这与本课题组之前的研究结果一致[18],说明水稻土中的紫色光合细菌含有丰富的多样性。紫色光合细菌主要分为两大类,紫色非硫细菌和紫色硫细菌。前者主要利用有机质异养生长,而紫色硫细菌主要利用光能自养生长。土壤生态系统与水生生态系统相比,富含有机质,且日光只能进入土壤几个厘米,绝大多数环境处于黑暗状态,因此水稻土中紫色光合细菌主要为α-和β- Proteobacteria类的紫色非硫细菌,而水生生态还含有大量γ- Proteobacteria类的紫色光合细菌[6,20]。紫色非硫细菌是一类具有重要生态功能的紫色光合细菌,例如Rhodobacter和Rhodopseudomonas。例如Byrne等[12]发现Rhodopseudomonas作为铁氧化细菌和Geobacter共同参与铁的氧还过程;本课题组研究发现水稻土中以Rhodopseudomonas为主的紫色光合细菌驱动着一个自下而上的微生物食物网络,通过该食物网络,土壤微生物驱动着C、N等物质循环过程[13]。结合本研究的结论,我们可以推断以上过程可能普遍存在于稻田生态系统。该认知将有助于我们更好的认识稻田生态系统中养分循环机制。
鉴于紫色光合细菌是一类具有重要生态功能的土壤微生物,又进一步研究了其地理学分布。PCR-DGGR指纹图谱明确的揭示出8个地区紫色光合细菌在群落组成上的差异性(图1)。8个地区中优势条带的数量和种类都不相同,其中,资阳地区的条带数量最丰富,共有28个优势条带,而鹰潭地区的条带数量最少,优势条带只有7个。从资阳到鹰潭,物种数量呈现一定递减的趋势。为了更好地展示紫色光合细菌群落在不同地点差异及其驱动因子,将其与环境变量相结合,进行典范对应分析以及最小判别效应分析。研究发现,在多种环境因子中pH和纬度(温度)是影响水稻土中紫色光合细菌群落发生分异的关键因素(图4和5)。pH是土壤的一个重要环境因子,它由多种环境因素所共同决定[21];在前期的工作中,本课题组已经证明,在北极地区的土壤中,pH对紫色光合细菌群落组成和多样性都有重要影响[9],是预测土壤中微生物群落发生分异的重要因素。其部分原因是由于紫色光合细菌细胞表面zeta电位的需求[22]:在同化CO2时,紫色光合细菌必须尽量保持自己的细胞膜不处于负电荷状态,以保证不(少)吸附Ca2+和保护自己不被CaCO3沉淀所伤害[23]。因此,pH值对紫色光合细菌细胞膜的zeta电位影响很大[24],进而对其群落结构也影响很大。同时,与水稻土中紫色光合细菌生态位相似,同处在碳循环末端的产甲烷古菌也被证实pH是影响其群落分异的主要驱动因子[16]。此外,纬度也是影响土壤中紫色光合细菌群落分异的关键环境因素。前期工作也发现温度(纬度)对产甲烷古菌的群落结构也有影响[16]。温度上升,增加土壤微生物数量和多样性[25],增强土壤微生物代谢活性[26],从而促进土壤碳转化效率[9]。因此,CCA图上显示纬度和土壤理化性质有着较高的相关性(图4)。紫色光合细菌是碳循环末端的微生物,温度升高通过增加底物供应而影响其群落结构。在研究中发现一些Roseivivax出现在纬度较高的海伦地区,而在低纬度地区并没有出现,例如条带15(图1和图5)。所以在纬度(温度)梯度上,紫色光合细菌群落结构也发生分异。
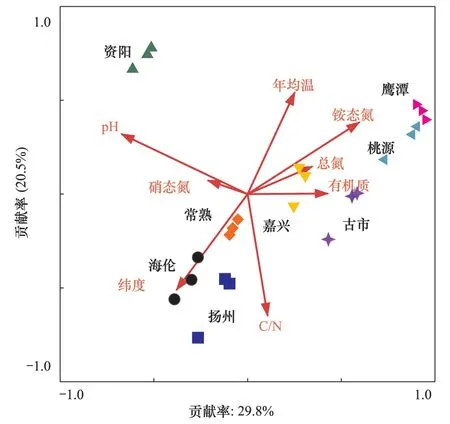
图4 8个地区水稻土中紫色光合细菌群落组成的典范对应分析Fig.4 Canonical correspondence analysis relating DGGE fingerprinting patterns with environmental variables
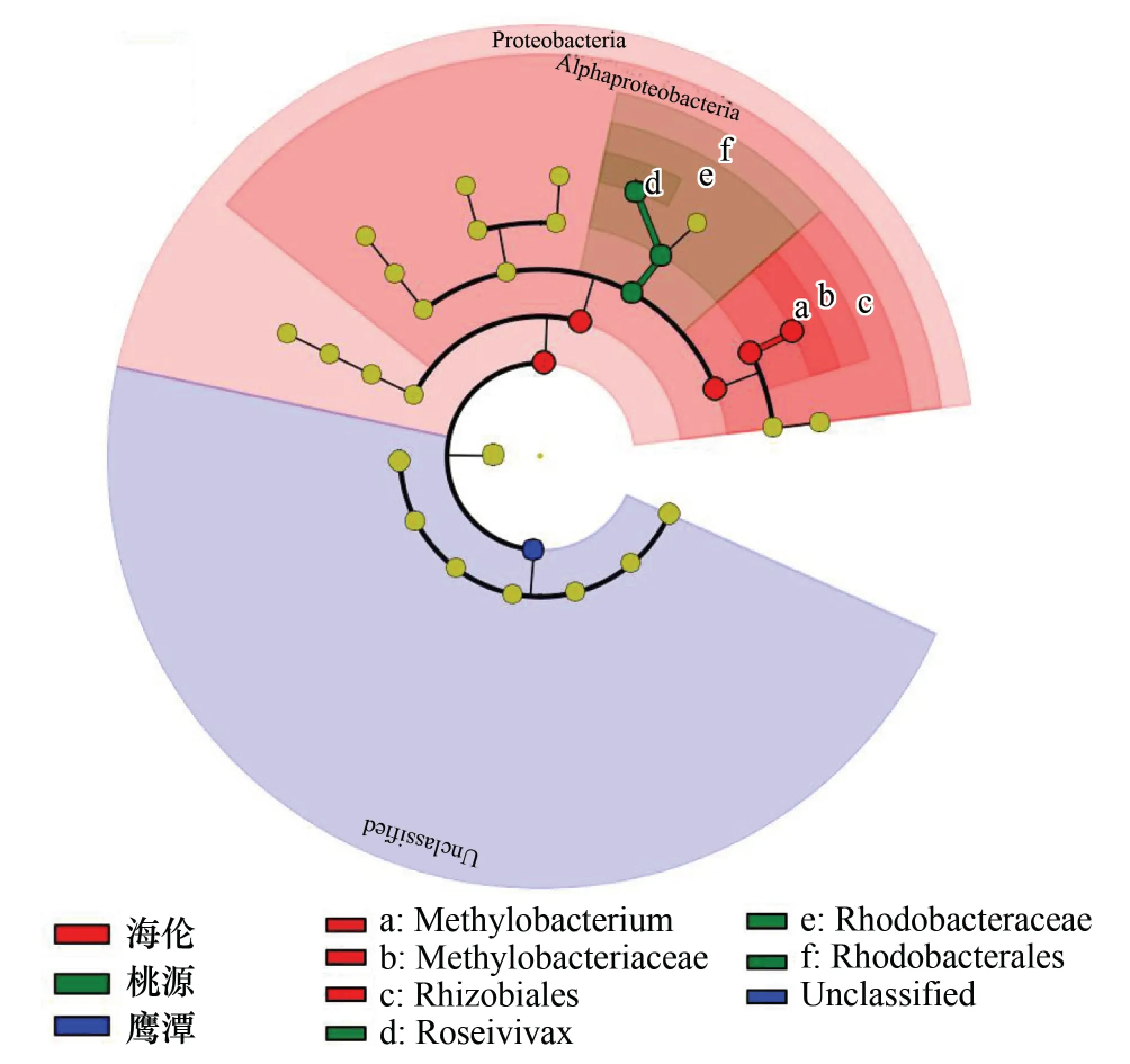
图5 8个地区水稻土中紫色光合细菌群落组成的最小判别效应分析Fig.5 Cladogram analysis showing the community structure about purple photosynthetic bacteria
综上所述,本研究发现水稻土中含有丰富的紫色光合细菌资源,主要为紫色非硫细菌。8个地区差异分析发现pH和纬度(温度)是影响水稻土中紫色光合细菌群落分异的2个关键因素。此外,本研究还发现水稻土中还有很多尚未发现的紫色光合细菌物种。由于PCR-DGGE指纹图谱只能半定量的表征物种的多样性,靶标土壤中少数优势微生物,所以今后还可以在更高的分辨率和更大的基因通量下深入的研究水稻土中紫色光合细菌的空间分异规律。
[1] Madigan M T. Anoxygenic phototrophic bacteria from extreme environments. Photosynthesis Research, 2003, 76(1/3): 157- 171.
[2] Pfennig N. Photosynthetic bacteria. Annual Review of Microbiology, 1967, 21: 285- 324.
[3] Madigan M T. Photocatabolism of acetone by nonsulfur purple bacteria. FEMS Microbiology Letters, 1990, 71(3): 281- 285.
[4] Van Gemerden H, Beeftink H H. Ecology of phototrophic bacteria // Ormerod J G, ed. The Phototrophic Bacteria. Berkeley: University of California Press, 1983: 146- 185.
[5] Madigan M T. Microbiology of nitrogenxation in photosynthetic bacteria // Blankenship R E, Madigan M T, Bauer C E, eds. Anoxygenic Photosynthetic Bacteria. Dordrecht, The Netherlands: Kluwer Academic Publishers, 1995: 915- 928.
[6] Hu Y H, Du H L, Jiao N Z, Zeng Y H. Abundant presence of the γ-like ProteobacterialpufMgene in oxic seawater. Fems Microbiology Letters, 2006, 263(2): 200- 206.
[7] Jiao N Z, Zhang Y, Zeng Y H, Hong N, Liu R L, Chen F, Wang P X. Distinct distribution pattern of abundance and diversity of aerobic anoxygenic phototrophic bacteria in the global ocean. Environmental Microbiology, 2007, 9(12): 3091- 3099.
[8] Karr E A, Sattley W M, Jung D O, Madigan M T, Achenbach L A. Remarkable diversity of phototrophic purple bacteria in a permanently frozen Antarctic lake. Applied and Environmental Microbiology, 2003, 69(8): 4910- 4914.
[9] Feng Y Z, Grogan P, Caporaso J G, Zhang H Y, Lin X G, Knight R, Chu H Y. PH is a good predictor of the distribution of anoxygenic purple phototrophic bacteria in Arctic soils. Soil Biology and Biochemistry, 2014, 74: 193- 200.
[10] 冯有智, 林先贵, 王一明. 紫色非硫细菌固体石蜡双层平板培养法. 微生物学通报, 2011, 38(9): 1435- 1442.
[11] Harada N, Nishiyama M, Otsuka S, Matsumoto S. Effects of inoculation of phototrophic purple bacteria on grain yield of rice and nitrogenase activity of paddy soil in a pot experiment. Soil Science and Plant Nutrition, 2005, 51(3): 361- 367.
[12] Byrne J M, Klueglein N, Pearce C, Rosso K M, Appl E, Kappler A. Redox cycling of Fe (II) and Fe (III) in magnetite by Fe-metabolizing bacteria. Science, 2015, 347(6229): 1473- 1476.
[13] Feng Y Z, Lin X G, Zhu J G, Jia Z J. A phototrophy-driven microbial food web in a rice soil. Journal of Soils and Sediments, 2011, 11(2): 301- 311.
[14] 王秀红. 我国水平地带性土壤中有机质的空间变化特征. 地理科学, 2001, 21(1): 19- 23.
[15] 李执强, 汪景宽, 曹宏杰, 李双异, 于树. 水热梯度变化及不同施肥处理对东北地区土壤轻组有机碳氮的影响. 土壤通报, 2009, 40(5): 1014- 1017.
[16] 俎千惠, 王保战, 郑燕, 贾仲君, 林先贵, 冯有智. 我国8个典型水稻土中产甲烷古菌群落组成的空间分异特征. 微生物学报, 2014, 54(12): 1397- 1405.
[17] 鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科技出版社, 2000: 296- 316.
[18] Feng Y Z, Lin X G, Wang Y M, Zhang J, Mao T T, Yin R, Zhu J G. Free-air CO2enrichment (FACE) enhances the biodiversity of purple phototrophic bacteria in flooded paddy soil. Plant and Soil, 2009, 324(1/2): 317- 328.
[19] Feng Y Z, Xu Y P, Yu Y C, Xie Z B, Lin X G. Mechanisms of biochar decreasing methane emission from Chinese paddy soils. Soil Biology and Biochemistry, 2012, 46: 80- 88.
[20] Waidner L A, Kirchman D L. Aerobic anoxygenic photosynthesis genes and operons in uncultured bacteria in the Delaware River. Environmental Microbiology, 2005, 7(12): 1896- 1908.
[21] Lauber C L, Strickland M S, Bradford M A, Fierer N. The influence of soil properties on the structure of bacterial and fungal communities across land-use types. Soil Biology and Biochemistry, 2008, 40(9): 2407- 2415.
[22] Hayashi H, Nihei T, Ono M, Tsuneda S, Hiratat A, Sasaki H. Rapid recovery of bacterial cells from a stable dispersion by heterocoagulation to a fibrous collector. Journal of Colloid and Interface Science, 2001, 243(1): 109- 115.
[23] Martinez R E, Gardés E, Pokrovsky O S, Schott J, Oelkers E H. Do photosynthetic bacteria have a protective mechanism against carbonate precipitation at their surfaces? Geochimica et Cosmochimica Acta, 2010, 74(4): 1329- 1337.
[24] Bosak T, Greene S E, Newman D K. A likely role for anoxygenic photosynthetic microbes in the formation of ancient stromatolites. Geobiology, 2007, 5(2): 119- 126.
[25] Noll M, Klose M, Conrad R. Effect of temperature change on the composition of the bacterial and archaeal community potentially involved in the turnover of acetate and propionate in methanogenic rice field soil. FEMS Microbiology Ecology, 2010, 73(2): 215- 225.
[26] Peng J J, Lü Z, Rui J P, Lu Y H. Dynamics of the methanogenic archaeal community during plant residue decomposition in an anoxic rice field soil. Applied and Environmental Microbiology, 2008, 74(9): 2894- 2901.
Spatial shifts in purple photosynthetic bacterial community composition in paddy soils along the latitude
ZU Qianhui1,2, WANG Baozhan1, JIA Zhongjun1, LIN Xiangui1, FENG Youzhi1,*
1StateKeyLaboratoryofSoilandSustainableAgriculture,InstituteofSoilScience,ChineseAcademyofSciences,Nanjing210008,China2GraduateUniversityofChineseAcademyofSciences,Beijing100049,China
Purple phototrophic bacteria (PPB) are a diverse group of Proteobacteria that can use sulfur, hydrogen, iron, or organic compounds as electron donors during light harvesting reactions. Because of their metabolic diversity, PPBs are distributed in a wide variety of ecosystems. They participate in, as well as drive, the processes of the carbon cycle in ecosystems. Among terrestrial ecosystems, paddy soils are a preferred PPB habitat. However, gaps exist in our knowledge about PPB community composition in paddy soil and spatial shifts across a large geologic scale. We studied the spatial distribution of PPB in nine representative paddy sites, along a large latitudinal gradient ranging from 28.38° N to 47.43° N in China, using PCR-DGGE fingerprinting and phylogenetic analyses. Mechanisms for the spatial shifts in community composition were further elucidated by canonical correspondence analyses and cladograms. It was found that the dominant paddy PPB guilds are purple non-sulfur bacteria, affiliated with alpha and beta branches of Proteobacteria. Soil pH and air temperature (latitude) were the main environmental triggers that influenced PPB community composition in paddy soil. This knowledge will help us to better understand the key species in paddy soil. In addition, this information will contribute to the comprehensive understanding of spatial shifts in the transformation of organic matter along the Chinese latitudinal gradient.
paddy soil; Purple photosynthetic bacteria; PCR-DGGE fingerprinting;canonical correspondence analysis; spatial shifts in community composition
国家自然科学基金重点项目(41430859);国家自然科学基金项目(41271256);中国科学院战略性先导科技专项(B类)(XDB15020104);土壤与农业可持续发展国家重点实验室优秀青年人才项目(212000009)
2015- 04- 21;
日期:2016- 03- 03
10.5846/stxb201504210819
*通讯作者Corresponding author.E-mail: yzfeng@issas.ac.cn
俎千惠,王保战,贾仲君,林先贵,冯有智.水稻土中紫色光合细菌沿纬度梯度的空间分异特征.生态学报,2016,36(21):6730- 6737.
Zu Q H, Wang B Z, Jia Z J, Lin X G, Feng Y Z.Spatial shifts in purple photosynthetic bacterial community composition in paddy soils along the latitude.Acta Ecologica Sinica,2016,36(21):6730- 6737.

