莱茵衣藻IFT139蛋白抗原的原核表达、纯化及多克隆抗体的制备
田 伟,董 彬,李镇芳,孟德梅,,樊振川,
(1. 食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津 300457;2. 天津科技大学新农村发展研究院,天津 300457)
莱茵衣藻IFT139蛋白抗原的原核表达、纯化及多克隆抗体的制备
田 伟1,董 彬1,李镇芳1,孟德梅1,2,樊振川1,2
(1. 食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津 300457;2. 天津科技大学新农村发展研究院,天津 300457)
IFT139是莱茵衣藻(Chlamydomonas reinhardtii)纤毛内运输蛋白IFT复合物A中的一个重要组分.其编码基因的突变、缺失或沉默将会影响纤毛正常的组装和解聚,进而导致纤毛病的产生.为深入研究IFT139的作用机制,本实验首先PCR获得ift139 5′端458 bp的EST片断,成功构建了pMAL-c2-ift139与pET-28a(+)-ift139重组质粒.然后将重组质粒转入大肠杆菌(E. coli)BL21(DE3),通过IPTG诱导表达,分别得到相对分子质量为6.0×104和2.5×104的重组MBP/HIS-IFT139融合蛋白.进一步将亲和纯化的MBP-IFT139融合蛋白(纯度95%,以上),免疫新西兰大白兔获得抗血清,间接ELISA法测得血清效价为1∶256,000.最后将抗血清依次经Protein A和硝酸纤维素膜纯化后,用Western blot检测抗体特异性,结果显示所制备抗体能够正确特异性识别莱茵衣藻中的IFT139,从而为IFT139作用机制的阐明和纤毛相关疾病的研究奠定了重要基础.
莱茵衣藻;纤毛;IFT139;表达纯化;多克隆抗体
莱茵衣藻(Chlamydomonas reinhardtii)是一种单细胞真核微藻,由一个直径约为8,µm的细胞和两根长度约为12,µm的纤毛组成.纤毛是一种细胞表面突起较为保守的细胞器,主要由细胞微管组成[1].纤毛主要为莱茵衣藻提供动力使其运动,同时为其逃避敌害、寻觅食物等提供了便利.组装纤毛所需要的蛋白均在莱茵衣藻细胞内合成,之后通过纤毛内运送蛋白(intraflagellar transport,IFT)运进纤毛,合成纤毛所需物质[2-3].
IFT复合物由IFT-A和IFT-B两个亚蛋白复合物组成[4],复合物B负责从纤毛基体到顶端的顺向运输,依靠驱动蛋白-2(kinesin-2);复合物A负责从顶端到基部的逆向运输,利用的是细胞质动力蛋白(cytoplasmic dynein)[5-7].顺向运输的过程中,IFT如同火车车厢般将合成纤毛所需要的蛋白组分运送到纤毛顶端,合成纤毛相关结构,进行纤毛的组装.逆向过程是将解聚的纤毛组分或周转蛋白运出纤毛,从而完成一个循环过程[8-10].莱茵衣藻作为一种典型的模式生物,与人类细胞的纤毛非常相近,所以,IFT139抗体的制备不仅可用于研究衣藻纤毛的相关功能,也可用于研究人体内纤毛的结构及功能.多项研究表明,纤毛中基因的突变或缺失,会造成纤毛生成缺陷,从而导致纤毛相关疾病的产生[11-14].
IFT139作为一种纤毛内运输蛋白,是IFT-A复合物中的重要组分.目前已有研究表明人类纤毛基因ift139的纯合错义突变会导致局灶节段性肾小球疾病,造成肾小球基膜增厚,肾小管萎缩,颗粒物质的积累等症状[15-16],然而对于IFT139作用机制目前仍没有清晰的认识.本研究对于IFT139在大肠杆菌中的表达、纯化及其多克隆抗体的制备,对于今后研究IFT139在纤毛中的作用及IFT139与其他蛋白复合物的相互作用提供了理论基础,也对于纤毛病的诊断提供了有利的方法基础.
1 材料与方法
1.1 菌株、质粒及实验动物
大肠杆菌(E. coli)XL1-blue与BL21(DE3)菌株,pMAL-c2-acbp与 pET-28a(+)-acbp质粒均是本实验室保存;pBlu-ift139由中科院水生所黄开耀老师实验室所赠;实验动物为雄性新西兰大白兔,购自天津欧阳实验种兔公司.
1.2 主要试剂
质粒小提试剂盒、琼脂糖凝胶DNA回收试剂盒、DNA产物纯化试剂盒、氨苄青霉素、卡那霉素、IPTG和胰蛋白胨,北京索莱宝生物科技有限公司;限制性内切酶、T4,DNA连接酶、pfu DNA聚合酶和蛋白Marker,加拿大Fermentas公司;DNA Marker,北京全式金生物技术有限公司;亲和层析填料,GE公司;AP(碱性磷酸酶)标记的羊抗兔抗体IgG和TMB (3,3',5,5'-四甲基联苯胺)底物显色试剂盒,北京康为世纪生物科技有限公司;弗氏完全和不完全佐剂,美国Sigma公司;其他常用试剂均为国产分析纯.
1.3 PCR扩增ift39基因
位于pBlu-ift139载体上的目的基因ift139,是属于全基因序列5′端458,bp的EST片段,根据NCBI中莱茵衣藻ift139的基因序列及原核表达载体图谱,进行PCR引物设计.上游引物加入BamHⅠ酶切位点:5′-ATGGATCCATGGCGGACAGGGTACTT-3′,下游引物加入HindⅢ酶切位点:5′-ATAAGCTTCTG ATGATGATCCAGCCCA-3′,加粗斜体部分即为引入的酶切序列,引物设计后送往北京奥科鼎盛生物科技有限公司合成.利用含ift139基因的重组质粒pBluift139为模板,50,µL的反应体系进行PCR扩增,反应条件为:95,℃ 1,min;95,℃ 30,s、57,℃ 30,s、72,℃40,s,30个循环;72,℃ 10,min.取2,µL PCR产物进行0.8%,的琼脂糖凝胶电泳分析[17-18].
1.4 重组质粒的构建
将PCR产物和实验室现存质粒pMAL-c2-acbp、pET-28a(+)-acbp使用BamHⅠ和HindⅢ于37,℃双酶切3,h,回收目的片段和对应载体,然后分别将获得黏性末端的PCR产物和载体在T4,DNA 连接酶的作用下重组质粒,4,℃连接过夜,转化.分别在对应抗生素的培养基平板上筛选单克隆,提取重组质粒并双酶切验证,质粒测序由北京奥科鼎盛生物科技有限公司完成[19-20].
1.5 融合蛋白的表达与纯化
1.5.1 融合蛋白的表达
采用CaCl2转化法将重组质粒pMAL-c2-ift139、pET-28a(+)-ift139转入BL21,在对应抗生素的平板上挑取单克隆,37,℃过夜摇菌培养,次日以1∶20稀释继续培养,待1,h后进行A600的测定.A600=0.6~0.8时,28,℃、0.2,mmol/L的IPTG诱导表达6,h,于4,℃、3,900,r/min离心10,min,收集菌体,PBS洗涤3次后,置于冰上超声破碎1,h.最后将破碎后的全蛋白、离心得到的上清液、用PBS处理后的沉淀按照一定的顺序等量上样,采用SDS-PAGE电泳分析融合蛋白表达情况[21-23].
1.5.2 MBP-IFT139融合蛋白的纯化
将pMAL-c2-ift139扩大培养获得大量菌液,经超声破碎,12,000,r/min离心10,min得到上清液,与MBP凝胶过夜结合,未结合的液体流出.然后用磷酸盐缓冲液(PBS,pH 7.5)清洗杂蛋白3次,最后用含10%,麦芽糖的洗脱液将目标蛋白从直链淀粉树脂上竞争性地洗脱下来.取样进行SDS-PAGE电泳分析蛋白纯度[24].
1.5.3 HIS-IFT139融合蛋白的纯化
将pET-28a(+)-ift139扩大培养获得大量菌液,经超声破碎,12,000,r/min离心10,min得到沉淀.用含20,mmol/L咪唑的漂洗缓冲液(含1,mol/L尿素)洗涤沉淀3次,用结合缓冲液(含8,mol/L尿素)将沉淀溶解3,h后,于4,℃、12,000,r/min离心10,min取上清液.然后与Ni柱凝胶过夜结合,流出液体后,分别用含20、40、80,mmol/L咪唑的漂洗缓冲液(含8,mol/L尿素)清洗杂蛋白3次,用含500,mmol/L咪唑的洗脱缓冲液(含8,mol/L尿素)洗脱目的蛋白,取样进行SDS-PAGE电泳分析蛋白纯度[25].
1.6 多克隆抗体的制备及效价的测定
1.6.1 抗血清的制备
实验动物是3月龄、体质量在1.5~2,kg的雄性新西兰大白兔,喂养1周后进行第1次免疫,取1,mol/L抗原1,mL与同剂量的弗式完全佐剂进行充分乳化后,采用背部皮下多点注射,初次免疫之前取血作为后续实验的阴性对照.之后每隔10~14,d进行第2~5次加强免疫,使用弗氏不完全佐剂,最后以心脏穿刺的方法获得全血,将血液室温静置1,h或4,℃静置过夜,于4,℃、3,000,r/min离心10,min,清澈透明的上清液即为抗血清,如有红色溶血进入,可再次离心取上清液,然后于-80,℃分装保存[26-27].
1.6.2 抗血清效价的测定
采用间接ELISA法测定效价.将经包被液稀释的抗原MBP-IFT39包被于酶标板上,每孔1,µg,4,℃包被过夜;加入0.5%,脱脂乳粉37,℃封闭1,h;加入经PBS溶液(pH 7.5)梯度稀释的兔血清,37,℃孵育1,h;加入经PBS溶液(pH 7.5)稀释20,000倍的HRP标记的羊抗兔二抗,37,℃孵育30,min;加入TMB显色液,室温避光显色25~30,min;最后加入0.5,mol/L H2SO4终止液,终止反应,在450,nm 波长下用酶标仪测定吸光度[28-29].
1.7 多克隆抗体的纯化及特异性分析
1.7.1 Protein A纯化抗体
将填料(Protein A Sepharose)与亲和层析柱按照其说明分别进行前处理后,加入经Binding Buffer稀释的抗血清(1,mL抗血清+1,mL Binding Buffer),充分结合,用Binding Buffer冲洗层析柱,约1,h后杂蛋白峰趋于水平状态,加入0.1,mol/L、pH 2.7的甘氨酸洗脱液进行洗脱,收集抗体,为了保证酸不稳定的IgG,添加1,mol/L、pH 9.0的Tris-HCl以中和洗脱下来的抗体,使pH 为7.0.将抗体于-20,℃暂时保存以备下一步纯化[30-31].
1.7.2 膜纯化抗体
取2,mg另一标签的融合蛋白HIS-IFT139进行SDS-PAGE蛋白电泳;电泳结束后,凝胶转移至NC膜上;将膜进行丽春红染色10,min,剪下目的条带,用TBST溶液(100,mL 10× TBS溶液,895,mL去离子水,5,mL 10%,的吐温20)洗膜3次,至膜上的颜色全部褪去;加入3,mL的5%,的脱脂乳粉室温封闭1,h;加入上步纯化的抗体(≥3,mg)进行孵育,4,℃摇床过夜;用TBST溶液洗膜3次后加入0.1,mol/L、pH 2.7的甘氨酸洗脱液进行洗脱,收集抗体.测定浓度后加入甘油至体积分数为30%,于-20,℃短期保存,-80,℃长期保存再加入叠氮化钠至终质量浓度为0.3,g/L[32].
1.7.3 抗体特异性检测
采用蛋白免疫印迹(Western blot)方法.将微藻样品CW92经过处理后[33]进行SDS-PAGE蛋白电泳,转至NC膜上,加入5%,的脱脂乳粉进行室温封闭1,h后,分别以1∶100和1∶500的稀释比例加入纯化后的抗体作为一抗,室温孵育1,h,以1∶2,500的稀释比例加入AP标记的羊抗兔二抗,室温孵育1,h,最后加入显色液进行显色,凝胶成像仪观察[34].
2 结果与分析
2.1 重组质粒载体的鉴定
以质粒pBlu-ift139为模板进行PCR,获得约为458,bp的基因片段,与预期大小相符合,如图1(a)所示;重组质粒pMAL-c2-ift139、pET-28a(+)-ift139经BamHⅠ和HindⅢ双酶切之后,分别得到对应的载体和458,bp的片段,与目的基因大小相一致(图1(b)、(c));重组质粒的测序结果经比对后与NCBI中ift139基因序列一致,证明重组质粒构建成功.
2.2 融合蛋白的表达与纯化
2.2.1 融合蛋白的表达
pMAL-c2-ift139经IPTG诱导表达的重组蛋白MBP-IFT139,相对分子质量约为6.0×104,与预期相符(图2),溶于上清液.
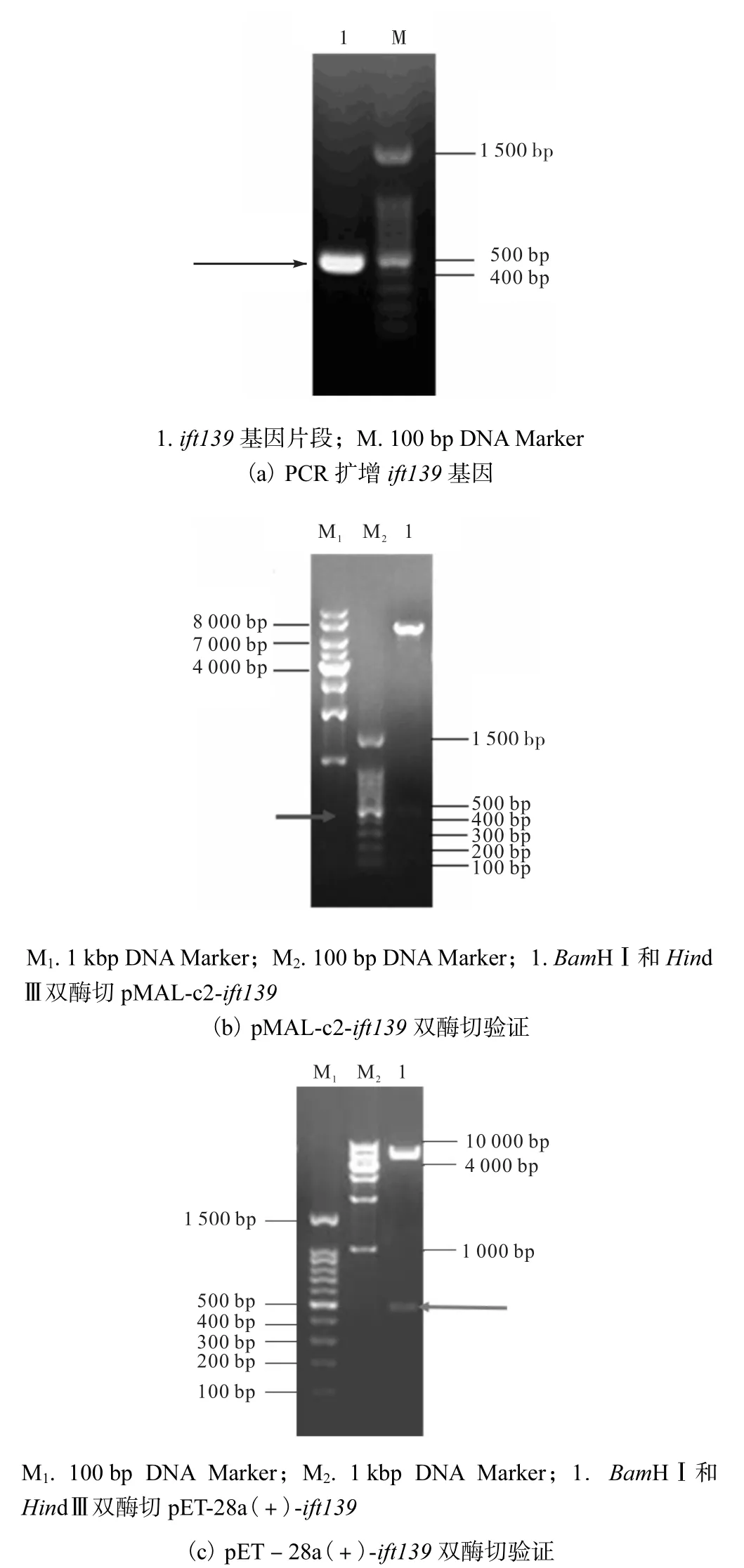
图1 ift139的PCR扩增及重组质粒的双酶切验证Fig. 1 PCR amplification of ift139 and identification of recombined plasmids with double restriction enzyme digestion
pET-28a(+)-ift139经IPTG诱导表达的重组蛋白HIS-IFT139,相对分子质量约为2.0×104,与预期相符(图3),以包涵体的形式存在.
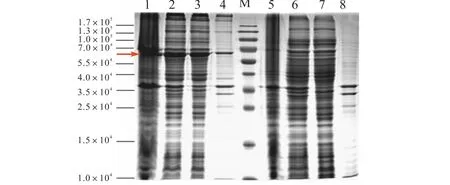
图2 SDS-PAGE检测重组表达载体pMAL-c2-ift139在E.coli BL21(DE3)中的表达Fig. 2SDS-PAGE analysis of the expression of recombined vector pMAL-c2-ift139 in E.coli BL21(DE3)

图3 SDS-PAGE检测重组表达载体pET-28a(+)-ift139在E.coli BL21(DE3)中的表达Fig. 3SDS-PAGE analysis of the expression of recombined vector pET-28a(+)-ift139 in E.coli BL21 (DE3)
2.2.2 融合蛋白的纯化
MBP-IFT139和HIS-IFT139融合蛋白的亲和纯化结果如图4所示.
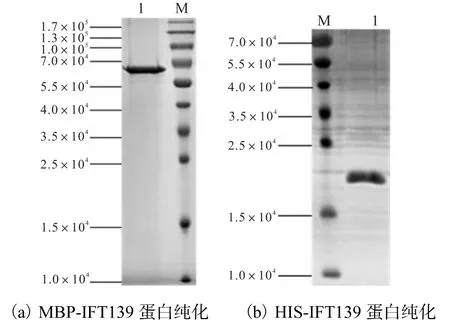
图4 MBP-IFT139和HIS-IFT139融合蛋白的亲和纯化Fig. 4Affinity purification of MBP-IFT139 and HISIFT139
MBP-IFT139与HIS-IFT139融合蛋白分别经MBP和HIS亲和层析柱纯化后得到相对分子质量约为6.0×104、2.0×104的目标条带,分子质量大小均与预期相符,对应质量浓度分别为1.3、1.1,mg/ mL.MBP-IFT139蛋白纯度达95%,以上,可作为抗原进行免疫兔子,HIS-IFT139上面有些杂带,但是不影响切膜纯化抗体.
2.3 多克隆抗体的制备
2.3.1 抗血清效价的测定
用纯化得到的MBP-IFT139融合蛋白免疫新西兰大白兔,经过5次免疫之后,在耳缘静脉少量采血,利用间接ELISA法测定抗血清的效价如图5所示,免疫抗血清A450与阴性对照血清A450之比大于等于2.1,即为阳性.所以,可得最高稀释倍数1∶256,000为抗血清的效价.
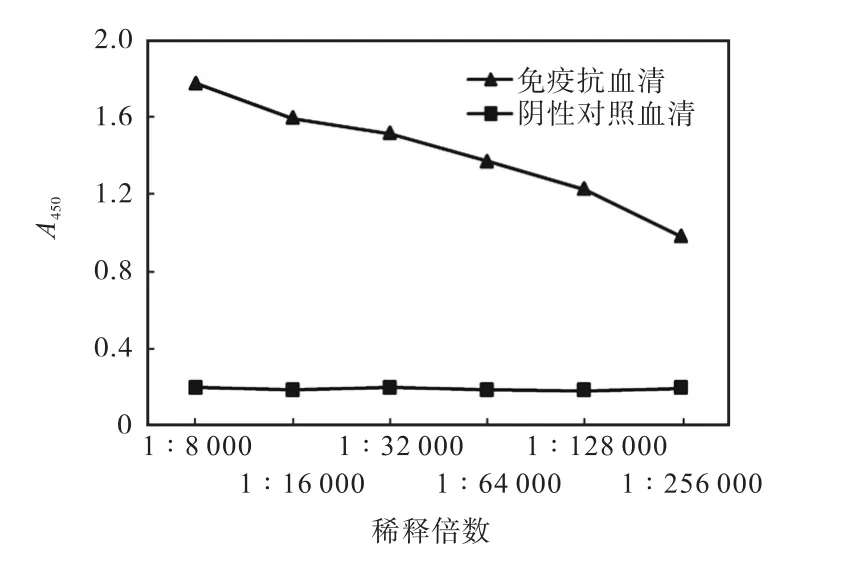
图5 抗血清效价的ELISA法测定Fig. 5 Determination of the antiserum titer with ELISA method
2.3.2 抗体的特异性分析
经Protein A纯化得到的IgG抗体,经Western blot初步检测分析发现抗体的特异性较差,又经过硝酸纤维素膜纯化法对抗体进一步纯化,得到的抗体由Western blot检测分析,结果如图6所示.
不同稀释倍数的抗体均可与微藻中的IFT139蛋白(相对分子质量约为1.40×105)特异性结合,形成明显的单一条带且大小与预期相符合.这表明多克隆抗体成功制备.

图6 Western blot 检测IFT139抗体的特异性Fig. 6 Specificity analysis of IFT139 polyclonal antibody with Western blot
3 讨 论
纤毛不仅是莱茵衣藻重要的组成部分,还分布于哺乳动物的多个器官和组织中,调控着动物的生长及发育.纤毛内基因的突变或蛋白缺失都将会对动物的生长及生理造成一定的影响,从而导致各种纤毛相关疾病的出现.像与纤毛运动功能相关的疾病:原生纤毛不动综合征、呼吸道感染、生殖功能降低、输卵管异常、内脏移位等[13];与纤毛感觉功能相关的疾病:视觉系统异常造成的视力下降或完全失明、听觉系统中纤毛的结构变化导致听力下降或失聪、嗅觉不灵敏等[14];与信号传导功能有关的疾病:巴德毕氏综合症(BBS),像多指症、肥胖症、视力下降、精神呆滞等[35-37].
本研究中ift139基因的突变、沉默等都将会对IFT139蛋白的合成造成一定的影响,继而可能会造成纤毛的组装缺陷,最终导致肾消耗病和窒息性胸营养不良综合症等疾病[15-16].在IFT-B如IFT80、IFT46等蛋白进行免疫共沉淀等实验研究中,IFT139常作为IFT-A中的重要组分被对比使用.然而,对于IFT139的研究还有很多未知和值得探讨的东西,它在纤毛中具体有哪些作用、其编码基因的突变或缺失会导致哪些疾病等内容均不清晰.本实验从PCR扩增目的基因ift139开始,成功构建了两种原核表达载体,通过IPTG的诱导表达得到重组蛋白,并进一步纯化抗原并免疫动物得到高效价的抗血清,然后经过抗体的两步纯化及特异性分析验证,成功获得了抗MBP-IFT139融合蛋白的多克隆抗体,对于今后研究IFT139在纤毛中的作用及IFT139与其他蛋白复合物共同作用提供了研究基础,也对纤毛病的进一步深层次研究提供了有利支持.
[1] Cole D G. Intraflagellar transport in the unicellular green alga,Chlamydomonas reinhardtii[J]. Protist,2003,154(2):181-191.
[2] 谢传晓,韩伟,余增亮. 模式生物衣藻及其研究进展[J]. 遗传,2003,25(3):350-354.
[3] Scholey J M. Intraflagellar transport[J]. Annual Review of Cell and Developmental Biology,2003,19:423-443.
[4] Williamson S M,Silva D A,Richey E,et al. Probing the role of IFT particle complex A and B in flagellar entry and exit of IFT-dynein in Chlamydomonas[J]. Proto-plasma,2012,249(3):851-856.
[5] Lechtreck K F,Luro S,Awata J,et al. HA-tagging of putative flagellar proteins in Chlamydomonas reinhardtii identifies a novel protein of intraflagellar transport complex B[J]. Cell Motility and the Cytoskeleton,2009,66(8):469-482.
[6] Awan A,Bernstein M,Hamasaki T,et al. Cloning and characterization of Kin5,a novel Tetrahymena ciliary kinesinⅡ[J]. Cell Motility and the Cytoskeleton,2004,58(1):1-9.
[7] Pan J,Snell W J. Kinesin II and regulated intraflagellar transport of Chlamydomonas aurora protein kinase[J]. Journal of Cell Science,2003,116(11):2179-2186.
[8] Wood C R,Wang Z,Diener D,et al. IFT proteins accumulate during cell division and localize to the cleavage furrow in Chlamydomonas[J]. PLoS One,2012,7(2):e30729.
[9] Wang Z,Fan Z C,Williamson S M,et al. Intraflagellar transport(IFT)protein IFT25 is a phosphoprotein component of IFT complex B and physically interacts with IFT27 in Chlamydomonas[J]. PLoS One,2009,4(5):e5384.
[10] Cole D G. The intraflagellar transport machinery of Chlamydomonas reinhardtii[J]. Traffic,2003,4(7):435-442.
[11] Iomini C,Li L,Esparza J M,et al. Retrograde intraflagellar transport mutants identify complex A proteins with multiple genetic interactions in Chlamydomonas reinhardtii[J]. Genetics,2009,183(3):885-896.
[12] Gerdes J M,Davis E E,Katsanis N. The vertebrate primary cilium in development,homeostasis,and disease [J]. Cell,2009,137(1):32-45.
[13] 曹木青,潘俊敏. 纤毛及纤毛相关疾病研究进展[J].中国细胞生物学学报,2012,34(9):849-856.
[14] 潘俊敏. 衣藻纤毛与纤毛相关疾病[J]. 中国科学,2008,38(5):399-409.
[15] Huynh Cong E,Bizet A A,Boyer O,et al. A homozygous missense mutation in the ciliary gene TTC21B causes familial FSGS[J]. Journal of the American Society of Nephrology,2014,25(11):2435-2443.
[16] Davis E E,Zhang Q,Liu Q,et al. TTC21B contributes both causal and modifying alleles across the ciliopathy spectrum[J]. Nature Genetics,2011,43(3):189-196.
[17] 陈春琳,刘祥,俱雄. 溶藻弧菌外膜蛋白OmpK的原核表达及多克隆抗体制备[J]. 西北农林科技大学学报,2015,43(7):1-8.
[18] 羊扬,厚华艳,郁磊,等. 大肠杆菌 K99 菌毛 fan 操纵子的克隆、表达及活性[J]. 微生物学报,2012,52(12):1524-1530.
[19] 向斌,周智广,黄干. 人羧基肽酶H原核表达载体的构建及其应用[J]. 中国糖尿病杂志,2007,15(2):84-86.
[20] 李骅,胡嘉,李艳君,等. 人LC3蛋白在大肠杆菌中的表达纯化及其抗体的制备与鉴定[J]. 细胞与分子免疫学杂志,2012,28(5):517-519.
[21] 徐秋芳,陈倪. 灰飞虱原肌球蛋白的基因克隆、原核表达及多克隆抗体制备[J]. 中国农业科学,2014,47(19):3791-3798.
[22] Wu Z,Wang W,Li Y,et al. Development of polyclonal antibodies against nucleocapsid protein of watermelon silver mottle virus and their application to diagnostic[J]. Acta Virologica,2014,58(2):167-172.
[23] Liu F,Wu X,Li L,et al. Expression,purification and characterization of two truncated peste des petits ruminants virus matrix proteins in Escherichia coli,and production of polyclonal antibodies against this protein[J]. Protein Expression and Purification,2013,91(1):1-9.
[24] Duplay P,Hofnung M. Two regions of mature periplasmic maltose-binding protein of Escherichia coli involved in secretion[J]. Journal of Bacteriology,1988,170(10):4445-4450.
[25] Li Y,Wang J,Yang J,et al. Recombinant expression,purification and characterization of antimicrobial peptide ORBK in Escherichia coli[J]. Protein Expression and Purification,2014,95(5):182-187.
[26] 查宏贤,刘罡,张晨,等. 家蚕丝氨酸蛋白酶抑制剂4(serpin-4)的基因克隆、原核表达和多克隆抗体制备[J]. 昆虫学报,2011,54(6):642-647.
[27] Kapoor R,Mandal B,Paul P K,et al. Production of cocktail of polyclonal antibodies using bacterial expressed recombinant protein for multiple virus detection [J]. Journal of Virological Methods,2014,196(2):7-14.
[28] Jiang W,Liu X,Wu D,et al. A simple,rapid one-step ELISA using antibody-antibody complex[J]. Biotechnology and Applied Biochemistry,2015,62(1):126-131.
[29] Limsuwanchote S,Wungsintaweekul J,Yusakul G,et al. Preparation of a monoclonal antibody against notoginsenoside R1,a distinctive saponin from Panax notoginseng,and its application to indirect competitive ELISA [J]. Planta Medica,2014,80(4):337-342.
[30] 张明娟,张美程,朱参战,等. 抗钠泵α,2亚单位截断性片段多肽抗体的制备与鉴定[J]. 南方医科大学学报,2015,35(2):168-173.
[31] Reusch D,Haberger M,Selman M H,et al. Highthroughput work flow for IgG Fc-glycosylation analysis of biotechnological samples[J]. Analytical Biochemistry,2013,432(2):82-89.
[32] 骆爱玲,梁峥. 用硝酸纤维素膜亲和法纯化抗体[J].植物学报,1997,39(6):534-536.
[33] Pazour G J,Wilkerson C G,Witman G B. A dynein light chain is essential for the retrograde particle movement of intraflagellar transport(IFT)[J]. Journal of Cell Biology,1998,141(4):979-992.
[34] Sun J,Tu M,Han B,et al. Generation and characterization of rabbit polyclonal antibodies against Vasohibin-2 for determination of its intracellular localization[J]. International Journal of Oncology,2013,43(1):255-261.
[35] Pazour G J,Rosenbaum J L. Intraflagellar transport and cilia-dependent diseases[J]. Trends in Cell Biology,2002,12(12):551-555.
[36] Bisgrove B W,Yost H J. The roles of cilia in developmental disorders and disease[J]. Development,2006,133(21):4131-4143.
[37] 柳林,纪伟. 纤毛疾病和与之相关的基因[J]. 现代生物医学进展,2012,12(2):373-376.
责任编辑:郎婧
Prokaryotic Expression,Purification and Polyclonal Antibody Preparation of Chlamydomonas reinhardtii IFT139 Protein Antigen
TIAN Wei1,DONG Bin1,LI Zhenfang1,MENG Demei1,2,FAN Zhenchuan1,2
(1.Key Laboratory of Food Nutrition and Safety,Ministry of Education,College of Food Engineering and Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China;2.Institute for New Rural Development ,Tianjin University of Science & Technology,Tianjin 300457,China)
IFT139 is a key component of the intraflagellar transport(IFT)complex A in Chlamydomonas reinhardtii.Mutations,deletions or silence of ift139 gene can affect cilia assembly and depolymerization,and thus lead to ciliopathy.To further investigate the role of IFT139 in ciliogenesis,ift139 5′-458 bp EST cDNA fragment was firstly amplified and the recombined plasmids pMAL-c2-ift139 and pET-28a(+)-ift139 were constructed and transferred into Escherichia coli BL21(DE3).Under IPTG induction,fusion proteins MBP-IFT139 and HIS-IFT139 with a molecular weight of 6.0×104and 2.5×104,respectively,were obtained.The fusion protein MBP-IFT139 was purified by affinity adsorption purification(more than 95%, purity)and then used for immunizing New Zealand white rabbits to produce antiserum.When the titer of antiserum reached 256,000,it was purified by Protein A,and then affinity adsorption purification was followed by nitrocellulose membrane purification procedure.The specificity of polyclonal antibodies was evaluated with Western blot.The result showed that the polyclonal antibody can specifically recognize IFT139.The research has provided an important tool for further clarifying the role of IFT139 in ciliogenesis and cilipathy.
Chlamydomonas reinhardtii;cilia;IFT139;expression and purification;polyclonal antibody
Q786
A
1672-6510(2016)06-0027-07
10.13364/j.issn.1672-6510.20160029
2016-01-24;
2016-04-14
国际遗传工程与生物技术中心(ICGEB)研究资助项目(CRP/CHN15-01)
田 伟(1989—),女,山东人,硕士研究生;
樊振川,教授,fanzhen@tust.edu.cn.

