射波刀联合贝伐单抗治疗复发高级别脑胶质瘤的疗效与安全性分析
康静波,温居一,张新红,方恒虎,张余飞
·临床研究·
射波刀联合贝伐单抗治疗复发高级别脑胶质瘤的疗效与安全性分析
康静波,温居一,张新红,方恒虎,张余飞
目的回顾性对比评价射波刀联合或不联合贝伐单抗治疗复发高级别脑胶质瘤的疗效与安全性。方法2012年3月—2014年12月28例复发高级别脑胶质瘤经射波刀联合贝伐单抗治疗的患者,射波刀治疗剂量为20~37 Gy/4~6 F,贝伐单抗剂量为5 mg/kg、每2周1次。不良反应在治疗期间、治疗后1个月评估;疗效在治疗后3个月评估,随后每间隔3个月评估1次。结果射波刀联合贝伐单抗组治疗后3个月有效率可达86.7%,中位无进展生存期(progression free survival,PFS)7.7个月,平均总生存期达10.9个月;射波刀未联合贝伐单抗组治疗后3个月有效率可达69.2%,中位PFS 4.7个月,平均总生存期达7.5个月。2组未观察到严重不良反应。结论射波刀联合贝伐单抗治疗复发高级别脑胶质瘤对比射波刀单独治疗有较好的疗效、较长的PFS,其神经系统不良反应没有明显增加。
高级别胶质瘤;复发;射波刀;贝伐单抗
放射治疗已被证明是恶性胶质瘤最有效的辅助治疗之一,但内在放射敏感性和周围正常脑组织耐受剂量的限制,在这些肿瘤中可以从中受益是有限的[1-2]。通过提高局部脑肿瘤照射剂量以及使用放射增敏剂治疗,并没有明显延长恶性胶质瘤患者的生存期[3]。恶性胶质瘤是乏氧肿瘤,肿瘤内源性表达缺氧诱导因子-1、血管内皮生长因子(vascular endothelial growth factor,VEGF)和VEGF受体,从而表现出丰富的血管生成[4-7]。贝伐单抗,一种人源化单克隆抗体,通过作用于VEGF达到抑制血管的生成,目前已被美国食品和药品管理局批准用于结直肠癌、非小细胞肺癌、肾细胞癌、复发高级别脑胶质瘤的治疗[8-10]。贝伐单抗已被单独用于或联合伊立替康治疗复发恶性脑胶质瘤[11-13]。
大分割体部立体定向放射治疗(stereotactic body radiation therapy,SBRT)对恶性胶质瘤直接杀伤、抑制作用与贝伐单抗对血管内皮生长因子的抑制作用联合将是恶性胶质瘤的有效治疗策略之一。作者回顾性研究的主要目的是对比评价射波刀联合或不联合贝伐单抗治疗复发高级别脑胶质瘤的疗效与安全性。
1 资料与方法
1.1 临床资料 2012年3月—2014年12月入组病例共计28例,其中射波刀联合贝伐单抗组15例、射波刀组13例。2组患者的年龄、性别、Karnofsky功能状态评分(Karnofsky performance status,KPS)及肿瘤分级、病灶个数、肿瘤大小、既往治疗情况差异均无统计学意义(P>0.05,表1)。
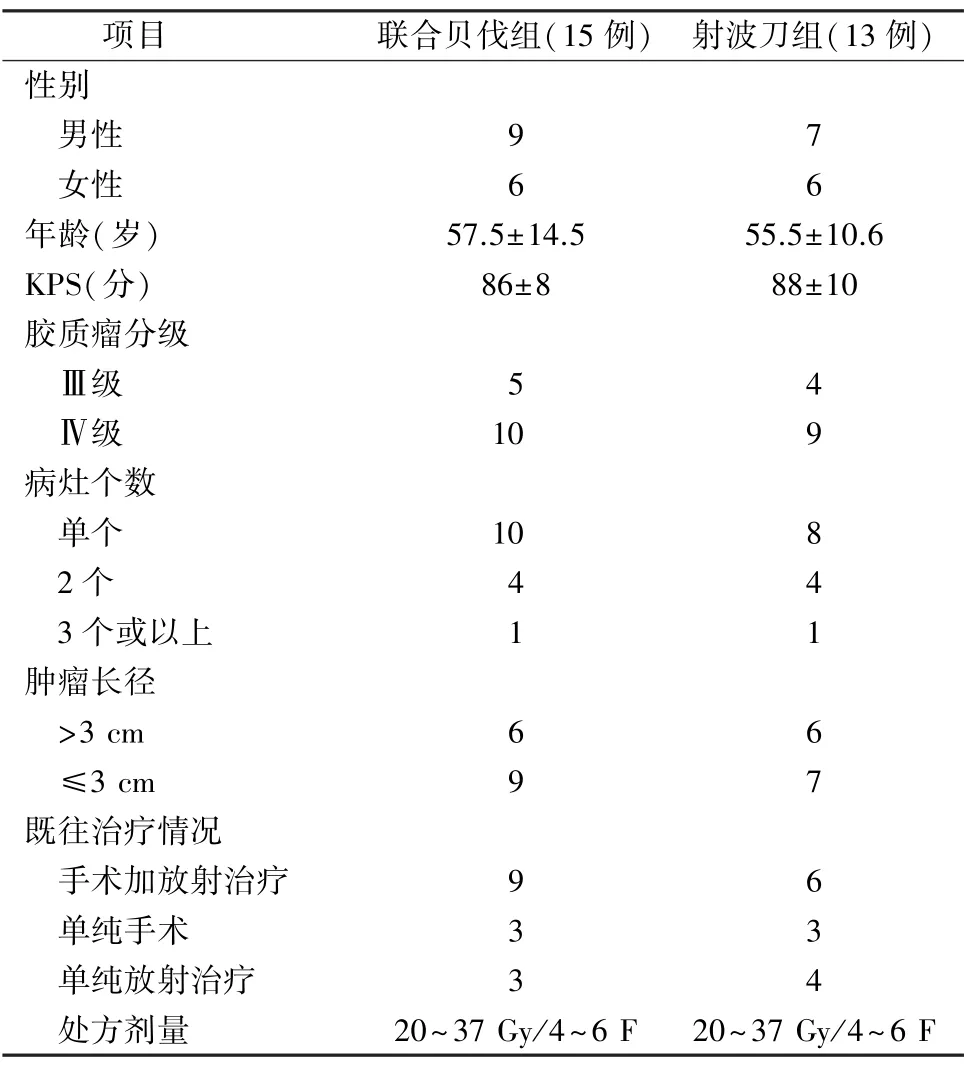
表1 28例病例资料
1.2 纳入与排除标准 纳入标准:①病理诊断明确;②初治经过手术及术后放疗同步替莫唑胺化学治疗标准治疗的复发高级别脑胶质瘤;③仅行过1次放射治疗,且距首次放射治疗时间6个月以上;④KPS>70分;⑤血常规、肝肾功能、心肺功能正常,无严重基础疾病;⑥射波刀治疗后随访期不低于3个月,随访内容包括症状、体征、影像学检查结果、不良反应,随访期内至少有1次可评估的MRI检查;⑦射波刀治疗后未再采取手术等可能局部根治的治疗方案。
排除标准:①无病理诊断;②初治未按照手术及术后放射治疗同步替莫唑胺化疗标准治疗;③已行调强放射治疗2次以上;④KPS<70分;⑤有严重基础疾病;⑥射波刀治疗后随访期内无可评估的MRI检查;⑦射波刀治疗后采取了手术等可能局部根治的治疗方案。
1.3 方法
1.3.1 射波刀治疗方法 采用热塑记忆型面膜固定。所有患者行定位CT扫描,患者平板床面热塑膜固定,扫描范围颅顶至锁骨,扫描条件双重可视范围30 cm×30 cm、120 kV、350 mA、层厚2 mm。患者经MRI行T1加权、T2加权增强扫描,扫描范围为全颅、层厚3 mm。医生结合CT和MRI定位图像勾画靶体积和危及器官,给定处方剂量及剂量限值,治疗剂量20~37 Gy/4~6 F,处方等剂量线范围为79%~88%。将图像及勾画好的靶体积和危及器官推至射波刀的服务器(CyberKnife Rave System,版本C310),在服务器上将图像及勾画好的靶体积和危及器官加载至计划数据库。在计划系统(CyberKnife Data Management System,版本2.0.1.0)上建立新计划,采用六维颅骨追踪,选择适合的摆位中心,使得2幅互为正交的参考射野的数字化重建影像,图像在前侧和顶部各留1 cm左右的空隙。选择大小恰当的准直器进行优化计算,包绕95%以上靶体积的剂量作为处方剂量,兼顾总跳数以及射束数。经主管医生确认后方可形成可执行计划。
1.3.2 贝伐单抗治疗方法 10例在射波刀治疗前开始静脉滴注贝伐单抗,5例于治疗过程中开始静脉滴注贝伐单抗,剂量均为5 mg/kg、每2周1次、28 d为1个周期,至少完成4个周期。
1.3.3 评价标准 ①采用实体瘤疗效评价标准[14],瘤体最长径总和、全部病灶消失维持4周为完全缓解(complete response,CR),缩小超过30%维持4周为部分缓解(partial response,PR),增加20%为疾病进展(progressive disease,PD),非PR或PD为病情稳定(stable disease,SD);治疗观察指标,近期疗效(治疗后3个月复查MRI):有效率[(CR+PR/全部患者)×100%],远期疗效无进展生存期(progression free survival,PFS)、总生存期。②患者射波刀治疗后3个月做增强MRI复查评价近期疗效,并填写癌症患者生命质量测定量表肿瘤治疗的功能一般评价中文版(V4.0)评估是否有生存质量改善,计算治疗观察指标、生存质量改善率。③采用肿瘤放射治疗协作组急性放射损伤分级标准及肿瘤放射治疗协作组/欧洲癌症治疗研究组织晚期放射损伤分级标准评价放射反应[14];药物不良反应参照美国国家癌症研究所通用不良反应评定标准第3版,分0~Ⅳ级。
1.3.4 随访 随访从射波刀治疗结束开始,截止到2015年9月31日。射波刀治疗结束后1周、3个月随访,以后每隔3个月随访1次,随访率100%。
1.4 统计学处理 应用SPSS 22.0软件,计量资料用均数±标准差(± s)表示,采用Mann-Whitney U或团体t检验;计数资料以率表示,采用χ2检验。生存结果采用Kaplan-Meier生存分析。P<0.05为差异有统计学意义。
2 结果
2.1 近期疗效 按照疗效评价标准,射波刀联合贝伐单抗组15例中,CR 5例、PR 8例、SD 1例、PD 1例,治疗有效率86.7%(13/15);射波刀单独治疗组13例中,CR 2例、PR 7例、SD 3例、PD 1例,治疗有效率69.2%(9/13)。2组治疗有效率差异无统计学意义(χ2=1.268、P=0.372)。
2.2 生存期 中位PFS,射波刀联合贝伐单抗组7.7个月、射波刀组4.7个月,差异有统计学意义(t=2.355、P=0.027);平均总生存期,射波刀联合贝伐单抗组10.9个月、射波刀组7.5个月,差异有统计学意义(t=2.300、P=0.030)。2组生存曲线见图1。
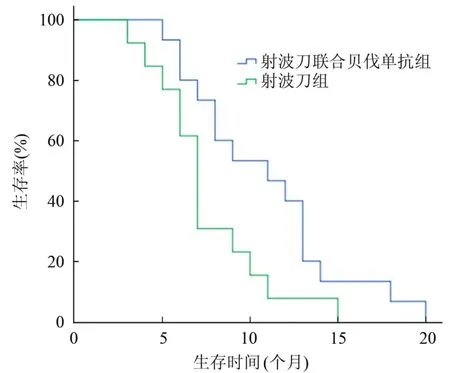
图1 2组患者生存曲线
2.3 生存质量改善 射波刀联合贝伐单抗组治疗后3个月,患者自觉生存质量改善率86.7%(13/ 15);射波刀单独治疗组治疗后3个月,患者自觉生存质量改善率46.2%(6/13)。生存质量改善率射波刀联合贝伐单抗组明显高于射波刀单独治疗组,差异有统计学意义(χ2=5.440、P=0.042)。
2.4 不良反应 2组治疗期间和治疗完成后1周出现不同程度的乏力、食欲缺乏、恶心等症状。射波刀联合贝伐单抗组神经系统毒性:5例Ⅲ级神经系统毒性,其中1例出现较严重的记忆力损害、余4例出现脑水肿,需住院应用甘露醇及激素治疗;6例Ⅱ级神经系统毒性,出现乏力、食欲缺乏;2例在静脉滴注贝伐单抗后出现高血压2级;1例出现蛋白尿2级;1例出现轻度皮肤淤血,给予对症治疗可恢复正常。射波刀组4例Ⅲ级神经系统毒性,因较严重头痛需要住院行甘露醇和激素治疗;3例Ⅱ级神经系统毒性。2组均未观察到严重不良反应。
3 讨论
恶性胶质瘤是最常见的原发性恶性脑肿瘤,发病率约为5/10万。目前的标准治疗是手术切除,术后替莫唑胺同步放化疗及辅助治疗。尽管欧洲癌症研究与治疗组织的研究结果显示,采用标准治疗后患者的总生存期与单纯放射治疗相比有显著提高,但是多形性胶质母细胞瘤患者的远期生存依然不佳,大部分的患者在数月内出现了肿瘤复发,局部复发是最常见的形式[15]。
目前对于复发胶质瘤的治疗,仍然没有统一的标准。手术、化学治疗和放射治疗都可以作为补救治疗的手段,其中以替莫唑胺及靶向药物的化学治疗最为常见[16-20]。贝伐单抗单药治疗48例复发胶质瘤的研究表明,其也具有一定的抗肿瘤活性,患者的中位PFS为16周,6个月无进展生存率达到29%,总生存时间为31周;常见的不良事件为血栓、高血压[20]。虽然放射治疗不是治疗复发胶质瘤的主要手段,但是近年来关于SBRT应用于复发胶质瘤研究报道却逐渐增多。与常规放射治疗相比,SBRT能够进行局部肿瘤的高剂量照射,并且减少对周围正常组织的放射性损伤。Hallemeier等[21]报道了用SBRT 18例复发或不可切除的纤维状星形细胞瘤,中位随访8年,1、5、10年生存率分别为94%、71%、71%,有11例(61%)肿瘤进展,局部进展4例;1、5、10年无进展生存率分别为65%、41%及17%。Combs等[22]回顾性研究59例复发胶质瘤患者在SBRT后中位生存时间为8个月,采用SBRT安全、耐受性好。
为了进一步延长复发胶质瘤患者的生存时间,研究者们开始尝试把SBRT同化学治疗联合治疗复发胶质瘤;其中,最常用的就是替莫唑胺。替莫唑胺是一种新型烷化剂,临床前期的研究数据显示,替莫唑胺联合放射治疗可以产生协同作用,提高放射治疗的疗效。而关于射波刀联合贝伐单抗治疗复发高级别脑胶质瘤目前相关的研究较少。贝伐单抗治疗脑肿瘤的优势有直接抑制肿瘤相关血管生成,使肿瘤相关血管正常化,直接对抗高级别脑胶质瘤中高表达VEGF的癌细胞,损坏胶质瘤干细胞周围的微血管。而放射治疗脑部肿瘤通常被认为是破坏肿瘤血管的。但临床前基础研究表明,放射治疗可以通过缺氧诱导因子-1α介导的途径刺激肿瘤血管生成,另外放射性坏死组织中VEGF往往是高表达的[23];而贝伐单抗不仅能有效抗肿瘤血管生成,而且还可有效减轻放射治疗相关不良反应(放射性坏死、水肿)。因此,放射治疗联合贝伐单抗或许能达到更好的临床获益。Cabrera等[24]报道的一项前瞻性临床研究证实,SBRT联合贝伐单抗治疗15例复发高级别脑胶质瘤患者是安全有效的,仅1例出现Ⅲ级神经系统不良反应。本研究的初步随访数据对比证实,采用射波刀联合贝伐单抗治疗复发高级别脑胶质瘤患者较单独应用射波刀治疗有着更好的临床症状改善率、更长的PFS和总生存期。由于样本量不足,2组治疗有效率并未呈现差异有统计学意义。
总之,射波刀联合贝伐单抗治疗复发高级别脑胶质瘤有较好疗效和安全性,联合替莫唑胺、贝伐单抗药物或许会有更好的临床获益,但仍有诸多问题亟待解决。如放射治疗的剂量分割模式,哪些患者是此种治疗模式的获益人群,治疗的最佳剂量和疗程是多少,哪些患者是严重不良反应的高危人群,影响疗效的预后因素有哪些,这些都需要进行更为深入的研究。
[1]Shen CY,Tyan YS,Kuo LW,et al.Quantitative evaluation of rabbit brain injury after cerebral hemisphere radiation exposure using generalized q-sampling imaging[J].PLoS One,2015,10(7):e0133001.
[2]Combs SE,Schmid TE,Vaupel P,et al.Stress response leading to resistance in glioblastoma-the need for innovative radiotherapy(iRT)concepts[J].Cancers(Basel),2016,8(1):E15.
[3]Aktan M,Koc M,Kanyilmaz G.Survival following reirradiation using intensity-modulated radiation therapy with temozolomide in selected patients with recurrent high grade gliomas[J].Ann Transl Med,2015,3(20):304.
[4]Jain RK,di Tomaso E,Duda DG,et al.Angiogenesis in brain tumours[J].Nat Rev Neurosci,2007,8(8):610-622.
[5]Lamszus K,Ulbricht U,Matschke J,et al.Levels of soluble vascular endothelial growth factor(VEGF)receptor 1 in astrocytic tumors and its relation to malignancy,vascularity,and VEGF-A[J].Clin Cancer Res,2003,9(4):1399-1405.
[6]Sathornsumetee S,Cao Y,Marcello JE,et al.Tumor angiogenic and hypoxic profiles predict radiographic response and survival in malignant astrocytomapatients treated with bevacizumab and irinotecan[J].J Clin Oncol,2008,26 (2):271-278.
[7]Flanigan PM,Aghi MK.Adaptation to antiangiogenic therapy in neurological tumors[J].Cell Mol Life Sci,2015,72 (16):3069-3082.
[8]Hurwitz H,Fehrenbacher L,Novotny W,et al.Bevacizumab plus irinotecan,fluorouracil,and leucovorin for metastatic colorectal cancer[J].N Engl J Med,2004,350(23):2335-2342.
[9]Sandler A,Gray R,Perry MC,et al.Paclitaxel-carboplatin alone or with bevacizumab for non-small-cell lung cancer [J].N Engl J Med,2006,355(24):2542-2550.
[10]Wedam SB,Low JA,Yang SX,et al.Antiangiogenic and antitumor effects of bevacizumab in patients with inflammatory and locally advanced breast cancer[J].J Clin Oncol,2006,24(5):769-777.
[11]Vredenburgh JJ,Desjardins A,Herndon JE 2nd,et al.PhaseⅡtrial of bevacizumab and irinotecan in recurrent malignant glioma[J].Clin Cancer Res,2007,13(4):1253-1259.
[12]Vredenburgh JJ,Desjardins A,Herndon JE 2nd,et al.Bevacizumab plus irinotecan in recurrent glioblastoma multiforme[J].J Clin Oncol,2007,25(30):4722-4729.
[13]Cloughesy TF,Prados MD,Wen PY,et al.A phaseⅡ,randomized,non-comparative clinical trial of the effect of bevacizumab(BV)alone or in combination with irinotecan (CPT)on 6-month progression free survival(PFS6)in recurrent,treatment-refractory glioblastoma(GBM)[J].J Clin Oncol,2008,26:2010b.
[14]杨学宁,吴一龙.实体瘤治疗疗效评价标准——RECIST [J].循证医学,2004,4(2):85-90,111.
[15]殷蔚伯,余子豪,徐国镇,等.肿瘤放射治疗学[M].4版.北京:中国协和医科大学出版社,2008:1350-1352.
[16]Milano MT,Okunieff P,Donatello RS,et al.Patterns and timing of recurrence after temozolomide-based chemoradiation for glioblastoma[J].Int J Radiat Oncol Biol Phys,2010,78(4):1147-1155.
[17]McDonald MW,Shu HK,Curran WJ Jr,et al.Pattern of failure after limited margin radiotherapy and temozolomide for glioblastoma[J].Int J Radiat Oncol Biol Phys,2011,79(1):130-136.
[18]Pope WB,Xia Q,Paton VE,et al.Patterns of progression in patients with recurrent glioblastoma treated with bevacizumab[J].Neurology,2011,76(5):432-437.
[19]Perry JR,Bélanger K,Mason WP,et al.PhaseⅡ trial of continuous dose-intense temozolomide in recurrent malignant glioma:RESCUE study[J].J Clin Oncol,2010,28 (12):2051-2057.
[20]Kreisl TN,Kim L,Moore K,et al.PhaseⅡtrial of singleagent bevacizumab followed by bevacizumab plus irinotecan at tumor progression in recurrent glioblastoma[J].J Clin Oncol,2009,27(5):740-745.
[21]Hallemeier CL,Pollock BE,Schomberg PJ,et al.Stereotactic radiosurgery for recurrent or unresectable pilocytic astrocytoma[J].Int J Radiat Oncol Biol Phys,2012,83(1): 107-112.
[22]Combs SE,Thilmann C,Edler L,et al.Efficacy of fractionated stereotactic reirradiation in recurrent gliomas:longterm results in 172 patients treated in a single institution [J].J Clin Oncol,2005,23(34):8863-8869.
[23]Steiner HH,Karcher S,Mueller MM,et al.Autocrine pathways of the vascular endothelial growth factor(VEGF)in glioblastoma multiforme:clinical relevance of radiation-induced increase of VEGF levels[J].J Neurooncol,2004,66 (1/2):129-138.
[24]Cabrera AR,Cuneo KC,Desjardins A,et al.Concurrent stereotactic radiosurgery and bevacizumab in recurrent malignant gliomas:a prospective trial[J].Int J Radiat Oncol Biol Phys,2013,86(5):873-879.
Safety and efficacy of Cyberknife adjuvant bevacizumab in patients with recurrent malignant gliomas
KANG Jingbo,WEN Juyi,ZHANG Xinghong,FANG Henghu,ZHANG Yufei
(Tumor Diagnosis and Treatment Center,Navy General Hospital,Beijing 100048,China)
Objective This study is to evaluate the efficacy and safety of Cyberknife combine with bevacizumab in the treatment of recurrent high-grade glioma.Methods From March 2012 to December 2014,28 cases of recurrent high-grade glioma patients were enrolled,after prior treatment with standard radiation therapy patients with recurrent high-grade glioma received 20—37 Gy/4—6 F of Cyberknife,patients also received bevacizumab(5 mg/kg intravenous)every 2 weeks of 28-daycycles until tumor progression.Toxicity and efficiency were assessed during treatment,and 1 month after Cyberknife.Subsequently,patients were evaluated at 3-month intervals.Results At 3 months after treatment,the total effective rate of the group treated with Cyberknife adjuvant bevacizumab was 86.7%.Median overall survival(OS)was 10.9 months,median progression free survival(PFS)was 7.7 months. The total effective rate of the group treated with Cyberknife was 69.2%.Median OS was 7.5 months,median PFS was 4.7 months.No grade 4 to 5 toxicities of two groups were observed.ConclusionTreatment of high-grade glioma with concurrent Cyberknife and bevacizumab was efficacy and safety,no excessive toxicity.
High-grade glioma;Recurrent;Cyberknife;Bevacizumab
R739.41
B
2095-3097(2016)06-0348-04
10.3969/j.issn.2095-3097.2016.06.008
2016-02-29 本文编辑:徐海琴)
中华国际医学交流基金会先声抗肿瘤治疗专项科研基金(CIMF-F-H001-S001)
100048北京,海军总医院肿瘤诊疗中心(康静波,温居一,张新红,方恒虎,张余飞)

