流式细胞仪气动稳流聚焦系统设计与测试
严心涛, 钟金凤, 吴云良, 王 策, 武晓东
(中国科学院 苏州生物医学工程技术研究所,江苏 苏州 215163)
流式细胞仪气动稳流聚焦系统设计与测试
严心涛, 钟金凤, 吴云良, 王 策, 武晓东
(中国科学院 苏州生物医学工程技术研究所,江苏 苏州 215163)

基于气动稳流方法,研制了一种流式细胞仪三维液流聚焦的液流系统。通过大量的实验数据,分析了所搭建系统的鞘液流量与气动装置中气压之间的关系,得出了细长孔动态流动的流量经验公式适用于所搭建的系统。利用CCD荧光成像方法对系统的样品聚焦稳定性进行了定性测试。使用Matlab软件对APD探测的多组样品聚焦的荧光信号进行了计算和分析,定量地评定了系统的样品聚焦稳定性。结果显示,研制的液流系统的样品聚焦宽度14 μm时,脉动低于0.5 μm;聚焦样品流的荧光信号的波动方差低于0.606。
流式细胞仪; 稳流; 聚焦; 气动
0 引 言
流式细胞仪是生命科学研究领域中先进的仪器之一,是一种可以快速、准确、客观,并且能够同时检测快速直线流动状态中的单个微粒(0.2~100 μm)的多项物理及生物学特性,用以分析定量也可对特定群体加以分选的仪器,广泛应用于免疫学、细胞学、海洋微生物学、药物代谢检测以及临床医学检验等方面[1-5]。
目前,实现单个微粒快速直线聚焦的方法主要有传统的三维鞘液动力学聚焦、微流管毛细作用聚焦[6]、超声波聚焦[7-8]、惯性流体聚焦[9]以及芯片上的液流聚焦[10-11]等。其中,三维鞘液动力学聚焦方法实现单个微粒的聚焦检测速度最快,但此方法对微粒聚焦位置和流动速度的稳定性提出很高的要求,而鞘液对微粒聚焦位置和流动速度的稳定性又起着关键性作用[1,12]。为实现鞘液对微粒稳定地聚焦,现采用的手段主要有注射泵控制鞘液的传输[13],因注射泵每次传输的流量有限,该方法难以实现样品长时间高速检测;蠕动泵传输鞘液,并在管路中加入多种稳流装置[14],该方法对稳流装置的设计制作的要求较高;利用气动装置实现鞘液的稳定流动,来实现微粒检测的稳定性[15],该专利控制鞘液稳流的气动装置比较复杂。
本文基于这种气动稳流方法,在该专利的基础上研制出一种简易的气动-液流系统;通过大量实验数据与经验公式计算结果的比较,评估了鞘液流量与气动装置中的气压大小关系,并以此为满足所需要的鞘液流量,反算出气动装置所需要的控制气压大小;研究了该气动稳流系统的样品聚焦稳定性的定性和定量的测试方法。
1 气动稳流聚焦系统原理
本系统的工作原理简图如图1所示,鞘液通过水泵(电磁泵或隔膜泵等)抽取,并经鞘液入口11流入到储气罐12中;之后鞘液在储气罐12的控制压力p0下经节流孔接头8稳定地流入流动室2中;其中,储气罐12中的气压由精密气压调节阀9控制;样品由样品泵4抽取,再经样品针管3进入流动室2中;根据液流动力学聚焦原理,进入流动室2中的样品在鞘液作用下聚焦,之后经混合液出口流出。
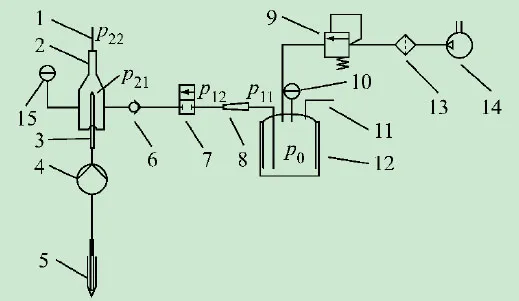
图1 气动稳流聚焦系统原理简图
2 气动稳流系统压力与流量关系
2.1 气动稳流聚焦系统搭建
为分析本系统储气罐中控制压力值与鞘液流量间的关系,搭建的系统采用Air Control公司的精密气压调节阀,其输出气压的控制精度±344 Pa,利用该调节阀来维持储气罐中的恒压状态;采用西安仪表厂的精密压力表,其量程160 kPa,精度等级0.25级,用于测试本系统管路中的压力值;水泵可采用隔膜泵;流动室鞘液入口位置比节流孔鞘液出口位置的高度约高10 cm;采用的节流孔接头的长度l1=10 mm,直径d1=230 μm;流动室节流孔的截面是一正方形,其边长a=250 μm,节流孔的长度l2=11.6 mm,流动室的水力直径d2与a之间的关系为:
d2=4Rh, Rh=A/P
(1)
式中:A为液流流过流动室节流孔的横截面积;P为流动室节流孔的湿周周长,则流动室节流孔的水力直径d2为250 μm;流路中的其他管子直径d3为3 mm。
2.2 系统控制压力与流量关系实验
为了分析系统控制压力与流量关系,在不同控制压力下,测试节流孔接头前后的压力值p11和p12,鞘液在流动室中聚焦前后的压力值p21和p22,以及混合液塞满(100±0.05)mL量瓶时间t。其中,在不同控制压力下,鞘液的流量Q见表1。表1中也显示出系统在不同控制压力下,两组测试实验的流量误差δ均在1%以下,说明鞘液流动的稳定性很好。
本系统采用的节流孔接头和流动室节流孔均是细长孔,其流量Q与其前后的压力差Δp之间的经验公式为:
Δp=128μlQ/(πd2)
(2)
其中:μ为液流的黏度;l为细长孔的长度;d为细长孔的直径;鞘液为去离子纯净水,其黏度μ约0.001 N·s·m-2。根据式(2)不难计算出节流孔接头和流动室聚焦前后压力差,以及与实验测得的压力差的误差大小。表2和表3显示在不同控制压力下,系统中2个节流孔的压力差的测量值与经验公式计算值的误差均在10%以内,引起压力误差的原因除了经验公式与实际管路模型存在一些偏差外,还由精密压力表的测量精度(测量精度为±400 Pa)和精密气压调节阀的稳

表2 节流孔接头前后测量的压力差与细长孔动态流动的流量经验公式计算的压力差

表3 流动室聚焦前后测量的压力差与细长孔动态流动的流量经验公式计算的压力差
压精度(控制精度为±344 Pa)引起;在该误差范围内,本系统的节流孔前后的压力差可由经验公式进行初步评估;若再结合液流连续方程:
(3)
以及伯努利定理:
(4)
就可以通过系统所需要的鞘液流量大小,计算出储气罐中所需要控制的气压大小。其中:D为管道的直径;z为测量点的相对高度;ρ为鞘液的密度;v为流速,p为压力大小。
3 系统样品聚焦稳定性测试
3.1 基于CCD成像的样品聚焦稳定性定性测试
在该测试方法中,所测试的样品采用稀释的罗丹明,其在532 nm激光器下可激发出强烈的荧光;为了降低CCD成像的背景噪声,在显微物镜前安装一高通滤波片,用于滤除流动室上的散射激光;调节反射镜,使得激光照射在样品聚焦的位置上;罗丹明受激激发的荧光经过一高通滤波片和显微物镜后即可在CCD上成像,并通过数据线上传到显示屏上,实时显示样品聚焦的状态,其测试原理如图2所示。
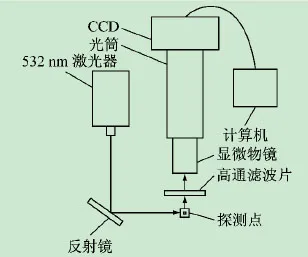
图2 CCD成像的样品聚焦稳定性测试方法原理图
为了定性地测试气动稳流系统的稳定性,将其与不含储气罐的液流系统(其他条件都一样)作对比;同时,为了排除样品流自身脉动的影响,采用低脉动的流量稳定的注射泵抽取样品,其中,注射泵的针管容量为50 μL,流量设定20 μL/min。在显示屏可观测到,经隔膜泵直接抽取的鞘液对样品聚焦时,样品流的聚焦宽度为12~16 μm之间周期性脉动,其中,脉动的周期与隔膜泵的运动周期一致;气动稳流系统的样品流的聚焦宽度为14 μm,脉动在0.5 μm以内。通过该CCD成像方法,可以直观、定性地观测到本气动稳流系统的样品聚焦稳定性还是很好的。
3.2 基于APD荧光探测的样品聚焦稳定性定量测试
在该测试的方法中,所测试的样品仍采用罗丹明,其在532 nm激光器下所激发的荧光经两个透镜聚焦后汇聚到APD上;为了提高信噪比,在APD前装配一高通滤波片和一带通滤波片;APD探测的荧光信号上传到示波器上;之后,再将示波器存储的数据导入到Matlab软件中,经数据提取,输出脉动图像以及作进一步地数据分析,其测试原理如图3所示。
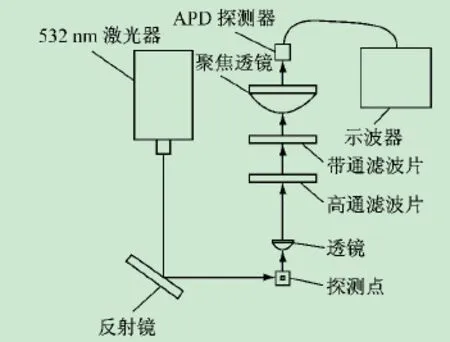
图3 基于APD荧光探测的样品聚焦稳定性定量测试方法原理图
同样,为测试气动稳流系统的稳定性,将其与不含储气罐的液流系统(其他条件都一样)作对比;采用低脉动的流量稳定的注射泵抽取样品,以尽量排除样品流自身脉动的影响,其中,注射泵的针管容量为50 μL。本方法采用样品公差这一统计值对样品流的聚焦稳定性作定量地评定:
(5)
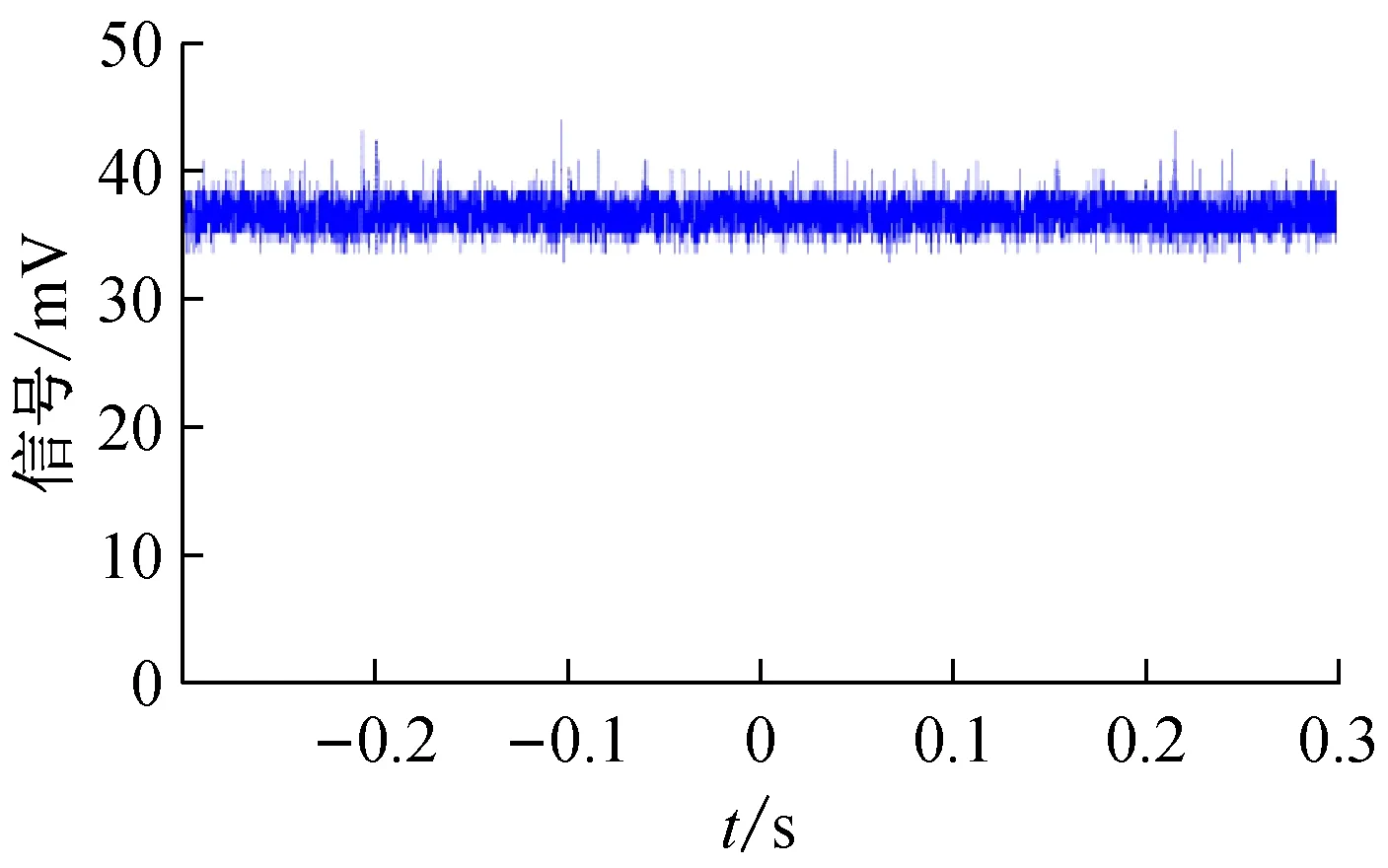
图4 在注射泵流量为20 μL/min下,气压稳流系统的聚焦样品流荧光信号波动图
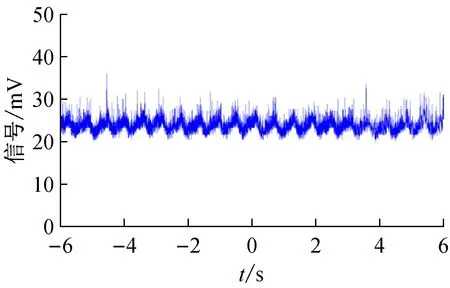
图5 在注射泵流量为20 μL/min下,隔膜泵直接抽取鞘液的聚焦样品流荧光信号波动图
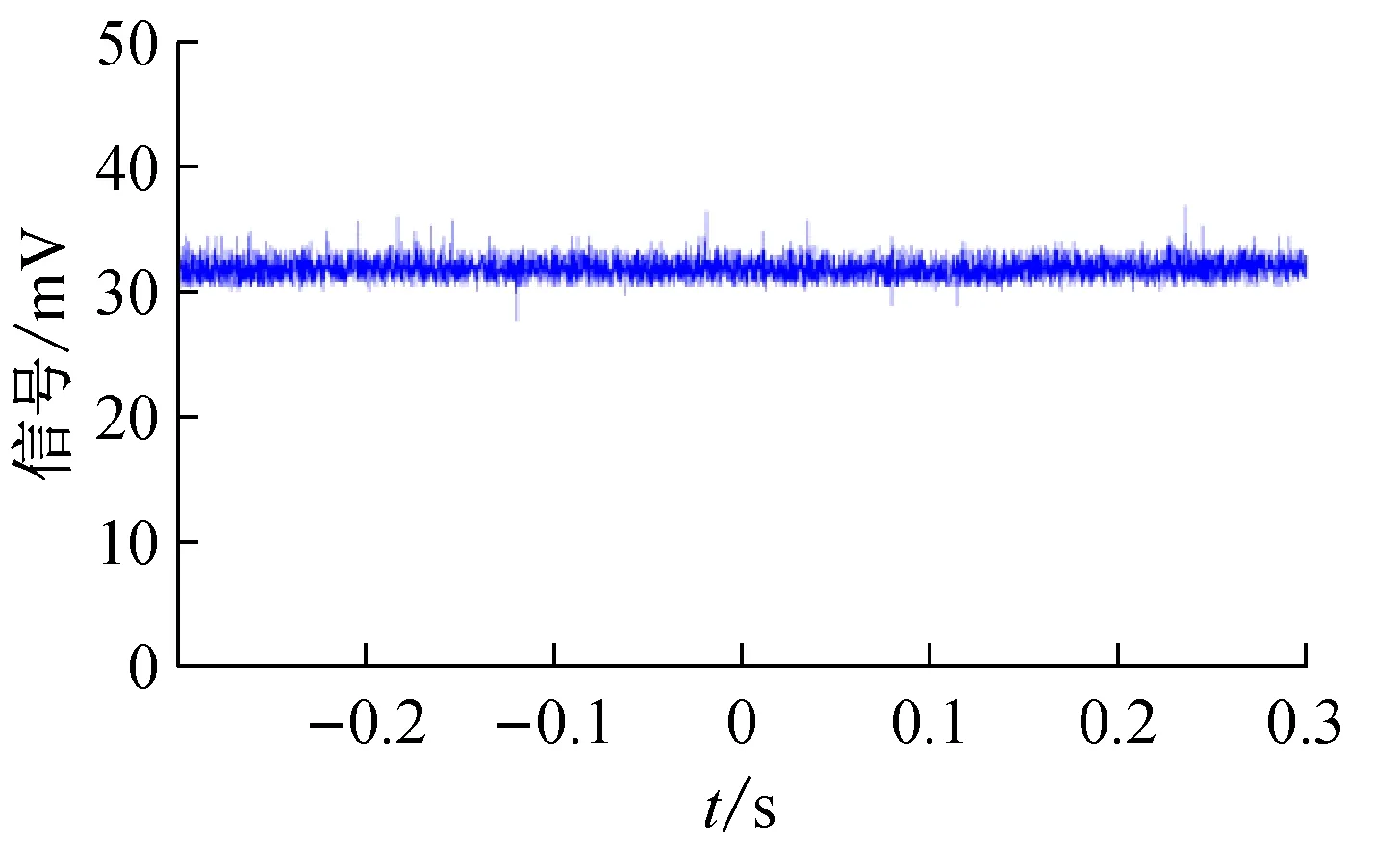
图6 在注射泵流量为40 μL/min下,气压稳流系统的聚焦样品流荧光信号波动图
在Matlab中利用式(5)计算荧光信号的波动方差。其中,在注射泵流量为20 μL/min下,气压稳流系统的聚焦样品流荧光信号的波动方差为0.606,隔膜泵直接抽取鞘液下聚焦样品流的荧光信号的波动方差为2.592;在注射泵流量为40 μL/min下,气压稳流系统的聚焦样品流荧光信号的波动方差为0.521,隔膜泵直接抽取鞘液下聚焦样品流的荧光信号的波动方差为5.534。通过上述实验,可以定量地评定本文研制的气压稳流系统的样品聚焦稳定性。
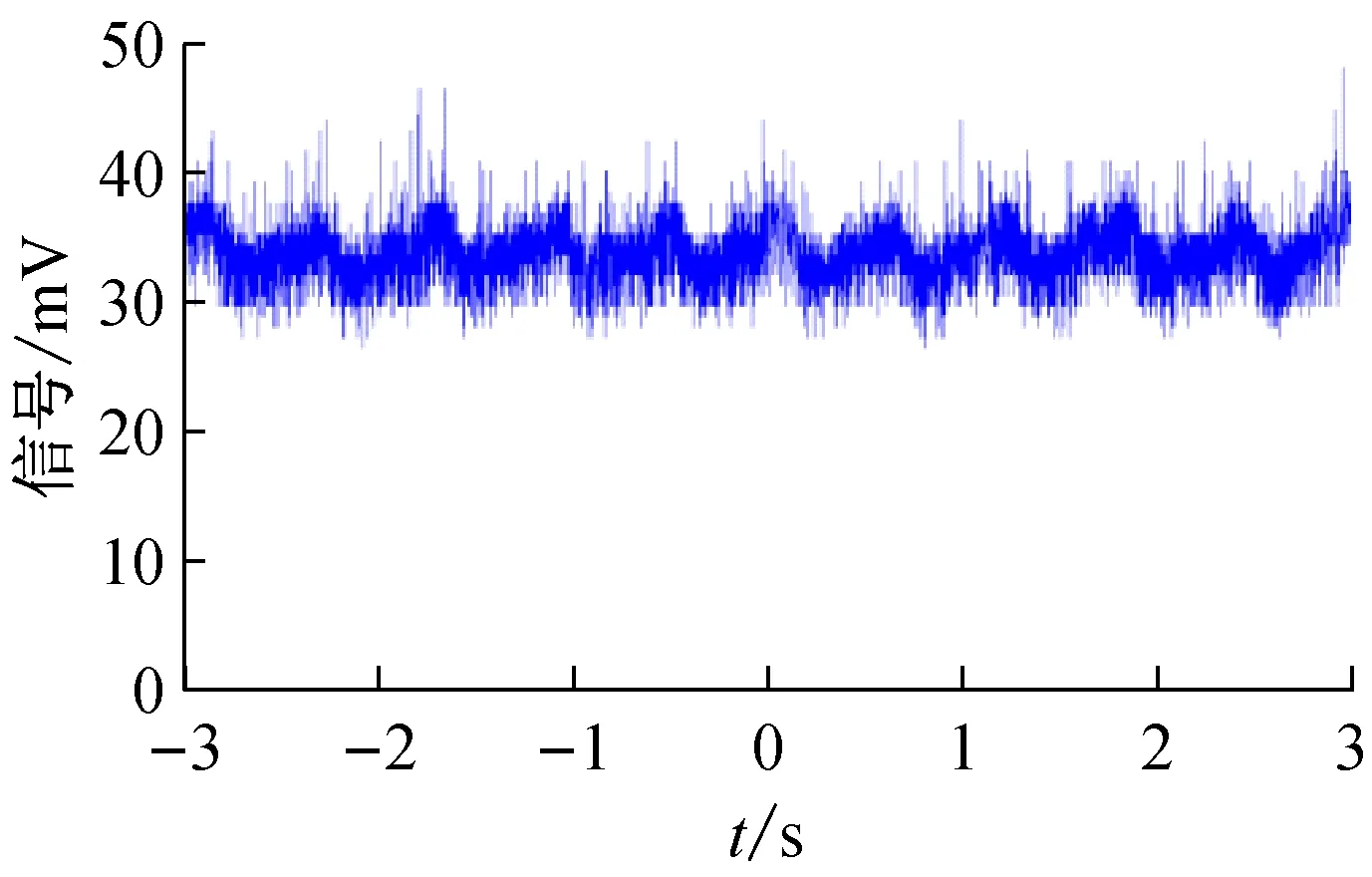
图7 在注射泵流量为40 μL/min下,隔膜泵直接抽取鞘液的聚焦样品流荧光信号波动图
4 结 语
基于鞘液三维动力学聚焦原理,本文研制了一种简易的气动稳流装置,通过精密控制该装置的气压可实现鞘液的稳定流动,以此来满足流式细胞仪样品中微粒的高速稳定的聚焦和检测,并进行了大量的实验和测试,可以得出以下结论:
本系统中节流孔前后的压力差的实际测量值与经验公式计算的理论值偏差在10%以内,可以采用经验公式估算本系统的节流孔前后的压力差,再结合液流连续方程和伯努利定理,就可以根据系统所需的鞘液流量大小来反算出气动装置所需要精密控制的气压大小;通过本文提出的CCD成像测试方法,可以直观定性地观测到本系统的样品聚焦稳定性非常好;利用本文提出的APD荧光探测测试方法,可以定量地比较本气动稳流系统与不含储气罐的液流系统(其他条件都一样)的稳定性大小,结果显示出本系统的样品脉动比后者要小的多。
[1] Shapiro H M. Practical Flow Cytometry[M]. New Jersey: Wiley-Liss, 2003: 1-2.
[2] Bendall S C, Simonds E F, Qiu P,etal. Single-Cell Mass Cytometry of Differential Immune and Drug Responses Across a Human Hematopoietic Continuum[J]. Science, 2011, 332(6030): 687-696.
[3] Pitsillides C M, Runnels J M, Spencer J A,etal. Cell labeling approaches for fluorescence-based in vivo flow cytometry[J]. Cytometry Part A, 2011, 79A(10): 758-765.
[4] Bjornson Z B, Nolan G P, Fantl W J. Single-cell mass cytometry for analysis of immune system functional states[J]. Current Opinion in Immunology, 2013, 25(4): 484-494.
[5] Bendall S C, Nolan G P, Roederer M,etal. A deep profiler’s guide to cytometry[J]. Trends in Immunology, 2012, 33(7): 323-332.
[6] Ilkov F A, Sunnyvale, CA(US). Asymmetric capillary for capillary-flow cytometers[P]. US: 20070236681A1. Oct. 11, 2007.
[7] Kaduchak G, Goddard G, Salzman G,etal. Ultrasonic analyte concentration and application in flow cytometry[P]. US: 007340957B2. Mar. 11, 2008.
[8] Kapishnikov S, Kantsler V, Steinberg V. Continuous particle size separation and size sorting using ultrasound in a microchannel[J]. Journal of Statistical Mechanics: Theory and Experiment, 2006(1): 01012.
[9] Carlo D D. Inertial microfluidics[J]. Lab Chip, 2009(9): 3038-3046.
[10] Chang C C, Huang Z X, Yang R J. Three-dimensional hydrodynamic focusing in two-layer polydimethylsiloxane(PDMS) microchannels[J]. Journal of Micromechanics and Microengineering, 2007, 17: 1479-1486.
[11] Sundararajan N, Pio M S, Lee L P,etal. Three-dimensional hydrodynamic focusing in polydimethylsiloxane(PDMS) microchannels[J]. Journal of Microelectromechanical Systems, 2004, 13(4): 559-567.
[12] 马玉婷,严心涛,陈忠祥,等. 流式细胞仪液流聚焦系统仿真分析与设计[J]. 分析仪器,2014(1):17-22.
[13] Seamer L C, Kuckuck F, Sklar L A. Sheath Fluid Control to Permit Stable Flow in Rapid Mix Flow Cytometry[J]. Cytometry, 1999, 35: 75-79.
[14] Rich C A, Bair N C. Pulsation attenuator for a fluidic system[P]. US: 007857005B2. Dec. 28, 2010.
[15] Vrane D R, Norton P. Constant output fluidic system[P]. US: 20040031521A1. Feb. 19, 2004.
Design and Test of Flow Cytometer Focusing System Based on Pneumatic Steady Flow Method
YANXin-tao,ZHONGJin-feng,WUYun-liang,WANGCe,WUXiao-dong
(Suzhou Institute of Biomedical Engineering and Technology, Chinese Academy of Sciences, Suzhou 215163, China)
A three-dimensional (3-D) hydrodynamic focusing system was designed based on pneumatic steady flow method in flow cytometer. Through a large number of experimental data collected from the building platform, the relationship between the sheath flow rate and the pressure which in the pneumatic devices was analyzed, and the empirical traffic formula of dynamic flow in the elongated hole was gotten, and the formula could be applicable to build platform. The fluorescence imaging method was used to take charge-coupled device (CCD), qualitatively, the stability of the focusing sample in the system was tested. Using Matlab software, fluorescence signals of the focusing sample which detected by Avalanche Photo Diode (APD) were calculated and analyzed. The stability of the focusing sample were quantitatively evaluated. The results showed that the sample pulsating size of the flow system developed was below 0.5 μm. When the focus width of the sample was 14 μm; the fluctuation variance of the focused sample stream’s fluorescence signal was lower than 0.606.
flow cytometer; steady flow; focusing; pneumatic
2015-03-07
国家高技术研究发展(863)计划资助项目(2011AA02A106);苏州市医疗器械与新医药专项(ZXY201428)
严心涛(1987-),男,湖北仙桃人,助理研究员,从事机电液一体化研究。Tel.:0512-69588273;E-mail: yanxt@sibet.ac.cn
武晓东(1968-),男,吉林舒兰人,研究员,从事光学工程和医用光学方面研究。E-mail:wuxiaodong2000@hotmail.com
TH 776
A
1006-7167(2016)01-0039-04

