(6R,7R)-7-氨基-3-[2-(4-甲基-5-噻唑)乙烯基]-8-氧代-5-硫-1-氮杂双环[4.2.0]辛-2-烯-2-羧酸的合成
杨 涛,孙 莉,孙 会,裴 文(.浙江工业大学 化学工程学院,浙江 杭州 3004;.浙江华方药业有限责任公司,浙江 台州 3800)
·制药技术·
(6R,7R)-7-氨基-3-[2-(4-甲基-5-噻唑)乙烯基]-8-氧代-5-硫-1-氮杂双环[4.2.0]辛-2-烯-2-羧酸的合成
杨 涛1,孙 莉1,孙 会2,裴 文1(1.浙江工业大学 化学工程学院,浙江 杭州 310014;2.浙江华方药业有限责任公司,浙江 台州 318020)
以1-磺丁基-3-甲基咪唑硫酸氢盐离子液体(b)为反应介质,7-氨基头孢烷酸(7-ACA,2)为原料,与4-甲基-5-甲酰基噻唑经缩合反应制得(6R,7R)-7-氨基-3-[2-(4-甲基-5-噻唑)乙烯基]-8-氧代-5-硫-1-氮杂双环[4.2.0]辛-2-烯-2-羧酸(7-ATCA,1),其结构经1H NMR,13C NMR和IR表征。考察了离子液体及其用量,原料摩尔比r[n(4-甲基-5-甲酰基噻唑)∶n(2)],反应温度和反应时间对1收率的影响。在最佳反应条件[b为反应介质,b用量为20 mL,r=1.3,于65 ℃反应5 h]下,1收率可达90%以上。
酸性离子液体;7-氨基头孢烷酸;药物合成
(6R,7R)-7-氨基-3-[(1Z)-2-(4-甲基-5-噻唑)乙烯基]-8-氧代-5-硫-1-氮杂双环[4.2.0]辛-2-烯-2-羧酸(7-ATCA,1)是一种重要的药物中间体,可作为母体用于合成头孢哌酮、头孢美唑、头孢米诺、头孢甲肟等一系列抗生素药物[1-2]。因此,1的合成长期受到研究者的普遍关注。1982年,Saikawa等[3]以浓硫酸为缩合剂促进7-氨基头孢烷酸(7-ACA,2)和4-甲基-5-甲酰基噻唑的缩合反应制得1,收率87%。Naito等[4]以二氯磷酸为催化剂,于-20 ℃反应制备1,收率83%。2013年,Gao等[5]以7-苯乙酰胺基-3-氯甲基头孢烷酸对甲氧基苄酯(GCLE)为原料,在氢氧化钠催化下,与4-甲基-5-甲酰基噻唑发生缩合反应,经消除保护基得1,收率80%。通过对以上几种方法分析,可知强酸和二氯磷酸催化法在合成过程中会产生大量强酸性废液或酸雾,对环境造成污染。而1内部的β-内酰胺环在碱液环境下易被破坏,导致碱催化下的产物收率不高。
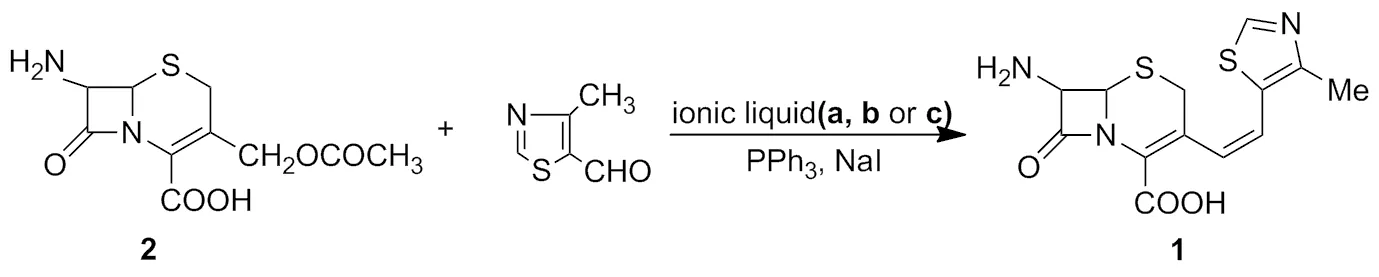
Scheme 1
离子液体是在室温呈液态的由离子构成的物质,具有稳定性高、酸碱性可调等优点[6-7]。在常规离子液体中引入不同阴、阳离子,使其具有特定的理化性质,可用于促进特定反应的进行[8-10]。
在酸性离子液体介质中合成1,既可以在酸性条件下保持较高的收率,又能避免产生强酸性废液和使用大量有机溶剂。本文以2为原料,分别在自制酸性离子液体1-丁基-3-甲基咪唑硫酸氢盐([Bmim][HSO4],a)、1-磺丁基-3-甲基咪唑硫酸氢盐([HSO3-Bmim][HSO4],b)、1-磺丁基-1-三乙基胺硫酸氢盐([HSO3-b-N(Et)3][HSO4],c)介质中与4-甲基-5-甲酰基噻唑发生缩合反应制得1(Scheme 1),其结构经1H NMR,13C NMR和IR表征。并对反应条件进行了优化,最佳反应条件为:b用量为20 mL,原料摩尔比[r=n(4-甲基-5-甲酰基噻唑):n(7-氨基头孢烷酸)]为1.3,于65 ℃反应5 h,收率93%。
1 实验部分
1.1 仪器与试剂
WR-52型数字熔点仪(温度未校正);Brucker Avance型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Brucker Vector 22 型红外光谱仪(KBr压片);HP 5989B型质谱仪。
a,b,c按文献[11-13]方法自制;其余所用试剂均为分析纯。
1.2 合成
(1) 1的合成(以a中为例)
向反应瓶中加入a 20 mL、2 2.72 g(10 mmol)、碘化钠1.80 g(12 mmol)和三苯基膦3.15 g(12 mmol),于10 ℃反应30 min,升温至60 ℃,加入4-甲基-5-甲酰基噻唑1.52 g(12mmol),继续反应5 h。反应液冷却至室温,用乙酸乙酯(3×10 mL)萃取,离子液体经旋蒸、真空干燥后可重复使用。合并萃取液,蒸除乙酸乙酯,残留物用甲醇重结晶得粗品。粗品用10%盐酸(50 mL)溶解,滴加氨水调至pH 3.5,结晶2 h,过滤,滤饼用二氯甲烷(3×10 mL)洗涤,真空干燥得淡黄色晶体1 2.19 g,收率68%,m.p.212~214 ℃;1H NMRδ:2.37(s,3H,CH3),3.30 (d,J=15.0 Hz,1H,CH2),3.48(d,J=15.0 Hz,1H,CH2),4.84(s,1H,CH),5.08(s,1H,CH),6.32(d,J=9.3 Hz,1H,CH2),6.68(d,J=9.3 Hz,1H,CH2),8.92(s,H,CH);13C NMRδ:15.9,40.1,51.5,54.9,65.0,121.3,127.0,129.1,152.5,153.3,168.4,169.4;IRν:3 422.2,1 763.6,1 618.1,1 383.9,1 080.2,715.2,565.9 cm-1;MS(ESI)m/z:323{[M+H]+}。
2 结果与讨论
2.1 表征
IR分析表明:3 422.2 cm-1处吸收峰为N—H伸缩振动吸收峰,2 976.2 cm-1处为甲基的C—H振动吸收,1 763.6 cm-1处为羧基中C=O的伸缩振动吸收峰,1 618.1 cm-1处为噻唑环与2相连形成的C=C伸缩振动吸收峰,1 383.9 cm-1处为甲基的C—H对称弯曲振动吸收峰,715.2 cm-1处为NH2面内摇摆振动峰,565.9 cm-1处为β-内酰胺环中C=O的伸缩振动吸收峰。
1H NMR中δ6.32和δ6.68处的双峰,13C NMR中的δ121.3及δ127.0处的吸收峰均归属于将六元杂环与噻唑环相连的—CH2=CH2—。
2.2 工艺条件优化
为寻找合成1的最佳工艺条件,分别考察了离子液体及其用量、原料摩尔比r、反应温度与反应时间对收率的影响。
(1) 离子液体
2 10 mmol,其余反应条件同1.2(1),考察以离子液体a作为反应介质,结果见表1。由表1可见,产物收率仅为68%(No.1),明显低于文献[2]报道的利用传统强酸催化法所得产物收率。为了提高1在酸性离子液体介质中的收率,考虑到文献[14-15]中报道了离子液体酸性对催化活性的影响,我们制备了具有双酸性位离子液体b,结果显示产物收率有大幅提升(No.2,89%)。为了进一步探究酸性离子液体阳离子基团对反应的影响,我们又制备了与b具有相同阴离子但具有不同阳离子的离子液体c(No.3,81%),c为反应介质时,1的收率略低于b中的收率,这表明以甲基咪唑为母体的阳离子较以三乙基胺为母体的阳离子更有利于1的生成。
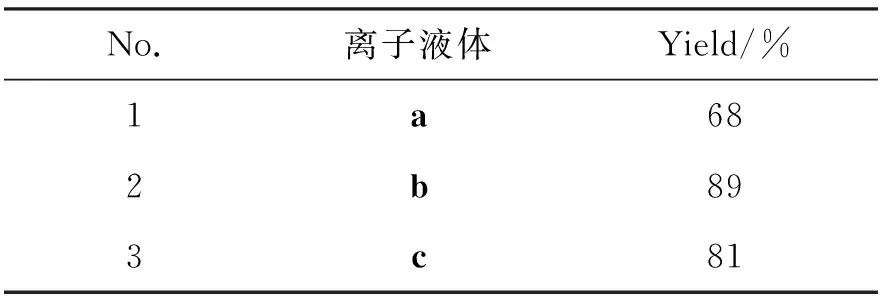
表1 离子液体对1收率的影响
综上所述,b为反应介质时,1的收率最高。因此,我们选择b为模板反应的反应介质。
(2) b的用量
以b为反应介质,其余反应条件同1.2(1),考察了b的用量对收率的影响,结果见图1。由图1可知,当b用量为5 mL时,产物收率仅为76%,逐渐增加离子液体用量,产物收率也相应提高。这是因为原料均为固体结晶,离子液体作为反应体系的介质,如果用量太少,体系混合程度不理想,会影响合成反应的进行,导致收率偏低。同时,b也对1的合成具有促进作用,增大其用量也在一定程度上增加了活性中心,进而更好地促进反应的进行。而随着b用量达到20 mL并进一步增大时,产物收率不再增高。因此,b的最佳用量为20 mL。
(3)r
以b 20 mL为反应介质,其余反应条件同1.2(1),考察r对1收率的影响,结果见图2。
由图2可知,r=1.0时,产物收率仅为73%。逐步提高r,产物收率随之增大,当r=1.3时收率达到90%。此后进一步增大r,收率并没有明显提高。因此,最佳原料摩尔比r=1.3。
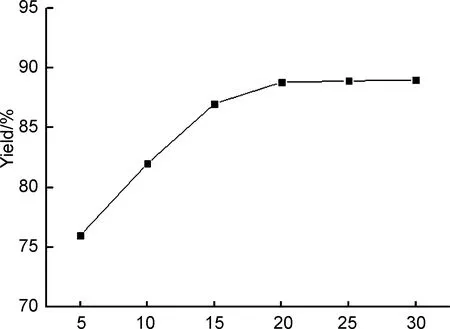
V/mL
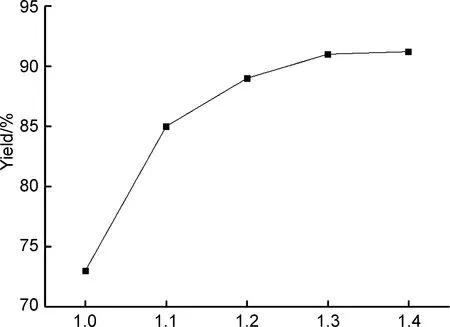
r
Temperature/℃
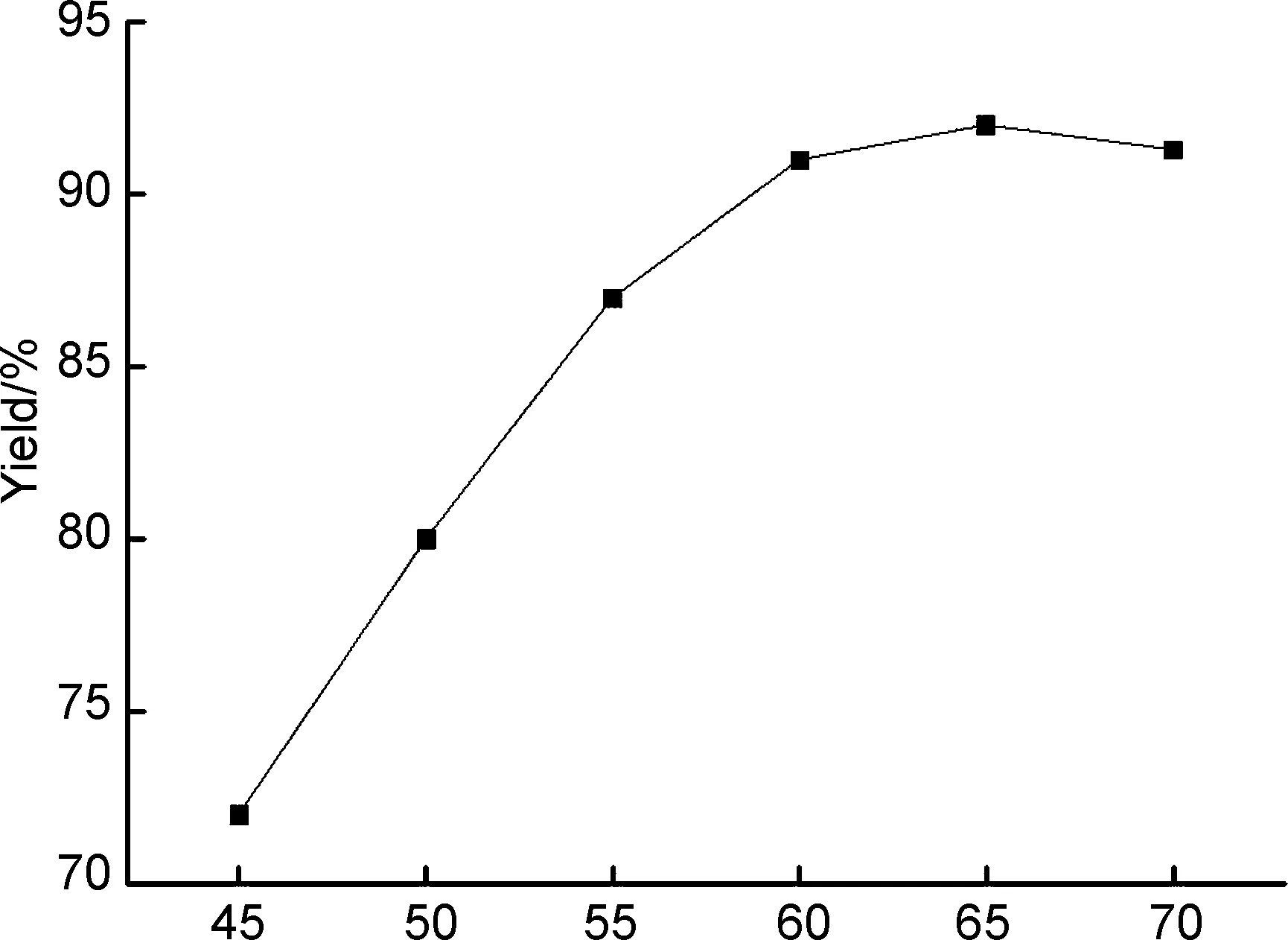
(4) 反应温度
r=1.3,其余反应条件同1.2(1),考察温度对收率的影响,结果见图3。由图3可知,当反应温度从45 ℃上升到60 ℃的过程中,1收率迅速升高至92%,这是由于低温下离子液体黏度较高,不利于反应体系混合,而温度的升高在降低离子液体黏度的同时加快了分子的运动,有利于反应的进行。但当反应温度超过60 ℃并进一步上升,1收率升高缓慢,并在超过65 ℃之后有下降的趋势。这是因为温度的升高在加快反应速率的同时也会促使一部分副反应的发生,例如高温破坏了β-内酰胺环。因此,最佳反应温度为65 ℃。
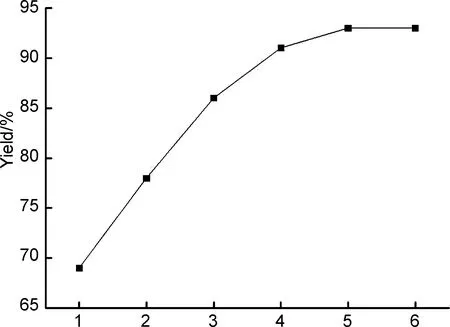
(5) 反应时间
r=1.3,反应温度为65 ℃,其余反应条件同1.2(1),考察反应时间对收率的影响,结果见图4。由图4可知,随着反应时间的延长,产物收率总体呈逐步上升的趋势,且当反应时间达到5 h时产物收率达到93%。继续延长反应时间,产物收率几乎不变,且没有明显上升的趋势,这表明反应进行了5 h后基本达到平衡。因此,最佳反应时间为5 h。
Time/h
综上所述,合成1的最佳反应条件为:b为反应介质,其用量为20 mL,r=1.3,于65 ℃反应5 h。
2.3 离子液体的循环使用
在最佳反应条件下,将通过1.2(1)中方法回收的b进行重复性实验,结果见图5。由图5可知,随着b重复使用次数的增加,其催化活性逐渐降低,且下降幅度逐步加大。这是因为在多次回收过程中,离子液体会有损耗且未完全分离的杂质破坏了b的活性中心,导致活性下降。另外通过观察我们发现,后期回收的离子液体颜色逐步加深,可能也是由于杂质的存在所导致的。尽管如此,回收重复使用的b依旧保持了较高的活性,在最佳反应条件下,重复使用6次后,1的收率仍保持在88%以上。
以1-磺丁基-3-甲基咪唑硫酸氢盐离子液体(b)为反应介质,7-氨基头孢烷酸为原料,与4-甲基-5-甲酰基噻唑经缩合反应制得(6R,7R)-7-氨基-3-[2-(4-甲基-5-噻唑)乙烯基]-8-氧代-5-硫-1-氮杂双环[4.2.0]辛-2-烯-2-羧酸(7-ATCA,1)。考察了离子液体及其用量,原料摩尔比r[n(4-甲基-5-甲酰基噻唑):n(7-氨基头孢烷酸)],反应温度和反应时间对1收率的影响。且所用b具有良好的重复使用性,回收重复使用6次,产物收率保持在88%以上。
[1] Kumar S P,Anandam V,Sivakumaran S,etal.An improved process for the preparation of cefditoren:WO 2005003141[P].2005.
[2] Kumar S P,Anandam V,Sivakumaran S,etal.Process for the preparation of cefditoren:US 20060173175[P].2006.
[3] Saikawa I,Takano S,Momonoi K,etal.Processfor producing 7-(substituded) amino-3-substitutedthinomethy.DELTA.Sup.3-cephem-4-Carboxylicacids:US 4312986[P].1982.
[4] Naito K,Shinbo H,Tsukamura K.Method for producing 7-aminocephem compounds[P].US 4446318,1984.
[5] Gao C H,Jia C G,Li W,etal.A scalable chemoenzymatic process for 7-amino-3-[Z-2-(4-methylthiazol-5-yl)vinyl]-3-cephem-4-carboxylic acid(ATCA)[J].Res Chem Intermed,2013,39:3911-3917.
[6] Holbrey J D,Seddon K R.Ionic liquids[J].Clean Products and Processes,1999,1:223-236.
[7] Hajipour A R,Rafiee F.Basic ionic liquids a short review[J].J Iran Chem Soc,2009,6(4):647-678.
[8] 孙莉,陶荣哨,胡卫雅,等.新型离子液体的合成及其在Heck反应合成烯丙醇类化合物中的应用[J].合成化学,2015,10(23):899-903.
[9] 崔文辉,吴磊,贾如琰,等.新型功能化Brøsted酸性离子液体1,4-二(4-磺酸基丁基)哌嗪硫酸氢盐磺酸的合成及其对酮醛交叉Aldol缩合反应的催化作用[J].合成化学,2013,1(21):21-25.
[10] Anjaiah S,Chandrasekhar S,Gree R.Synthesis and preliminary use of novel acrylic ester-derived task-specific ionic liquids[J].Tetrahedron Letters,2004,45:569-571.
[11] Li H L,Yu S T,Liu F S,etal.Synthesis of dioctyl phthalate using acid functionalized ionic liquid as catalyst[J].Catalysis Communications,2007,8:1759-1762.
[12] Liu Y Y,Xiao W W,Xia S Q,etal.SO3H-functionalized acidic ionic liquids as catalysts for the hydrolysis of cellulose[J].Carbohydrate Polymers,2013,92:218-222.
[13] Zhao Y W,Long J X,Deng F G,etal.Catalytic amounts of Brøsted acidic ionic liquids promoted esterification:Study of acidity-activity relationship[J].Catalysis Communications,2009,10:732-736.
[14] Liu Y,Li L,Xie C X.Acidic functionalized ionic liquids as catalyst for the isomerizstion ofα-pinene to camphene[J],Res ChemIntermed,2016,42:559-569.
[15] Patra T,Ahamad S,Upadhyayula S.Highly efficient alkylation of phenol withtert-butyl alcohol using environmentally benign Brøsted acidic ionic liquids[J].Applied Catalysis A:General,2015,506:228-236.
Synthesis of (6R,7R)-7-Amino-3-[2-(4-methylthiazol-5-yl)vinyl]- 3-cephem-4-carboxylic Acid
YANG Tao1,SUN Li1,SUN Hui2,PEI Wen1*
(1.College of Chemical Engineering,Zhejiang University of Technology,Hangzhou 310014 2.Zhejiang Huafang Pharmaceutical Co.Ltd.,Taizhou 318020)
7-Amino-3-[2-(4-methylthiazol-5-yl)vinyl]-3-cephem-4-carboxylicacid (7-ATCA,1)was prepared by condensation reaction of 7-aminocephalosporanic acid (7-ACA,2)with 4-methylthiazole-5-aldehyde using 1-sulfobutyl-3-methyl-imidazolium hydrogen sulfate(b) as reaction medium.The structure was confirmed by1H NMR,13C NMR and IR.The effect of ionic liquid and its dosage,the ratio of the reactantsr[n(4-methylthiazole-5-aldehyde):n(2)],reaction temperature and reaction time on the yield of 1 were studied.In the optimum reaction conditions [b as reaction medium,the amount of b was 20 mL,r=1.3,at 65 ℃ for 5 h],the yield of 1 was above 90%.
acidic ionic liquid;7-aminocephalosporanic acid;drug synthesis
2016-07-15
杨涛(1991-),男,汉族,浙江长兴人,硕士,主要从事工业催化、有机合成的研究。 E-mail:413242807@qq.com
裴文,博士,教授,E-mail:peiwen58@zjut.edu.cn
O626;R914.5
A
10.15952/j.cnki.cjsc.1005-1511.2016.12.16182

