亚临界丁烷制备豆粕及其蛋白氧化稳定性研究
朱乐平 杨晓泉
(华南理工大学轻工与食品学院 食物蛋白工程研究中心,广州 510640)
亚临界丁烷制备豆粕及其蛋白氧化稳定性研究
朱乐平 杨晓泉
(华南理工大学轻工与食品学院 食物蛋白工程研究中心,广州 510640)
采用亚临界丁烷对大豆粉脱油制得豆粕(DSF-B),并与正己烷制备豆粕(DSF-H)比较,对分离蛋白得率及热变性、豆粕残余极性脂和在贮藏过程中蛋白的氧化进行分析。DSF-B的蛋白得率(32.1%)比DSF-H高(约6%),蛋白热变性二者一致,且11S变性温度低于工业白豆片。残余极性脂分析,DSF-B比DSF-H总量低、磷脂含量高,脂肪酸组成有差异。模拟贮藏试验表明,DSF-B在贮藏中蛋白更易被氧化,这可能与极性脂的组成有关。亚临界萃取技术无高温处理、可选溶剂多样,可开发应用于大豆等植物蛋白制品。
亚临界丁烷 正己烷 豆粕 蛋白氧化
豆粕是大豆提取豆油后的副产品。它含有45%左右的蛋白质,氨基酸种类齐全,除蛋氨酸含量较低外,其余必需氨基酸含量均比较丰富,且含有大豆磷脂、大豆异黄酮等生物活性物质,营养价值高。作为优质植物蛋白原料,豆粕被广泛应用于畜禽饲料和商用脱脂大豆蛋白产品。但豆粕在生产及贮藏过程中,受加工方式、外部环境及水分、脂质、酶等因素影响,质量发生劣变,蛋白随之受到诱导变性,蛋白氧化是主要形式之一,严重降低其营养价值。
亚临界萃取技术是近20年发展起来的一项新的萃取分离技术[1]。在萃取过程中,萃取剂温度高于其沸点、始终为液态,利用相似相溶原理,萃取生物原料中的脂类物质。它的主要优点是低温工艺,不会对热敏性成分造成损害,目前已在精油、色素、植物油、药材等几十种植物原料脂溶性和水溶性成分的分离提取中得到应用[2]。同时,有研究报道植物油料应用亚临界丙烷和丁烷萃取工艺,保证了粕中植物蛋白等成分不变性[3]。以大豆为代表的食用油生产中,国内外大多采用正己烷作为浸出溶剂,工艺中的热处理会破坏油料中的有用成分,并且正己烷对神经系统有一定的毒性,人们已提出质疑并期望找到可替代溶剂。
对亚临界萃取技术的研究,目前主要集中在油脂、天然活性物质等有关成分的分离提取方面,对粕和蛋白的研究鲜见报道。本试验采用亚临界丁烷萃取技术制备豆粕,并与传统的正己烷制备豆粕进行比较,分析分离蛋白得率及热变性、豆粕残余极性脂和在贮藏过程中蛋白的氧化变性,以期为亚临界萃取技术中副产品的综合利用提供理论参考。
1 材料与方法
1.1 材料与设备
大豆和白豆片,市售;亚临界丁烷:广州深岩燃气有限公司;其他试剂为分析纯或色谱纯。
亚临界流体萃取装置:珠海共同机械有限公司;DYF-500摇摆式高压万能粉碎机:温岭市林大机械有限公司;KDN-102C定氮仪:上海纤检仪器有限公司;CR22G高速冷冻离心机:日本Hitachi公司;Alpha-4冷冻干燥机:德国Christ公司;SevenEasypH计:梅特勒-托利多仪器(上海)有限公司;UV2300紫外-可见分光光度计:上海天美科学仪器有限公司;Nano示差扫描量热仪:美国TA公司;GC5890-MS5975气相色谱质谱联用仪:美国安捷伦公司。
1.2 试验方法
1.2.1 脱脂豆粕的制备
亚临界丁烷萃取:大豆经清理除杂、粉碎,过30目筛,萃取压力0.4 MPa、温度40 ℃、时间30 min,重复3次。然后铺成薄层置于通风厨,并定期翻动,干燥24 h粉粹过60目筛。
正己烷浸提:大豆经清理除杂、粉碎,过60目筛,加入4倍体积正己烷浸提脱脂,温度40 ℃、时间30 min,重复3次。然后铺成薄层置于通风厨,并定期翻动,干燥24 h过60目筛。
1.2.2 分离蛋白的制备
脱脂豆粕经碱溶酸沉提取蛋白,采用Zheng等[4]的方法。
蛋白得率=(提取的蛋白干重/脱脂豆粕干重)×100%。
蛋白回收率=(提取的蛋白干重×蛋白含量)/(脱脂豆粕干重×豆粕蛋白含量)×100%。
1.2.3 豆粕主要指标测定
蛋白含量:参考GB/T 5009.5—2003,微量凯氏定氮法[5]。蛋白含量=含氮量×6.25。
极性脂含量:参考GB/T 2677.6—1994[6],用索氏抽提法测定极性脂含量,抽提溶剂为氯仿-甲醇(2∶1,V/V)。
极性脂含量(干基)=(极性脂质量/试样干重)×100%。
1.2.4 分离蛋白热变性测定
采用Meng等[7]的差示扫描热量法(DSC)。将约2 mg样品和10 μL、50 mmol/L、pH 7.0的磷酸缓冲液密封于铝盘中,以空白铝盘作对照,将样品以10 ℃/min加热速率由20 ℃加热至120 ℃。
1.2.5 豆粕残余极性脂分析
残余极性脂提取:称取豆粕3 g,加入15 mL氯仿-甲醇(2∶1,V/V),室温搅拌萃取30 min,10 400 r/min离心10 min取上清液备用,测脂肪酸和磷脂组成。
气相色谱-质谱联用(GC-MS):取适量上清液,氮吹除去溶剂,采用GB/T 17376—2008[8]酯交换法进行甲酯化。气相色谱条件:色谱柱HP-5MS(30 m×0.25 mm×0.5 μm),进样口温度250 ℃,载气流速(He)1.0 mL/min,进样量2.0 μL,分流比50∶1。采用程序升温,柱初温100 ℃,以10 ℃/min升温至280 ℃,保持10 min。离子源EI 70 ev,扫描范围50~450 amu。用面积归一化法确定各成分的相对含量。
薄层层析(TLC):取上清液20 μL点到硅胶H薄层板上,用氯仿/甲醇/冰醋酸/水(85∶15∶10∶3,V/V)混合液展开,取出,晾干,碘蒸气显色。
1.2.6 模拟贮藏豆粕
2种豆粕各取适量,均分为2份。各取1份100 ℃干热处理20 min。将4份豆粕(干热处理与未处理各2份)铺成薄层置于35 ℃密闭水浴锅吸收水分2 h,提高含水量。将上述豆粕放入密封瓶中,置于60 ℃烘箱存放,分别于第1、2、4、6天取样,4 ℃保存备用。进行一次重复试验。
1.2.7 豆粕蛋白的氧化指标测定
溶解度:精确称取0.02 g样品于消化管,参考GB/T 5009.5—2003微量凯氏定氮法[5]测定总氮含量;再精确称取0.35 g样品于20 mL去离子水中,室温下搅拌溶解1.5 h,以10 000 r/min离心20 min,取上清蛋白液5 mL于消化管,沸水浴浓缩至稠状物,按微量凯氏定氮法[5]测定可溶性氮含量。
蛋白含量=含氮量×6.25。
溶解度=(上清液中的蛋白含量/样品蛋白含量)×100%
羰基含量:取上述测溶解度的上清蛋白液,根据Huang等[9]的方法测定羰基含量。以上清液中每g蛋白所含μmol计。
自由巯基含量:精确称取0.35 g样品,加入20 mL、0.1 mol/L、pH 8.0磷酸缓冲液,该磷酸缓冲液含有l mmol/L EDTA(乙二胺四乙酸)和1% SDS(十二烷基硫酸钠),室温下搅拌溶解1 h。以10 000 r/min离心20 min,取上清蛋白液。根据Huang等[9]的方法测定自由巯基。以每g豆粕蛋白所含μmol计。
1.3 数据分析
利用SPSS 11.7和OriginPro 8软件进行数据统计分析及作图,数据以均值±标准差(Means±SD)表示,显著水平为P<0.05。
2 结果与讨论
2.1 豆粕主要成分
如表1所示,以市售WF作参照,DSF-B与DSF-H的蛋白含量和极性脂含量与之相近。DSF-B的极性脂含量比DSF-H略低,残余极性脂是影响豆粕品质和引起蛋白氧化变性的主要因素。
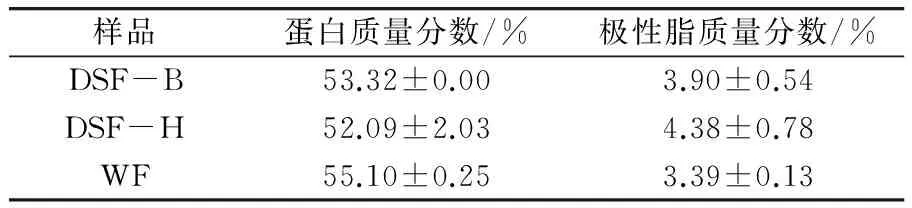
表1 豆粕主要成分(干基)
注:DSF-B和DSF-H分别是大豆采用亚临界丁烷(Butane)萃取和正己烷(Hexane)浸提脱油,制得脱脂豆粕(Defatted soybean flour),WF是市售白豆片(White flakes)。
2.2 蛋白质得率和回收率
蛋白得率的高低与生产大豆蛋白企业的经济效益直接相关,其变化范围一般为20%~30%[10],DSF-B蛋白得率为32.1%,比DSF-H高(约6%)。二者蛋白含量接近,故DSF-B的蛋白回收率相应比DSF-H高(图1)。

注:SPI-B、SPI-H及WF SPI分别是从DSF-B、DSF-H及WF提取的分离蛋白。
图1 3种豆粕的蛋白得率及回收率
2.3 分离蛋白的热变性
图2显示3种蛋白的7S和11S组分都有明显的特征吸收峰,说明蛋白变性程度低。表2列出了11S组分变性的起始温度(Tm)、峰值温度(Td)及焓变(ΔH),可知SPI-B与SPI-H的11S组分变性温度比WF SPI低。由于DSF-B与DSF-H采用自然干燥脱溶,全部处理温度最高仅为40 ℃,而市售WF目前常采用闪蒸脱溶和卧式脱溶,有不同时间的高温处理(闪蒸脱溶约2 s,卧式脱溶10~15 min)[11],蛋白结构更加稳定,使其热变性需要更高温度,所以可能导致SPI-B与SPI-H的11S组分变性温度比WF SPI低,具有较差的热稳定性。
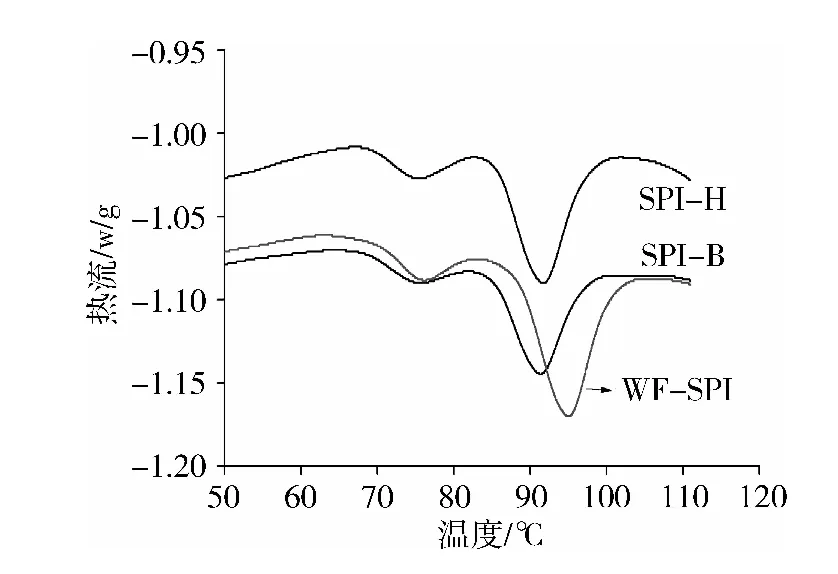
图2 分离蛋白的DSC图谱

样品Tm/℃Td/℃ΔH/J/g蛋白质SPI-B86.4±0.791.9±0.64.5±0.8SPI-H86.3±0.392.0±0.46.1±0.8WFSPI88.7±0.894.9±0.66.2±0.2
2.4 豆粕残余极性脂分析
棕榈酸、硬脂酸、油酸、亚油酸和亚麻酸是大豆中含量最多的5种脂肪酸,占出峰物质的99%以上[12]。从表3可见,脂肪酸含量高低顺序均依次为亚油酸、棕榈酸、油酸、硬脂酸、亚麻酸,但其相对含量有一定的差异。DSF-B的亚油酸和亚麻酸相对含量比DSF-H略高,而油酸含量明显低于DSF-H。大豆中丰富的脂肪氧合酶能催化含1,4-顺,顺-戊二烯结构的多不饱和脂肪酸(亚油酸、亚麻酸),发生脂质过氧化反应,产生的自由基、脂质氢过氧化物及活性醛类会使蛋白发生共价修饰,造成蛋白氧化[13]。

图3 极性脂的气相色谱图
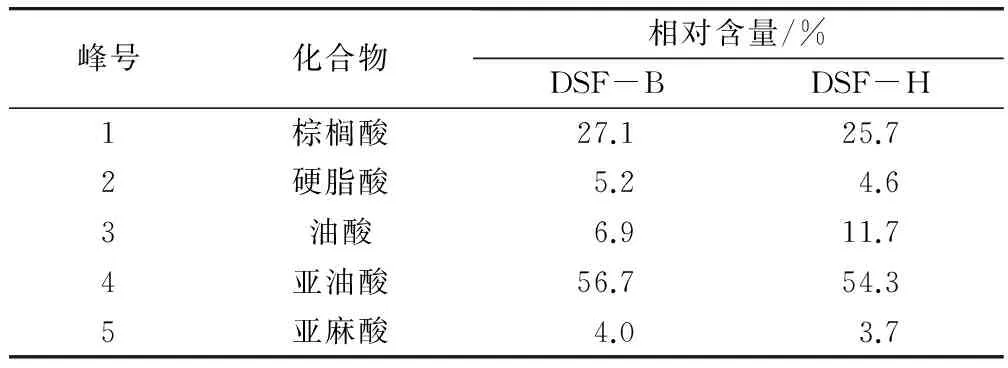
峰号化合物相对含量/%DSF-BDSF-H1棕榈酸27.125.72硬脂酸5.24.63油酸6.911.74亚油酸56.754.35亚麻酸4.03.7
残余极性脂含量DSF-B为3.90%,DSF-H为4.38%(见表1)。TLC分析表明(见图4),2种豆粕含有磷脂酰乙醇胺(PE)、卵磷脂 (PC),磷酯酰肌醇(PI)等磷脂,磷脂的含量和组成不同。图4可知,L是商业卵磷脂,从上至下3个主要组分依次为PE、PC、PI[14],可以看出DSF-B中磷脂含量较高,主要表现在PC较多。这是因为,丁烷比正己烷对磷脂的浸出量少,DSF-B残余的磷脂相应多。

图4 极性脂的TLC分析图
2.5 贮藏过程中蛋白的氧化评价
豆粕在贮藏过程中,水分、残余脂质、脂肪氧合酶等将导致其质量劣变,蛋白氧化随之发生。脂肪氧合酶在60 ℃左右有一个激活态,酶被激发出更高的活力[15]。试验中为了较快分析豆粕在贮藏中蛋白的变化,贮藏前使豆粕吸收水分成为高水分豆粕,温度采用60 ℃,以构建一个高温高湿环境模拟加速氧化。同时对经过100 ℃干热处理20 min的豆粕进行试验。贮藏1、2、4、6 d后,分别对蛋白溶解度、羰基和自由巯基进行测定。
2.5.1 溶解度变化
溶解度在一定程度上反映了蛋白的变性程度。从图5可知:豆粕经100 ℃、20 min干热处理,溶解度保持不变;随着贮藏时间的延长,溶解度均显著下降;经干热处理后,溶解度下降明显比未干热的缓和,但贮藏到第6天时,同样降至很低。Pro-B与DH Pro-B分别比Pro-H与DH Pro-H,溶解度下降相对较快。说明经适度干热灭酶处理不影响蛋白的溶解度,且能减缓溶解度降低,干热与否Pro-B均比Pro-H更易氧化变性。
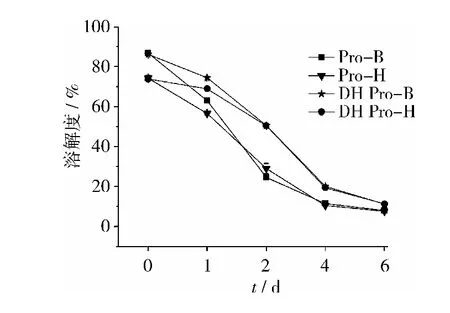
注:Pro-B和Pro-H分别是DSF-B和DSF-H中的蛋白。DH Pro-B和DH Pro-H分别是经100 ℃干热(Dry heat)处理20 min的DSF-B和DSF-H中的蛋白。
图5 贮藏过程中溶解度变化
2.5.2 羰基含量
蛋白质氨基酸侧链的氧化可导致羰基产物的积累,蛋白质羰基含量是蛋白质氧化损伤的敏感指标[16]。图6显示,在贮藏过程中,羰基含量逐渐增加,这是大豆脂肪氧合酶酶促氧化积累的结果。羰基含量:DH Pro-B低于Pro-B,DH Pro-H低于Pro-H;DH Pro-B高于DH Pro-H,Pro-B高于Pro-H。另外,在第6天时,由于Pro-B和Pro-H的溶解度过低,无法测出羰基含量。说明经适度干热灭酶处理可以减少贮藏中蛋白的氧化损伤,干热与否Pro-B均比Pro-H更易氧化。
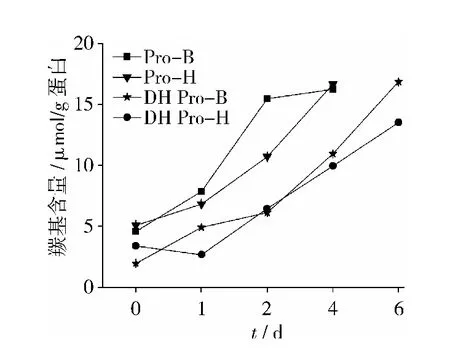
图6 贮藏过程中羰基含量变化
2.5.3 自由巯基含量
半胱氨酸残基可能是最敏感的氨基酸残基,将巯基转化为其他含硫氧化物是蛋白氧化的早期现象之一[17]。如图7所示,在贮藏前2天,Pro-B与DH Pro-B自由巯基含量逐渐减少,而Pro-H与DH Pro-H是先增加后减少。第2天之后,Pro-B与Pro-H的自由巯基含量持续下降,而DH Pro-B与DH Pro-H则基本保持不变。自由巯基含量降低,意味着蛋白质发生了变性,可能通过形成分子间二硫键聚集发生了氧化。自由巯基含量升高,是蛋白分子展开、内部基团暴露的结果。说明干热灭酶处理能减弱自由巯基的氧化,干热与否Pro-B在贮藏初期表现出比Pro-H较易氧化。
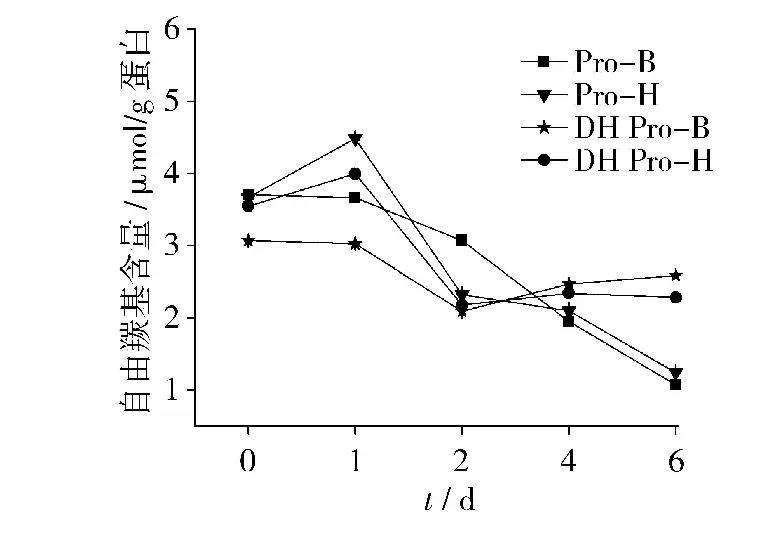
图7 贮藏过程中自由巯基含量变化
残余极性脂作为诱导豆粕蛋白氧化变性的主要因素,尽管DSF-B含量低于DSF-H,其油酸相对含量明显低于豆粕-H,但贮藏过程中Pro-B更易被氧化。亚油酸和亚麻酸可以发生脂质过氧化反应,而油酸不能,DSF-B的亚油酸和亚麻酸相对含量比DSF-H略高,Pro-B更易被氧化可能与此有关。
3 结论
与正己烷制备豆粕相比,亚临界丁烷脱脂豆粕蛋白得率较高,残余极性脂总量低而磷脂(主要是PC)含量较高,在贮藏过程中蛋白更易被氧化,这可能与残余极性脂组成差异有关。
[1]祁鲲. 液化石油气浸出油脂工艺; 中国, 90108660.6 [P]. 1990
[2]刘月蓉, 陈晞, 郑建灿, 等. 亚临界萃取设备在天然产物有效成分提取中的应用[J]. 莆田学院学报, 2012, 19 (2) : 73-75
[3]祁鲲. 亚临界溶剂生物萃取技术的发展及现状[J]. 粮食与食品工业, 2012, 19(5) : 5-8
[4]郑二丽. 分级分离技术制备大豆蛋白及其性质的研究[D]. 广州: 华南理工大学, 2012
[5]GB/T 5009. 5-2003,微量凯氏定氮法[S]
[6]GB/T 2677.6-1994,造纸原料有机溶剂抽出物含量的测定[S]
[7]Meng G T, Ching K M, Ma C Y. Thermal aggregation of globulin from an indigenous Chinese legume, Phaseolus angularis(red bean)[J]. Food Chemistry, 2002, 79: 93-103
[8]GB/T 17376-2008/ ISO 5509:2000, 动植物油脂 脂肪酸甲酯制备[S]
[9]Huang Y R, Hua Y F, Qiu A Y.Soybean protein aggregation induced by lipoxygenase catalyzed linoleic acid oxidation[J]. Food Research International, 2006, 39: 240-242
[10]李桂菊, 王晓强, 何启刚, 等. 碱溶时间对大豆蛋白提取率和得率的影响[J]. 安徽农业科学, 2011, 39 (4) : 2292-2293
[11]胡小中, 温光源. 低温豆粕生产工艺现状分析[J]. 粮油食品科技, 2004, 12(5) : 32-34
[12]王晓燕, 张彩英, 贾晓艳. 河北省大豆品种脂肪酸组成与含量分析[J]. 河北农业大学学报, 2007, 30(2):16-18
[13]许瑛瑛, 华欲飞. 脂肪氧合酶催化亚油酸影响因素的研究[J]. 粮油食品科技, 2002, 10(3): 11-13
[14]吴娜娜. 大豆油体及大豆油体-卡拉胶乳液稳定性研究[D]. 广州: 华南理工大学, 2012
[15]鄢全, 王洪晶, 华欲飞. 脱脂豆粕中脂肪氧合酶的干热灭酶工艺研究[J]. 中国油脂, 2006, 31(4):13-16
[16]Stanley T, Omave P Z. β-Carotene and protein oxidation: effects of ascorbic acid and α-tocopherol[J]. Toxicology, 2000, 146: 37-47
[17]Buttkus H A. The reaction of malondialdehyde or oxidized linolenic acid with sulphydryl compounds [J].Journal of the American Oil Chemists’ Society, 1972, 49:613-614.
Oxidation Stability of Protein from Defatted Soybean Flour Produced by Subcritical Butane
Zhu Leping Yang Xiaoquan
(Research and Development Center of Food Proteins, College of Light Industry and Food,South China University of Technology, Guangzhou 510640)
The soybean has been defatted by subcritical butane extraction and n-hexane extraction to obtain defatted soybean flour-butane (DSF-B) and produce defatted soybean flour-hexane (DSF-H) respectively in the paper. The yield and thermal properties of proteins and residual polar lipid were analyzed and conducted comparation, as well as protein oxidation in the storage process of defatted soybean flour. The results indicated that protein yield of DSF-B was about 6% higher than that of DSF-H. Thermal properties of proteins had no difference; the denaturation temperature of both 11S proteins was lower than that for industrial white flakes. The content and composition of residual polar lipid had differences. During defatted soybean flour storage, protein from DSF-B was easier to be oxidized. The subcritical extraction technology with several optional solvent and no-high-temperature processes can be developed for vegetable protein products.
subcritical butane, n-hexane, defatted soybean flour, protein oxidation
TS214.2
A
1003-0174(2016)03-0042-05
粤港关键领域重点突破项目(2012A080107006)
2014-08-11
朱乐平,女,1988年出生,硕士,粮食、油脂与植物蛋白工程
杨晓泉,男,1965年出生,教授,博士生导师,蛋白质化学和综合利用

