TAC对luminal B型乳腺癌的新辅助化疗疗效观察与预后分析
杨福兰,倪 军,黄兴伟,习 勋
(南昌大学附属赣州医院,赣州市人民医院普外二科,江西 赣州 341000)
TAC对luminal B型乳腺癌的新辅助化疗疗效观察与预后分析
杨福兰,倪 军,黄兴伟,习 勋
(南昌大学附属赣州医院,赣州市人民医院普外二科,江西 赣州 341000)
目的 观察TAC方案对不同亚型luminal B型乳腺癌的新辅助化疗疗效并分析其预后。方法 收集2011年6月至2015年6月住院并完成TAC方案新辅助化疗至少4个周期的luminal B型乳腺癌患者111例,根据巴德针穿刺标本免疫组织化学分为3组:Her-2阴性且ki≥14%组(1组),Her-2阳性且ki≥14%组(2组)和Her-2阳性且ki<14%组(3组),收集其临床病理资料并随访复发转移事件。结果 各组患者发病年龄、肿瘤大小、TNM分期、淋巴结状态、组织学分级及临床疗效比较差异无统计学意义(均P>0.05);5.4%(6/111)达病理完全缓解(pCR),病理有效(2~3级)率为78.4%,临床有效(CR+PR)率为76.6%;1组患者病理有效率较另外2组高,差异有统计学意义(P<0.05);各亚组无病生存率(disease free survival, DFS)不同,3组时间最长,1组次之,2组最低,组间比较差异具有统计学意义(P<0.05)。结论 不同亚型luminal B型乳腺癌患者采用TAC方案新辅助化疗的病理疗效不同,其中Her-2阴性且ki≥14%亚型患者的病理有效率更高。尚未有条件行靶向治疗的Her-2阳性luminal B型乳腺癌患者采用TAC方案新辅助化疗可获得较好的疗效和预后。
乳腺癌; luminal B型; 新辅助化疗; 疗效观察; 预后分析
乳腺癌是世界上女性最常见的恶性肿瘤之一,占全部女性恶性肿瘤的22.9%,在中国占女性全身各种恶性肿瘤的19.17%[1-2]。新辅助化疗(NAC)目前已成为局部晚期乳腺癌的标准治疗,NAC后若能达到病理完全缓解(pCR),可提高远期生存率[3]。乳腺癌作为一类分子水平上具有高度异质性的全身性慢性疾病,近年来提倡的个体化综合性治疗使患者的无病生存率、总生存率及保乳率得到了明显地提高。本研究回顾性分析2011年6月至2015年6月本院乳腺外科收治的111例luminal B型乳腺浸润性导管癌,参照2013年瑞士国际乳腺癌大会St.Gallen等共识提出的乳腺癌分子亚型的分类标准[4],采用免疫组织化学(IHC)检测NAC前乳腺癌穿刺癌组织标本分子指标,包括ER、PR、Her-2、ki-67等,对乳腺癌进行分子分型,观察luminal B型乳腺癌3种亚型对蒽环联合紫衫类TAC方案NAC治疗的疗效及其预后。
1 资料与方法
1.1 一般资料
选择2011年6月至2015年6月赣州市人民医院乳腺外科收治并行TAC方案NAC的原发性乳腺浸润性导管癌463例,根据分子分型标准[4],其中luminal B型有111例,均为女性,年龄35~68岁,中位年龄42岁;就诊前均未接受化疗、内分泌治疗或局部放疗,具有可评价病灶,肿瘤直径2~6 cm;化疗前TNM分期ⅡB期40例,ⅢA期42例,ⅢB期29例,乳腺癌分期按美国肿瘤联合会TNM分期标准(2002年第6版)。
1.2 治疗方法
化疗前常规进行胸部CT、腹部彩超及全身骨显像等检查,均无明确的远处转移病灶,并全部经超声引导下巴德针穿刺,病理明确为乳腺浸润性导管癌,同时检测穿刺癌组织中ER、PR、Her-2及ki-67的表达情况。化疗方案:TAC方案,环磷酰胺500 mg·m-2,静脉注射,第1天;吡柔比星50 mg·m-2,静脉注射,第1天;多西他赛75 mg·m-2,静脉注射,第2天,21 d为1个周期。均顺利完成至少4个周期NAC后行手术治疗。术后参照美国国立综合癌症网(NCCN)乳腺癌指南及患者意愿选择术后治疗方案。
1.3 标本ER、PR、Her-2、ki-67检测结果判定及分组标准
1.3.1 标本
经巴德针穿刺取得的标本,用10%中性甲醛固定、石蜡包埋、切片,采用IHC方法检测ER、PR、Her-2及ki-67的表达,其中Her-2(2+)既往未行荧光原位杂交(FISH)检测患者,取其蜡块标本本院补行FISH检测,参照实验说明书进行操作。
1.3.2 结果判定
由病理科两位资深专业人员单独阅片,采用光学显微镜观察。参照美国临床肿瘤学会(ASCO)/美国病理学家学会(CAP)推荐的2011年版ER、PR、Her-2及ki-67 IHC检测标准。
ER、PR蛋白表达以细胞核内出现棕黄色颗粒为阳性染色,阳性细胞比例<1%为(-),1%~25% 为(+),>25%~50%为(),>50%为()。
Her-2定位于细胞膜或细胞质,无染色或<10%的浸润癌细胞胞膜染色为(-);≥10%的胞膜微弱的或不完整的膜染色为(+);≥10%的细胞呈现弱至中等强度,完整但不均匀的细胞膜棕黄着色,或<30%的细胞呈现强且完整的细胞膜棕褐着色为();≥30%的细胞出现强的完整的细胞膜棕褐染色为()。
本研究根据Jalava等[5]的研究将ki-67表达强度分为3个等级:阳性细胞数≤14%为弱阳性(+),>14%且≤30%为阳性(),>30%为强阳性()。
1.3.3 分型及分组标准
按2013年St.Gallen分子分型标准:ER和(或)PR阳性,1)luminal B型(Her-2阴性):Her-2阴性,且ki-67高表达或PR低表达;2)luminal B(Her-2阳性):Her-2阳性(蛋白过表达或基因扩增),任何状态的ki-67。ki-67以14%作为高低表达的界值[6],PR以20%作为高低表达的判定界值[7]。
本研究根据Her-2和ki-67表达情况将luminal B型乳腺癌分为3个亚型,1组:Her-2阴性且ki≥14%;2组:Her-2阳性且ki≥14%;3组: Her-2阳性且ki<14%。
1.4 疗效评判标准
1.4.1 临床疗效
评价按国际实体瘤疗效(RECIST)评判标准。1)临床完全缓解CR:临床检查肿瘤完全消失;2)临床部分缓解PR:肿瘤最大直径与最大垂直径的乘积减少≥50%;3)疾病稳定SD:肿瘤最大直径与垂直径的乘积减少<50%或增大<25%;4)疾病进展PD:肿瘤最大直径与最大垂直径的乘积减少增大≥25%[8]。总有效率(RR)=(CR+PR)例数/总例数×100%。每2个周期化疗结束后下一周期化疗前评估疗效,有效(PR、CR)则继续原方案化疗,若无效(SD)或进展(PD),可考虑换方案或条件允许行手术,但此部分未完成满4个周期NAC患者不纳入研究。
1.4.2 术后病理效果
按卫生部2011年版《乳腺癌诊疗规范》。0级:无效应,癌细胞在治疗后几乎无变化;1级:轻微反应指癌细胞轻度变性改变,癌细胞能存活;2级:明显反应指癌细胞严重的变性破坏,不能存活;3级:完全反应,所有癌组织发生坏死或消失,或完全被肉芽组织和(或)纤维组织替代,包括少量导管内癌成分残留。
病理完全缓解(pCR):新辅助化疗后原发肿瘤区域及区域淋巴结均无浸润性癌残留,其中残留原位癌也认定为pCR,达pCR患者属于术后3级反应。0~1级视为病理无效。2~3级视为病理有效。
1.5 统计学方法
数据分析应用SPSS 20.0软件处理,计数资料的比较采用卡方检验或Fisher确切概率法;生存分析采用Log-rank检验,以P<0.05为差异有统计学意义。
2 结果
2.1 不同分子亚型乳腺癌患者一般临床特征
Luminal B型3组患者共111例,发病年龄35~68岁,中位年龄42岁。各亚组luminal B型乳腺癌在发病年龄、原发肿瘤大小、肿瘤TNM分期、淋巴结状况及组织学核分级上的差异均无统计学意义,P>0.05。见表1。
2.2 不同分子亚型乳腺癌患者的疗效反应
111例中达pCR患者6例,约5.4%,主要为1组Her-2阴性且ki≥14%的患者5例,经统计学分析各亚组pCR率和临床疗效间差异均无统计学意义(前者P=0.645,后者P=0.203)。各亚组病理疗效间差异有统计学意义(P=0.049),1组患者较2组和3组患者病理有效率高。见表1。
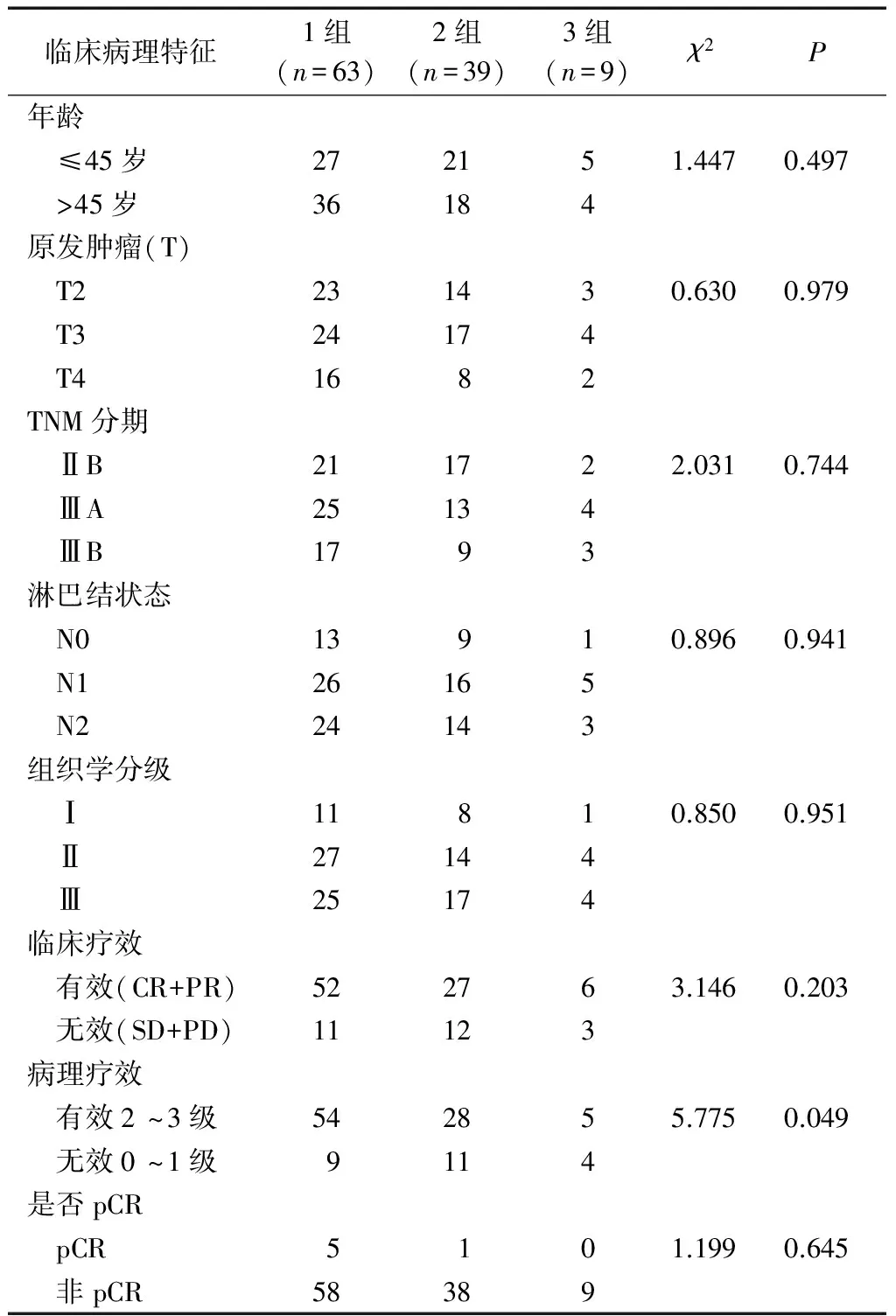
表1 luminal B型患者一般临床病理资料 例
2.3 3组的无病生存率对比分析
3个亚型中,Her-2阳性、ki-67<14%者(3组)中位DFS为46.2个月,Her-2阴性、ki-67≥14%者(1组)中位DFS为42.7个月,Her-2 阳性、ki-67≥14%者(2组)中位DFS为35.9个月。Log-rank 检验显示3组的DFS时间最长,1组其次,2组最低,各组间差异具有统计学意义(P<0.05)。见图1。
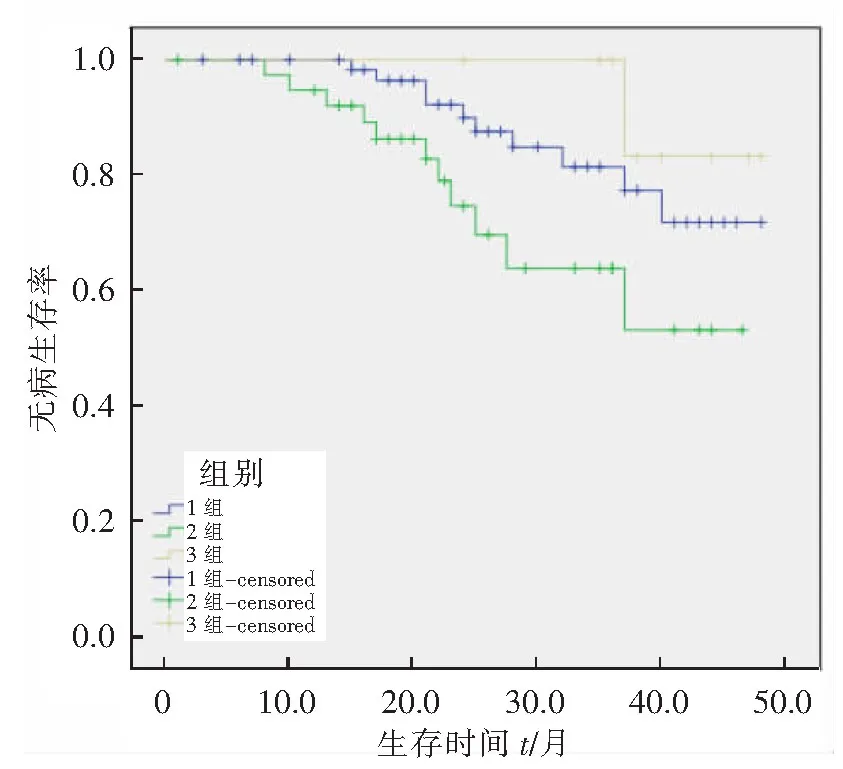
图1 Log-rank无病生存率对比
3 讨论
乳腺癌是一类高度异质性的恶性肿瘤,无论在组织形态、免疫表型、生物学行为还是治疗反应上都存在着极大的差异。2001年,Sørlie等[9]通过cDNA微阵列技术,将乳腺癌分为5个亚型:luminal A、luminal B、HER-2型、基底细胞样型和正常乳腺样型,不同亚型的治疗方法和预后明显不同。2011年St.Gallen共识[10]将luminal B型乳腺癌定义为:ER(+)和(或)PR(+):1)Her-2阴性且ki-67≥14%;2)Her-2阳性、任何状ki-67。2013年St.Gallen乳腺癌大会上形成的最新版St.Gallen 共识[4]也将PR状态加入到乳腺癌的分子分型中,将PR≤20%的luminal型归入预后较差的luminal B型中。故本研究根据Her-2和ki-67对luminal B型乳腺癌患者行TAC方案新辅助化疗的疗效进行亚型分析。
luminal B型乳腺癌具有难治性的临床特点,其中对内分泌治疗不如luminal A型乳腺癌敏感,而对化疗又不如Her-2过表达型和三阴性型敏感。本研究中luminal B型乳腺癌中Her-2阴性且ki-67高表达组(1组)患者的病理有效率较另外2组高,差异有统计学意义,与Anderson等[11]研究结果相似。其中1组和2组的区别在于Her-2表达的差异,因此验证Her-2是一个疗效预测指标。同时Her-2也是乳腺癌曲妥珠单抗靶向治疗的靶点,Her-2阳性luminal B型乳腺癌患者建议行化疗、靶向治疗及内分泌等综合性治疗[4]。
由于曲妥珠单抗治疗费用昂贵,相当部分的Her-2阳性乳腺癌患者不具有使用曲妥珠单抗治疗的经济能力。本研究显示luminal B型3个亚组病理有效率分别为88.9%、71.8%、55.6%,3组患者均有较高的病理有效率,意味着新辅助化疗中Her-2阳性患者没有条件使用曲妥珠单抗靶向治疗情况下,选择蒽环联合紫衫类TAC方案化疗疗效可靠,被NCCN指南和St.Gallen共识所推荐。对于有经济能力的Her-2阳性患者,选用含曲妥珠单抗的新辅助化疗方案有利于提高其pCR率[12-13],有望改善远期预后。
本研究还发现,3个亚型中,Her-2阳性,ki-67<14%(3组)者中位DFS最长(约46.2个月),其次为Her-2阴性,ki-67≥14%(1组)者(约42.7个月),而Her-2阳性,ki-67≥14%(2组)者中位DFS最短(约35.9月)。其中,1组和2组区别在于Her-2的表达,因此,Her-2阳性可能是影响这2组DFS的因素之一。2组和3组均为Her-2阳性,2组的区别在于2组为ki-67≥14%,3组为ki-67<14%,因此,ki-67的高低可能是影响这2组DFS的因素之一。既往研究发现,ki-67与肿瘤恶性程度呈正比,与肿瘤的生长、侵袭及转移能力密切相关,是乳腺癌疗效和预后判断的一项重要指标[14]。因此,本研究提示Her-2阳性及ki-67高表达均为luminal B型乳腺癌预后不良指标。
综上所述,具有难治性特点的luminal B型乳腺癌是一个异质性明显群体,根据Her-2和ki-67表达不同分为3个亚型的新辅助化疗疗效和预后有所不同。TAC方案在3个亚型中有较好的治疗反应性,但对于有经济能力的Her-2阳性患者加入曲妥珠单抗进行新辅助化疗有利于进一步提高pCR率,延长无病生存率和总生存率。因本研究病例数较少,长期预后随访时间较短,以后将扩大样本量和继续定期随访做进一步研究。
[1] Ferlay J,Shin H R,Bray F,et al.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J].Int J Cancer,2010,127(12):2893-2917.
[2] 王书学,陈利,董可新,等.北京市密云地区2534例恶性肿瘤疾病谱特点分析[J].实用肿瘤杂志,2013,28(1):81-84.
[3] Liu S V,Melstrom L,Yao K,et al.Neoadjuvant therapy for breast cancer[J].J Surg Oncology,2010,101(4):283-291.
[4] Goldhirsch A,Winer E,Coates A,et al.Personalizing the treatment of women with early breast cancer:highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2013[J].Ann Oncol,2013,24(9):2206-2223.
[5] Jalava P,Kuopio T,Juntti Patinen L,et al.Ki67 immunohistochemistry:a valuable marker in prognostication but with a risk of misclassification:proliferation subgroups formed based on Ki67 immunoreactivity and standardized mitotic index[J].Histopathology,2006,48(6):674-682.
[6] Cheang M C,Chia S K,Voduc D,et al.Ki67 index,HER2 status,and prognosis of patients with luminal B breast cancer[J].J Nati Cancer I,2009,101(10):736-750.
[7] Prat A,Cheang M C,Martín M,et al.Prognostic significance of progesterone receptor-positive tumor cells within immunohistochemically defined luminal A breast cancer[J].J Clini Oncol,2013,31(2):203-209.
[8] Scholl S,Fourquet A,Asselain B,et al.Neoadjuvant versus adjuvant chemotherapy in premenopausal patients with tumours considered too large for breast conserving surgery:preliminary results of a randomised trial:S6[J].Eur J Cancer,1994,30(5):645-652.
[9] Sørlie T,Perou C M,Tibshirani R,et al.Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications[J].P Nati A Sci India A ,2001,98(19):10869-10874.
[10] Goldhirsch A,Wood W,Coates A,et al.Strategies for subtypes-dealing with the diversity of breast cancer:highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011[J].Ann Oncol,2011,22(8):1736-1747.
[11] Anderson H,Hills M,Zabaglo L,et al.Relationship between estrogen receptor,progesterone receptor,HER-2 and Ki67 expression and efficacy of aromatase inhibitors in advanced breast cancer[J].Ann Oncol,2011,22(8):1770-1776.
[12] Fisher E R,Wang J,Bryant J,et al.Pathobiology of preoperative chemotherapy:findings from the National Surgical Adjuvant Breast and Bowel (NSABP) protocol B-18[J].Cancer,2002,95(4):681-695.
[13] Gianni L,Eiemann W,Semiglazow V,et al.Neoadjuvant chemotherapy with trastuzumab followed by adjuvant trastuzumab versus neoadjuvant chemotherapy alone,in patients with HER2-positive locally advanced breast cancer (the NOAH trial):a randomised controlled superiority trial with a parallel HER2-negative cohort[J].Lancet,2010,375(9712):377-384.[14] Suciu C,Muresan A,Cornea R,et al.Semi-automated evaluation of Ki-67 index in invasive ductal carcinoma of the breast[J].Oncology letters,2014,7(1):107-114.
(责任编辑:刘大仁)
2015-10-20
赣州市科技局指导性科技计划项目(G22015ZSF190)
黄兴伟,主任医师,E-mail:hxingwei2010@163.com。
R737.9
A
1009-8194(2016)03-0032-04
10.13764/j.cnki.lcsy.2016.03.013

