Wx基因对小麦淀粉合成关键酶活性的影响
覃 鹏 孔治有 刘叶菊 唐永生 杨俊华
(云南农业大学农学与生物技术学院1, 昆明 650201) (保山学院资环学院2, 保山 678000) (云南农业大学研究生处3, 昆明 650201) (曲靖市农业科学院4, 曲靖 655000) (德宏州农业科学研究所5, 芒市 678400)
Wx基因对小麦淀粉合成关键酶活性的影响
覃 鹏1孔治有2刘叶菊3唐永生4杨俊华5
(云南农业大学农学与生物技术学院1, 昆明 650201) (保山学院资环学院2, 保山 678000) (云南农业大学研究生处3, 昆明 650201) (曲靖市农业科学院4, 曲靖 655000) (德宏州农业科学研究所5, 芒市 678400)
为研究Wx基因的缺失对小麦淀粉合成关键酶活性的影响,本试验以8个Wx小麦近等基因系为材料,在灌浆期的10、20、30和40 d取籽粒对ADP-葡萄糖焦磷酸化酶(AGPase)、可溶性淀粉合成酶(SSS)、颗粒结合型淀粉合成酶(GBSS)和淀粉分支酶(SBE)活性进行了测定。结果表明:野生型的AGPase、SSS、GBSS和SBE活性在花后所有时期均最高(GBSS花后40 d除外,处于中间水平),而WxABD型4种淀粉合成相关酶活性几乎在整个灌浆期均低于其余基因型,尤其是WxABD型的GBSS活性尽管也呈现先升高后降低、20 d左右达到高峰的趋势,但其升高或降低的幅度很小,其活性相对较为稳定。研究证明小麦Wx基因缺失对淀粉合成关键酶活性影响较大,依次为Wx-D1>Wx-A1>Wx-B1;淀粉合成关键酶活性在花后逐渐增加,以花后20 d最大,此后逐渐降低,到40 d达最低值;WxABD型缺失所有Wx基因,淀粉合成酶活性在花后各时期最低,其中GBSS活性远低于其余基因型且在花后各时期变化较小。
小麦 淀粉合成关键酶活性Wx近等基因系 灌浆期
淀粉是小麦籽粒的重要组成部分,是由小麦叶、鞘等绿色器官制造的光合同化物以蔗糖的形式运输到籽粒胞液、再在一系列酶的催化作用下转化为腺苷二磷酸葡萄糖(ADPG)或葡萄糖-6-磷酸(G-6-P)、最后转运至淀粉质体中合成籽粒淀粉[1-2]。蔗糖合成酶(SS)催化籽粒中的蔗糖降解为尿苷二磷酸葡萄糖(UDPG)和果糖,为淀粉的生物合成提供原料[3];磷酸蔗糖合成酶(SPS)主要是将6-磷酸果糖(F-6-P)转变合成为6-磷酸蔗糖[4-6];腺苷二磷酸葡萄糖焦磷酸化酶(AGPase)是ADP-葡萄糖,即形成直链淀粉和支链淀粉的骨架的合成酶,因此是淀粉生物合成的限速酶[7];颗粒结合性淀粉合成酶(GBSS)作用于α-1,4-糖苷键,只负责直链淀粉的合成;可溶性淀粉合成酶(SSS)催化将葡萄糖分子转移到淀粉引物上,使淀粉链延长[8];淀粉分支酶(SBE)催化α-1,4-糖苷键水解,形成α-1,6-糖苷键而在淀粉链上形成分支[9-11];脱分支酶(DBE)水解α-1,6-糖苷键以调节分支和支链淀粉结晶度[12-14]。所有酶活性在灌浆期均呈单峰曲线,在花后10~25 d达到峰值[15-17]。
由Waxy基因(Wxgene)编码的颗粒结合型淀粉合成酶(Granule bound starch synthase,GBSS)是合成直链淀粉的关键酶。六倍体小麦的Waxy蛋白受3个不同的Wx基因编码,其缺失、突变或遗传表达障碍会使胚乳中直链淀粉含量减少和支链淀粉含量增加[18-21]。Wx基因的缺失在很大程度上会影响小麦的淀粉含量,但是对于作为淀粉合成关键酶活性的影响鲜见报道,而此前有关小麦淀粉合成的研究因受到遗传背景的限制会有很大程度的局限性。本研究将Wx基因转入宁麦14并不断回交获得的8个近等基因系具有相同遗传背景,而以其研究Wx基因对小麦淀粉合成关键酶活性的影响,可以排除其他因素对研究结果所造成的影响,真实反映Wx基因对小麦淀粉合成关键酶的作用,对进一步研究Wx基因对小麦淀粉品质和农艺性状的影响具有重要意义。
1 材料与方法
1.1 材料
以普通非糯小麦品种宁麦14与糯小麦品系Wx扬繁9进行杂交,以后每代均选取与母本农艺性状接近且基因型为Wx-A1、Wx-B1、Wx-D1 3个位点均杂合的单株作父本进行连续回交,杂合单株的判断方法为用0.07%I2-KI溶液对杂交和回交后代花粉染色并用显微镜检查,淘汰全部呈现黑色(深蓝色)的单株,而约1/8花粉呈黄色、7/8花粉呈黑色的单株予以保留并挂牌作为父本。到BC7F1自交获得BC7F2群体,分子标记选择最终获得8个Wx近等基因系(表1)。
8个小麦Wx近等基因系于2013年11月种植于保山学院基地,花后每隔10 d取样测定籽淀粉合成关键酶活性。

表1 8个小麦Wx近等基因系
注:+表示显性,-表示隐性。
1.2 方法
从开花起标记同一天开花的8个基因型的穗子,在花后10、20、30、40 d取样,每个基因型每次取5穗(即5次重复);剥取中部的4个小穗籽粒用于淀粉合成关键酶活性的测定和分析。
AGPase、SSS、GBSS和SBE的测定参照谭彩霞等[22]的方法略作改进。测定仪器为DR6000紫外分光光度计:美国哈希(HACH)公司。
1.3 统计分析
每个基因型重复5次,以SAS9.0进行统计分析,显著性标记为P<0.05和P<0.01。
2 结果与分析
在8种基因型之间以及花后不同时间之间,AGPase、SSS、GBSS和SBE等4种酶的活性均达到极显著差异(表2)。

表2 淀粉合成关键酶活性方差分析(F值)
注:*表示0.05显著水平,**表示0.01显著水平。
野生型的AGPase、SSS、GBSS和SBE活性均最高、而WxABD的均最低,其他基因型介于二者之间(表3);Wx-D1基因的缺失对4种淀粉合成关键酶活性的影响最大、Wx-A1次之而Wx-B1最小,但差异均未达显著水平。
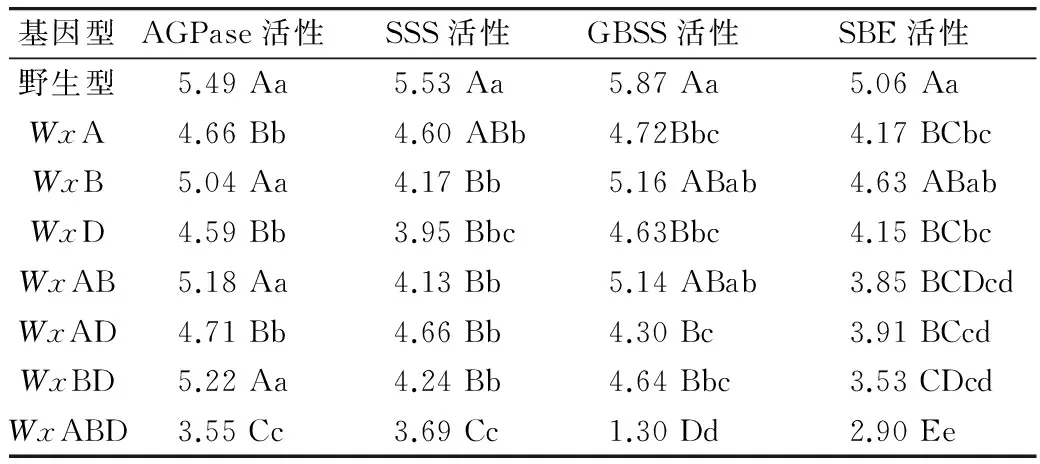
表3 各Wx基因型之间淀粉合成相关酶活性差异显著性/nmol/(1 000粒·min)
注:表中每列相同字母表示无显著差异。大写字母表示0.01显著水平,小写字母表示0.05显著水平。下同。
随花后时间推移,AGPase、SSS、GBSS和SBE活性均呈先升高、花后20 d达最大值、此后急剧降低的变化,到花后40 d、即籽粒基本成熟时酶活性最低(表4)。
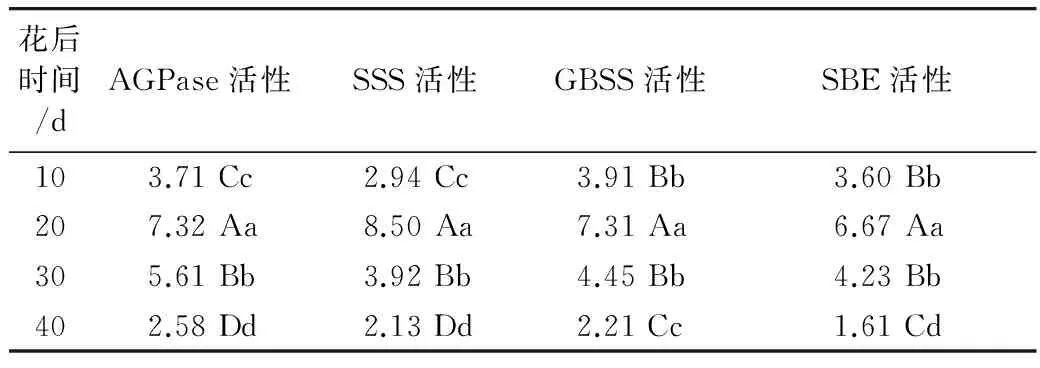
表4 花后不同时间淀粉合成关键酶活性差异显著性/nmol/(1 000 粒·min)
所有基因型的AGPase、SSS、GBSS和SBE(图1)活性在花后随灌浆时间的延长而逐渐增加、20 d左右达到峰值、随后急剧降低。其中野生型的AGPase、SSS、GBSS和SBE活性在花后所有时期均最高(GBSS花后40 d除外,处于中间水平);在灌浆10 d时,WxAB的AGPase活性最高、GBSS活性也仅次于野生型,而其SBE活性最低;WxABD型4种淀粉合成相关酶活性几乎在整个灌浆期均低于其余基因型,尤其是WxABD型的GBSS活性尽管也呈现先升高后降低、20 d左右达到高峰的趋势,但其升高或降低的幅度很小,其活性相对较为稳定。
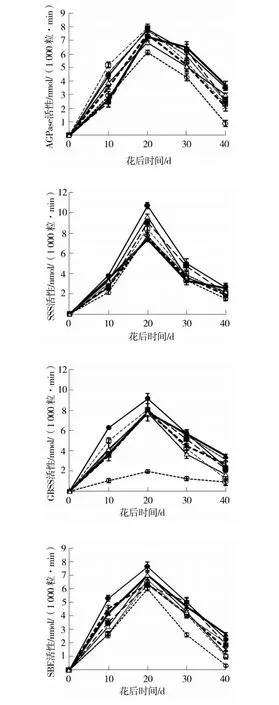
图1 灌浆期小麦Wx近等基因系AGPase、SSS、GBSS和SBE活性
3 讨论
作为淀粉合成关键酶之一,颗粒结合型淀粉合成酶(GBSS)由Wx-A1、Wx-B1、Wx-D1等3个基因位点控制,控制这小麦籽粒中直链淀粉的合成。淀粉合成的机理非常复杂,遗传因素和环境因素都会对淀粉的合成产生影响,此前的一些研究由于对遗传和环境影响很难严格控制,难免引起最终结果与实际情况产生偏离。本研究采用遗传背景一致、仅3个Wx基因位点存在差异的8个近等基因系作为材料,另外种植环境和栽培管理措施完全一样,从而排除遗传和环境因素的干扰,可以真实体现3个Wx基因的缺失与否对淀粉合成关键酶产生的影响,可丰富淀粉合成机理相关理论,为将来小麦Wx基因的进一步研究及利用突进提供参考。
本研究中,野生型的AGPase、SSS、GBSS和SBE活性均最高,而WxABD的均最低,其他基因型介于二者之间,表明任何Wx基因的缺失都会导致淀粉合成关键酶活性的降低,并可能最终导致淀粉合成速度的减缓及最终籽粒内淀粉含量的减少。其中Wx-D1基因的缺失影响最大,降低淀粉合成酶活性的效果最为显著。随开花时间的延长和灌浆的进行,AGPase、SSS、GBSS和SBE活性均急剧增加,反映了小麦籽粒从花后逐渐开始灌浆,随时间延长灌浆进程加快的趋势;在花后20 d达最大值,表明此时灌浆速率最快,因淀粉合成关键酶活性的增强而产生更多的淀粉,是淀粉合成的关键时期,因此对水分和营养的需求也必然到达顶点;随后又急剧降低、到花后40 d籽粒基本成熟时酶活性降到最低,表明灌浆和淀粉合成经过一段时间的高速阶段后自然减缓,也与小麦植株的生育时期密切相关,此时叶片逐渐衰老、种子由乳熟趋于完熟即将收获。3个Wx基因对淀粉合成关键酶活性的影响也不相同,依次为Wx-D1>Wx-A1>Wx-B1,但是WxBD型缺失了Wx-D1和Wx-B1基因后其GBSS和AGPase活性反而异常高于除野生型外的其他基因型,这可能与其SSS和SBE活性相对于其他基因型较低有关,也就是淀粉合成酶和淀粉分支酶活性的降低导致与直链淀粉合成相关的GBSS活性的相对增加,但缺失Wx-D1和Wx-B1基因引起的这种变化与淀粉合成动态不尽一致,可能是相互作用导致的,但仍需深入研究酶活性与淀粉合成,尤其是直链淀粉合成之间直接相关性,以及酶活性大小与淀粉合成不完全一致的内在因素。WxABD型由于缺失了全部Wx基因,因此各种淀粉合成酶的活性在花后各时期不仅低于野生型、也低于缺失1个或2个Wx基因的其他型,尤其是由这3个Wx基因直接控制的GBSS活性,尽管随花后时间的延长也呈现先升高后降低、20 d左右达到峰值的趋势,但其升高或降低的幅度都很小,其活性相对较为稳定,这也反映了直链淀粉的合成情况,导致最终该类型小麦籽粒中直链淀粉的含量极低(<2%)或完全丧失。
目前鲜见Wx基因对淀粉合成关键酶的作用方式及作用机理的相关研究结果,而以小麦Wx近等基因系来研究小麦淀粉合成关键酶也鲜见报道,今后仍须进行深入研究,发掘其必然联系才能最终明确Wx基因在小麦淀粉合成过程中所起作用及其影响因素。
4 结论
4.1 小麦Wx基因缺失对淀粉合成关键酶活性影响较大,依次为Wx-D1>Wx-A1>Wx-B1。
4.2 淀粉合成关键酶活性在花后逐渐增加,以花后20 d最大,此后逐渐降低,到花后40 d达最低值。
4.3WxABD型缺失所有Wx基因,淀粉合成酶活性在花后各时期最低,其中GBSS活性远低于其余基因型且在花后各时期变化较小。
[1]彭佶松, 郑志仁, 刘涤,等. 淀粉的生物合成及其关键酶[J]. 植物生理学通讯, 1997, 33(4): 297-303
Peng J S, Zheng Z R, Liu D,et al. Starch biosynthesis and its key enzymes[J]. Plant Physiology Communications, 1997, 33(4): 297-303
[2]Okita T W. Is there an alternative pathway for starch synthesis?[J]. Plant Physiology, 1992, 100(2): 560-564
[3]Sturm A,Tang G Q. The sucrose-cleaving enzymes of plants are crucial for development,growth and carbon partitioning[J]. Trends in Plant Science, 1999(4): 401-407
[4]李永庚, 于振文, 姜东,等. 冬小麦旗叶蔗糖和籽粒淀粉合成动态及与其有关的酶活性的研究[J]. 作物学报, 2001, 27(5): 658-664
Li Y G, Yu Z W, Jiang D, et al. Studies on the dynamic changes of the synthesis of sucrose in the flag leaf and starch in the grain and related enzymes of high-yieding wheat[J]. ACTA Agrionomica Sinica, 2001, 27(5): 658-664
[5]Huber S C,Huber J I. Role and regulation of sucrose-phosphate synthase in higher plants[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1996(47): 431-444
[6]黄东亮, 李双喜, 廖青,等. 植物蔗糖磷酸合成酶研究进展[J]. 中国生物工程杂志, 2012, 32(6): 109-119
Huang D L, Li S X, Liao Q, et al. Advances on sucrose phosphate synthase in plants[J]. China Biotechnology, 2012, 32(6): 109-119
[7]Kang G Z, Wang Y H, Liu C, et a1. Difference in AGPase subunits could be associated with starch accumulation in grains between two wheat cultivars[J]. Plant Growth Regulation, 2010,61(1): 61-66
[8]Shimbata T, Ai Y F, Fujita M, et a1. Effects of homoeologous wheat starch synthase IIa genes on starch properties[J]. Journal of Agricultural and Food Chemistry, 2012, 60(48): 12004-12010
[9]Regina A, Kosar-Hashemi B, Li Z, et a1. Starch branching enzyme IIb in wheat is expressed at low levels in the endosperm compared to other cereals and encoded at a non-syntenic locus[J]. Planta, 2005, 222: 899-909
[10]Han Y, Sun F J, Rosales M S,et a1.Three orthologs in rice, Arabidopsis, and Populus encoding starch branching enzymes (SBEs) are different from other SBE gene families in plants[J]. Gene, 2007, 401: 123-130
[11]Peng M, Hucl P, Chibbar R N. Isolation, characterization and expression analysis of starch synthase I from wheat (TriticumaestivumL.)[J]. Plant Science, 2001, 161: 1055-1062
[12]Jeon J S, Ryoo N, Hahn T R, et a1. Starch biosynthesis in cereal endosperm[J]. Plant Physiology and Biochemistry, 2010, 48: 383-392
[13]Zeeman S C, Smith S M, Smith A M. The diurnal metabolism of leaf starch[J]. The Biochemical Journal, 2007, 401 (1): 13-28
[14]Utsumi Y, Utsumi C, Sawada T, et a1. Functional diversity of isoamylase oligomers: the ISA1 homo-oligomer is essential for amylopectin biosynthesis in rice endosperm[J]. Plant Physiology, 2011, 156(1): 61-77
[15]Thitisaksakul M,Jimnez R C, Arias M C, et a1. Effects of environmental factors on cereal starch biosynthesis and composition[J]. Journal of Cereal Science, 2012, 56(1):67-80
[16]李建敏, 王振林, 高荣岐,等. 强、弱筋小麦籽粒形成期蔗糖、淀粉合成相关酶活性及其与氮代谢的关系[J]. 作物学报, 2008, 34(6): 1019-1026
Li J M, Wang Z L, Gao R Q, et al. Activities of enzymes involved in sucrose and starch synthesis during grain filling and the relation to nitrogen metabolism in strong-and wak-gluten wheat cultivars[J]. ACTA Agrionomica Sinica, 2008, 34(6): 1019-1026
[17]曹颖妮. 小麦籽粒灌浆期淀粉合成酶学机制及基因表达模式的研究[D]. 杨凌: 西北农林科技大学, 2012
Cao Yingni. Study on the mechanism of starch synthesis and gene expression pattern during grain filling stage in wheat[D]. Yangling: North West Agriculture and Forestry University. 2012
[18]Anisworth C, Tarvis M, Clark J. Isolation and analysis of cDNA clone encoding the small subunit of ADP-glucose pyrophosphorylase from wheat[J]. Plant Molecular Biology, 1993, 23: 23-33
[19]Nakamura T, Yamamori M, Hirano H, et al. Identification of three waxy proteins in wheat (TriticumaestivumL.) [J]. Biochemical Genetics, 1993, 31(1-2): 75-86
[20]Yamamori M, Endo T R. Variation of starch granule proteins and chromosome mapping of their coding genes in common wheat[J]. Theoretical and Applied Genetics, 1996, 93(1-2): 275-281
[21]Sun C, Puthigae S, Staffan A, et al. The two genes encoding starch-branching enzymes Ⅱa and Ⅱb are differentially expressed in barley[J]. Plant Physiology, 1998, 118: 37-49
[22]谭彩霞, 郭静, 陈静,等. 弱筋小麦籽粒淀粉合成特性与酶基因表达的关系[J]. 扬州大学学报(农业与生命科学版), 2009, 30(1): 84-89
Tan C X, Guo J, Chen J, et al. Relationship between grain starch synthesis and starch synthase gene expression in weak gluten wheat[J]. Journal of Yangzhou University (Agricultural and Life Science Edition), 2009, 30(1): 84-89.
Effect of Wx Genes on Key Enzyme Activities of Starch Biosynthesis in Wheat
Qin Peng1Kong Zhiyou2Liu Yeju3Tang Yongsheng4Yang Junhua5
(College of Agronomy and Biotechnology, Yunnan Agricultural University1, Kunming 650201) (College of Resources and Environment,Baoshan University2, Baoshan 678000)(Postgraduate Administration Offices, Yunnan Agricultural University3, Kunming 650201)(Qujing Agricultural Science Academy4, Qujing 655000) (Dehong Agricultural Science Institution5, Mangshi 678400)
In order to investigate the effect of absence ofWx gene on key enzymes activity of starch biosynthesis in wheat, 8 near-isogenicWx wheat genes were used. The activities of ADP-glucose pyrophosphorylase polypeptide (AGPase), soluble starch synthase (SSS), granule-bound starch synthase (GBSS) and starch branch-ingenzyme (SBE) were determined during the grain filling period at 10, 20, 30 and 40 d in this study. The results showed that the AGPase, SSS, GBSS and SBE activity of wild type were the highest at all times after anthesis (excepted for GBSS activity at 40 d after anthesis which was at an intermediate level). However, related enzymes activity of 4 kinds of starch synthesis inWxABD was lower than all other genotypes in the whole grain filling stage, especially the GBSS activity of which, although increased first and then decreased, and reached to the peak trend at about 20 d after anthesis, but the increasing or decreasing of the amplitude was very small, and the activity was relatively stable. This study Showed that the greater impact of lack ofWx genes in wheat on the key enzyme activities of starch biosynthesis was observed, and the effect of threeWx genes wasWx-D1>Wx-B1>Wx-B1; the activities of key enzyme of starch biosynthesis were gradually increased at the end of anthesis, which reached to the maximum value 20 d after anthesis, and then decreased gradually, which reached the minimum value 40 d after anthesis; for allWxWxABD type-free genes, synthetase activities of starch biosynthesis ofWxABD were the lowest in all stages at the end of anthesis, of which GBSS activity was much lower than the otherWx-genotypes and had little changes in all stages after anthesis.
wheat, key enzyme activity of starch biosynthesis,Wx near-isogenic lines, filling stage
S512.01
A
1003-0174(2016)10-0006-05
国家自然科学基金(31000712)
2015-02-02
覃鹏,男,1977年出生,副教授,小麦遗传育种与品质改良

