番红花培养细胞对辐射小鼠外周血细胞的保护作用
周湘洁,张丽芬,钟 悦,陈 长,周晓春,吴 凡,杜学礼,窦跃龙,郭志刚
(1.中国人民解放军总装备部后勤部航天城门诊部,北京 100094;2.清华大学化工系,北京 100084)
番红花培养细胞对辐射小鼠外周血细胞的保护作用
周湘洁1,张丽芬1,钟 悦1,陈 长1,周晓春1,吴 凡2,杜学礼1,窦跃龙1,郭志刚2
(1.中国人民解放军总装备部后勤部航天城门诊部,北京 100094;2.清华大学化工系,北京 100084)
目的 探讨番红花培养细胞对被辐射小鼠外周血指标变化的影响。方法 取100只昆明种雄性小鼠,随机分为5组,除空白对照组外,其余各组给予2.5 Gy60Co 射线全身照射处理(包括模型组和番红花培养细胞低、中、高剂量组),定时检测小鼠外周血白细胞、红细胞、淋巴细胞、血红蛋白含量、血小板含量及红细胞相关指标,观察番红花培养细胞对被辐射小鼠的保护作用。结果 小鼠经 射线辐射后,外周血白细胞数、淋巴细胞数、红细胞数、血红蛋白及血小板含量均下降。给小鼠灌服番红花培养细胞可显著延缓其以上指标的下降速度。结论 番红花培养细胞对辐射小鼠外周血细胞有一定保护作用。
番红花培养细胞;辐射损伤;外周血细胞
一定剂量的电磁辐射照射下,可引起人体组织的代谢、机能及形态结构变化,其中以造血功能最敏感,表现为外周血象各类血细胞数量剧烈下降。在辐射防护剂的研究过程中,从天然药物中寻找高效低毒的辐射防护剂一直是我国学者努力的方向,并取得了一些研究成果[1-11]。番红花 Crocussativus L.为活血化瘀良药,由于其含较多番红花苷等类胡萝卜素物质,故有很好的抗氧化活性。番红花还具有广谱的抗癌活性,且对正常细胞毒性很小,但因为资源极其短缺并未得到广泛应用和深入研究[12]。清华大学化工系植物细胞研究室目前已经建立了番红花培养细胞的高效培养体系和大规模培养工艺,每1 L培养液4周内可获得干细胞50 g,10 L培养液就相当于667m2地番红花的产量,可为番红花的应用研究提供充足的番红花原料。本研究中通过2.5Gy60Coγ射线照射小鼠构建病理模型,然后按不同剂量给药,观察番红花培养细胞对正常小鼠受照后外周血细胞指标的影响,以探讨番红花培养细胞的抗辐射功效。
1 材料与方法
1.1 动物、试剂与仪器
选择SPF级昆明种小鼠,雄性,6~8周,体重17~21g,由军事医学科学院动物实验中心提供,动物许可证号为SCXK-(军)2007-004。番红花培养细胞由清华大学化工系生化所提供,采用冷冻干燥后呈粉末状,用蒸馏水按0.05,0.025,0.005 g/m L制成低、中、高3种质量浓度的混悬液。主要仪器为60Coγ放射源(防化计量站),POCH-80I型五分类血细胞计数仪。
1.2 方法
选取雄性、SPF级昆明种小鼠100只,随机分成5组,各20只,即空白对照组(A组)、照射模型组(B组)、照射+高剂量药物组(1 g/kg,C组)、照射+中剂量药物组(0.5 g/kg,D组)、照射+低剂量药物组(0.1 g/kg,E组)。动物分组后于试验第2天,剪小鼠尾0.1 cm取血1次,血样送检。3个给药组按剂量灌胃给药,A组和B组灌胃等量生理盐水14 d后,剪小鼠尾0.1 cm取血1次,血样送检。然后送往防化计量站,A组小鼠置于放射源房间附近,其余4组小鼠1次性照射60Coγ射线2.5Gy,具体照射处理方法为60Coγ辐射源,受照剂量为2.5 Cy,剂量率为0.083 Gy/min,距离为3 600 cm,分组一次性全身照射受试动物30min。照射后继续灌胃给药14 d,照射后第3,6,10,14天各剪小鼠尾0.1 cm取血1次,血样送检。
1.3 检测指标
检测并记录各组小鼠的血白细胞(WBC)、淋巴细胞(LYM)、红细胞(RBC)、血红蛋白(HGB)及血小板(PLT),红细胞压积(HCT)、平均红细胞血红蛋白含量(MCH)、红细胞平均体积(MCV)、平均血红蛋白浓度(MCHC)、红细胞体积分布宽度(RDW-CV)结果。
1.4 统计学处理
数据分析采用独立样本LSD测验方法,分别从α=0.001,0.01,0.05 3个水平检验2个样本是否有显著性差异,数据处理采用美国IBM SPSSStatistics 19.0软件。P<0.01,P<0.05分别表示在α=0.01,0.05水平上,2个样本有显著性差异。
2 结果
2.1 外周血W BC计数
结果见表1。可见,各组小鼠在照射前饲喂期间(前14 d),WBC计数呈上升趋势,各组间无显著性差异。照射后第3天各照射组WBC计数均明显下降,与空白对照组相比均有显著性差异(P<0.01),番红花培养细胞给药组的降低幅度均小于照射模型组,但无显著性差异。从照射后第6天开始,各照射组WBC计数均呈上升趋势:番红花培养细胞给药组在照射后第6,10,14天均显著高于模型组(P<0.05)。其中中、高剂量给药组在第6,10天上升幅度高于低剂量给药组,第14天3个给药组间无显著性差异。试验结果表明,被γ射线照射后小鼠的外周血WBC计数迅速下降,番红花培养细胞能显著促进外周血WBC的生成。
表1 各组小鼠外周血WBC计数比较(s,×109/L,n=20)
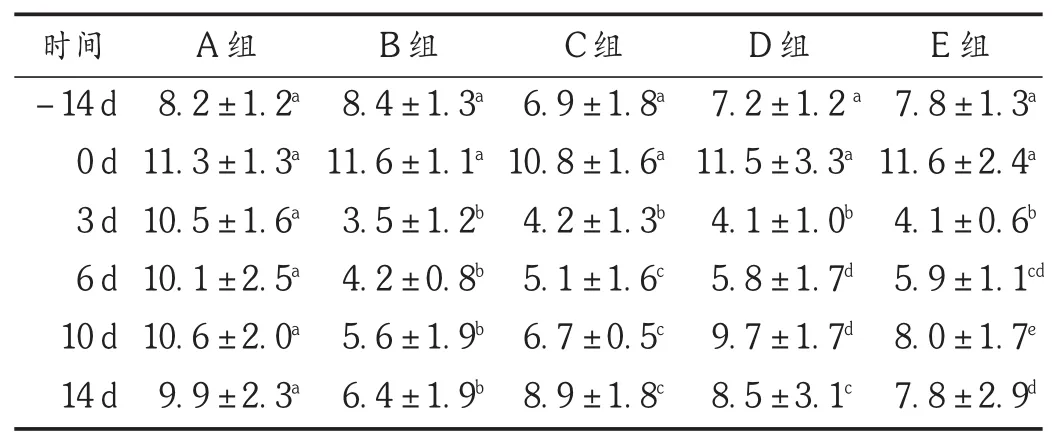
表1 各组小鼠外周血WBC计数比较(s,×109/L,n=20)
注:数据中字母相同的表示差异无统计学意义,字母不同的表示差异有统计学意义。下表同。
时间-14 d 0 d 3 d 6 d 10 d 14 d A组8.2±1.2a11.3±1.3a10.5±1.6a10.1±2.5a10.6±2.0a9.9±2.3aB组8.4±1.3a11.6±1.1a3.5±1.2b4.2±0.8b5.6±1.9b6.4±1.9bC组6.9±1.8a10.8±1.6a4.2±1.3b5.1±1.6c6.7±0.5c8.9±1.8cD组7.2±1.2a11.5±3.3a4.1±1.0b5.8±1.7d9.7±1.7d8.5±3.1cE组7.8±1.3a11.6±2.4a4.1±0.6b5.9±1.1cd8.0±1.7e7.8±2.9d
2.2 外周血LYM计数
结果见表2。可见,各组小鼠在照射前饲喂期间,LYM计数均呈上升趋势,各组间无显著性差异。照射后第3天,各照射组淋巴细胞计数均明显下降,与空白对照组相比均有显著性差异(P<0.01)。照射后第6天开始,各照射组LYM计数均呈上升趋势:番红花培养细胞中、高剂量给药组在照射后第6,10,14天均显著高于照射模型组(P<0.05),低剂量给药组在照射后第6,14天均显著高于照射模型组(P<0.05),中、高剂量给药组在第6,10天上升幅度高于低剂量给药组,第14天3个给药组间无显著性差异。试验结果表明,被γ射线照射后小鼠的外周血LYM计数迅速下降,番红花培养细胞能显著促进外周血LYM的生成。
表2 各组小鼠外周血LYM计数比较(s,×109/L,n=20)
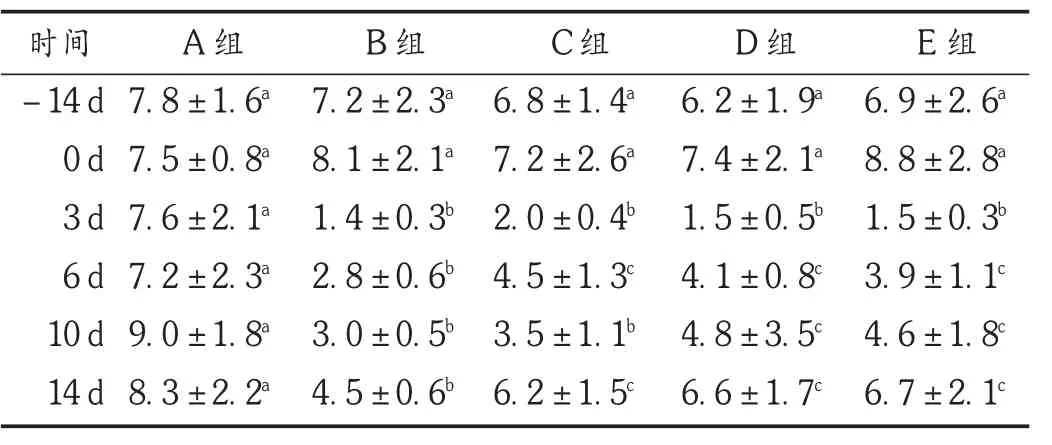
表2 各组小鼠外周血LYM计数比较(s,×109/L,n=20)
时间-14 d 0 d 3 d 6 d 10 d 14 d A组7.8±1.6a7.5±0.8a7.6±2.1a7.2±2.3a9.0±1.8a8.3±2.2aB组7.2±2.3a8.1±2.1a1.4±0.3b2.8±0.6b3.0±0.5b4.5±0.6bC组6.8±1.4a7.2±2.6a2.0±0.4b4.5±1.3c3.5±1.1b6.2±1.5cD组6.2±1.9a7.4±2.1a1.5±0.5b4.1±0.8c4.8±3.5c6.6±1.7cE组6.9±2.6a8.8±2.8a1.5±0.3b3.9±1.1c4.6±1.8c6.7±2.1c
2.3 外周血RBC计数
结果见表3。可见,各组小鼠在照射前饲喂期间,RBC计数呈上升趋势,3个番红花给药组上升幅度较大,与空白对照组相比有显著性差异(P<0.05)。照射后,模型组从第6天RBC计数开始下降,14天降到最低;番红花培养细胞给药组从照射后RBC计数开始下降,第6天开始回升,至照射后第14天各给药组与照射组相比有显著性差异(P<0.05),高剂量给药组降幅最小,回升最快,照射后第14天RBC计数恢复至照前水平。试验结果表明,被射线照射后小鼠的外周血RBC数明显下降,番红花培养细胞能显著促进外周血RBC的生成。
表3 各组小鼠外周血RBC计数比较(s,×1012/L,n=20)
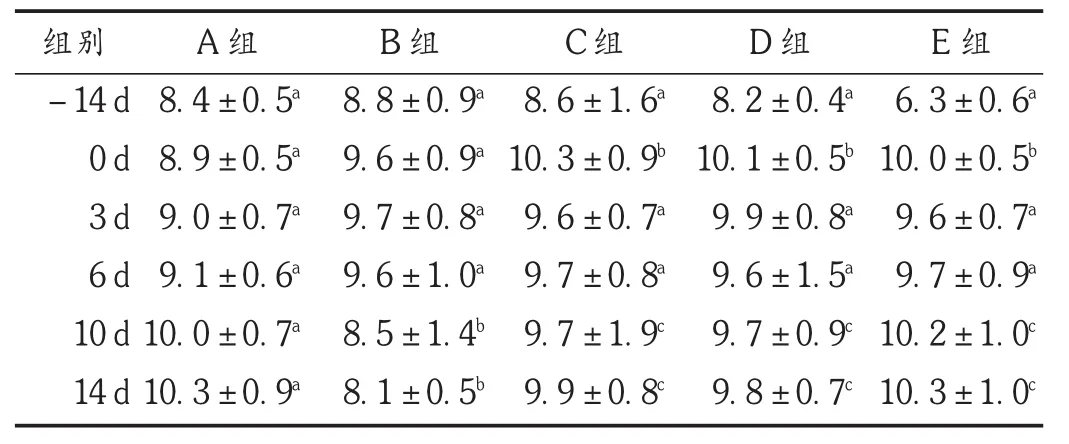
表3 各组小鼠外周血RBC计数比较(s,×1012/L,n=20)
组别-14 d 0 d 3 d 6 d 10 d 14 d A组8.4±0.5a8.9±0.5a9.0±0.7a9.1±0.6a10.0±0.7a10.3±0.9aB组8.8±0.9a9.6±0.9a9.7±0.8a9.6±1.0a8.5±1.4b8.1±0.5bC组8.6±1.6a10.3±0.9b9.6±0.7a9.7±0.8a9.7±1.9c9.9±0.8cD组8.2±0.4a10.1±0.5b9.9±0.8a9.6±1.5a9.7±0.9c9.8±0.7cE组6.3±0.6a10.0±0.5b9.6±0.7a9.7±0.9a10.2±1.0c10.3±1.0c
2.4 外周血HGB含量
结果见表4。可见,各组小鼠在照射前饲喂期间,HGB含量呈上升趋势,3个番红花给药组上升幅度较大,与空白对照组相比有显著性差异(P<0.05)。照射后,模型组从第6天HGB含量开始下降,第14天降至最低;番红花培养细胞给药组HGB含量从照射后开始下降,高剂量给药组从第3天开始回升,中、低剂量给药组从第6天开始回升,至照射后第14天各给药组与照射组相比有显著性差异(P<0.05)。试验结果表明,被射线照射后小鼠的外周血HGB含量明显下降,番红花培养细胞能显著提高外周血HGB的含量。
2.5 外周血PLT计数
结果见表5。可见,各组小鼠在照射前饲喂期间,PLT计数呈上升趋势,各组间无显著性差异。照射后第3天各照射组PLT计数无明显变化,与空白对照组相比无显著性差异。照射后第3天开始,各照射组小鼠的PLT计数呈下降趋势,至照射后10 d降至最低,随后上升;番红花培养细胞高剂量给药组下降幅度最小,上升较快,在照射后第6,10,14天均显著高于照射模型组(P<0.05)。其次是番红花培养细胞中剂量给药组,在照射后第6,10,14天也显著高于照射模型组(P<0.05);低剂量给药组在照射后第6,10,14天也显著高于照射模型组(P<0.05),上升幅度小于高、中剂量给药组;所有照射组外周血PLT计数在照射后第14天均未恢复到正常水平,与空白对照组相比有显著性差异(P<0.05)。试验结果表明,番红花培养细胞给药能减缓被辐射小鼠外周血PLT计数的减少,同时在一定程度上促进PLT再生,而且其促进效果随着给药量的增加而提高。
表4 各组小鼠外周血HGB含量比较(s,g/L,n=20)

表4 各组小鼠外周血HGB含量比较(s,g/L,n=20)
组别-14 d 0 d 3 d 6 d 10 d 14 d A组132.3±8.6a138.6±18.1a140.2±11.9a148.3±23.1a157.9±6.6a159.8±8.9aB组132.3±13.5a142.4±15.0a141.2±13.9a140.1±11.5a133.6±7.2b131.7±5.1bC组132.6±8.7a158.5±12.5b152.3±9.7b145.0±11.2a146.7±11.4c147.2±7.0cD组135.1±8.5a152.9±10.4b151.5±1.9b144.2±19.7a146.7±9.1c147.9±10.3cE组132.4±5.6a154.1±6.2b149.9±9.3b152.5±13.0b154.6±12.3c151.6±13.1c
表5 各组小鼠外周血PLT生成比较(s,×109/L,n=20)
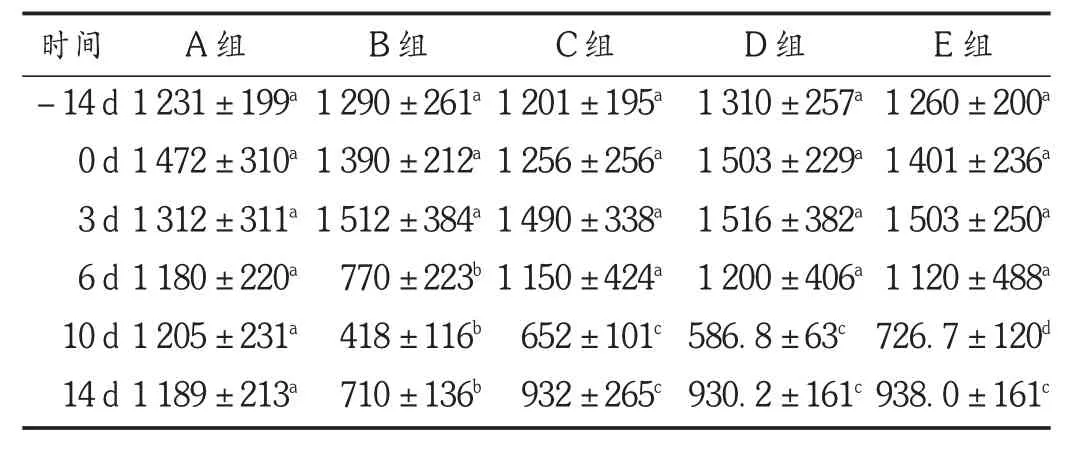
表5 各组小鼠外周血PLT生成比较(s,×109/L,n=20)
时间-14 d 0 d 3 d 6 d 10 d 14 d A组1 231±199a1 472±310a1 312±311a1 180±220a1 205±231a1 189±213aB组1 290±261a1 390±212a1 512±384a770±223b418±116b710±136bC组1 201±195a1 256±256a1 490±338a1 150±424a652±101c932±265cD组1 310±257a1 503±229a1 516±382a1 200±406a586.8±63c930.2±161cE组1 260±200a1 401±236a1 503±250a1 120±488a726.7±120d938.0±161c
2.6 外周血HCT
结果见表6。可见,各组小鼠在照射前饲喂期间,HCT呈上升趋势,3个番红花给药组上升幅度较大,与空白组相比有显著性差异(P<0.05)。照射后,照射模型组从第6天HCT开始下降,第14天降至最低;番红花培养细胞给药组从照射后HCT开始下降,第6天开始回升,至照射后第14天各给药组与照射组相比有显著性差异(P<0.05),高剂量给药组降幅最小,回升最快。试验结果表明,被射线照射后小鼠的外周血红细胞压积明显下降,番红花培养细胞能显著提高外周血HCT。
2.7 外周血MCH
结果见表7。可见,在射线照射前14 d,所有处理组小鼠的MCH水平呈轻微下降趋势。被照射后,模型组小鼠的MCH几乎无变化,一直保持在一定水平,而空白对照组一直呈轻微上升趋势。番红花培养细胞给药组的小鼠被照射后虽均有上升趋势,与模型组相比一直保持在较高水平,但照射后14 d与模型组相比无显著性差异(P<0.05)。不同给药量几乎不影响被辐射小鼠外周血MCH的含量,表明番红花培养细胞具有一定维持或提高MCH的作用。
表6 各组小鼠外周血HCT比较(s,%,n=20)

表6 各组小鼠外周血HCT比较(s,%,n=20)
时间-14 d 0 d 3 d 6 d 10 d 14 d A组0.48±0.03a0.49±0.06a0.50±0.03a0.50±0.08a0.55±0.02a0.55±0.03aB组0.51±0.04a0.50±0.05a0.52±0.04a0.49±0.05a0.46±0.13b0.45±0.01bC组0.48±0.07a0.56±0.04b0.53±0.03a0.52±0.03b0.51±0.08c0.53±0.02cD组0.49±0.02a0.55±0.03b0.53±0.04a0.54±0.07b0.49±0.03c0.53±0.04cE组0.48±0.02a0.54±0.02b0.53±0.03a0.53±0.02b0.53±0.01c0.52±0.04c
表7 各组小鼠外周血MCH比较(s,pg,n=20)
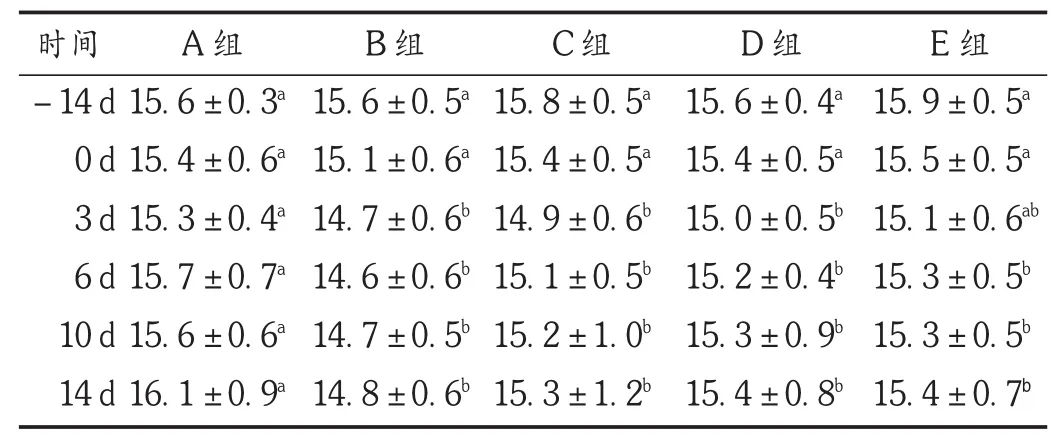
表7 各组小鼠外周血MCH比较(s,pg,n=20)
时间-14 d 0 d 3 d 6 d 10 d 14 d A组15.6±0.3a15.4±0.6a15.3±0.4a15.7±0.7a15.6±0.6a16.1±0.9aB组15.6±0.5a15.1±0.6a14.7±0.6b14.6±0.6b14.7±0.5b14.8±0.6bC组15.8±0.5a15.4±0.5a14.9±0.6b15.1±0.5b15.2±1.0b15.3±1.2bD组15.6±0.4a15.4±0.5a15.0±0.5b15.2±0.4b15.3±0.9b15.4±0.8bE组15.9±0.5a15.5±0.5a15.1±0.6ab15.3±0.5b15.3±0.5b15.4±0.7b
2.8 外周血MCV
结果见表8。可见,在被照射处理前14 d,所有处理组小鼠的MCV均呈下降趋势。与模型组相比,番红花培养细胞给药组小鼠被照射后的MCV下降幅度较小,在照后6~10 d下降后回升。3个给药组间无显著性差异,基本处于同等水平。在试验期间,3个给药组的MCV水平虽一直高于模型组,但无显著性差异,表明番红花培养细胞具有一定维持或提高MCV的作用。
表8 各组小鼠外周血MCV比较(s,fL,n=20)

表8 各组小鼠外周血MCV比较(s,fL,n=20)
时间-14 d 0 d 3 d 6 d 10 d 14 d A组56.4±0.8a54.5±1.8a54.6±1.1a58.9±7.2a54.8±1.6a54.2±1.5aB组54.0±1.0a53.4±1.8a52.8±1.9a52.8±1.8a53.0±1.6a52.8±1.5aC组57.2±2.8a53.5±1.6a53.5±1.4a53.6±1.1a53.7±3.6a55.4±5.1aD组55.6±1.2a54.2±1.4a53.2±1.2a53.8±1.2a54.5±3.6a54.6±2.7aE组56.5±1.6a54.4±1.7a53.6±1.6a53.6±1.5a53.7±1.7a53.5±1.8a
2.9 外周血MCHC
结果见表9。可见,在试验开始前14 d所有试验组小鼠的MCHC含量均有所上升。照射开始后,模型组小鼠的MCHC含量停止上升,基本上稳定在284 g/L的水平,照射10 d后开始上升,且基本达到了空白对照组的水平。番红花培养细胞给药组被照射后其MCHC含量基本上保持在高于模型组的水平,其变化趋势与空白对照组基本相同,呈缓慢上升趋势。但给药组间无显著性差异,表明番红花培养细胞能维持或提高外周血MCHC的含量。
表9 各组小鼠外周血MCHC比较(s,g/L,n=20)

表9 各组小鼠外周血MCHC比较(s,g/L,n=20)
时间-14 d 0 d 3 d 6 d 10 d 14 d A组277.9±5.3a283.5±5.2a284.1±4.9a285.6±9.1a286.0±3.5a286.6±5.6aB组277.8±5.5a283.8±5.1a283.2±5.3a283.5±5.6a283.8±5.5a283.3±6.5aC组276.6±7.5a286.3±5.4a285.4±5.3a286.8±5.7a289.8±7.5a289.5±6.4aD组279.6±5.6a284.5±5.2a285.7±5.1a286.3±6.5a288.5±4.0a290.2±4.6aE组277.6±5.8a286.4±4.9a288.0±5.2a288.5±5.6a287.6±6.5a292.1±3.7a
2.10 外周血RDW-CV
结果见表10。可见,试验开始前,所有处理组的小鼠的RDW-CV均处于缓慢下降趋势。特别是空白对照组小鼠的RDW-CV一直呈下降趋势。被射线照射后,模型组和给药组的RDW-CV值均快速下降,在第3天开始上升,在第14天达到最高,而给药组小鼠被照射后其RDW-CV下降程度均大于模型组。其中,中、高剂量给药组的下降程度更大,与模型组相比存在显著性差异(P<0.05),表明番红花培养细胞具有抑制RDW-CV升高的作用。
表10 各组小鼠外周血RDW-CV比较(s,%,n=20)
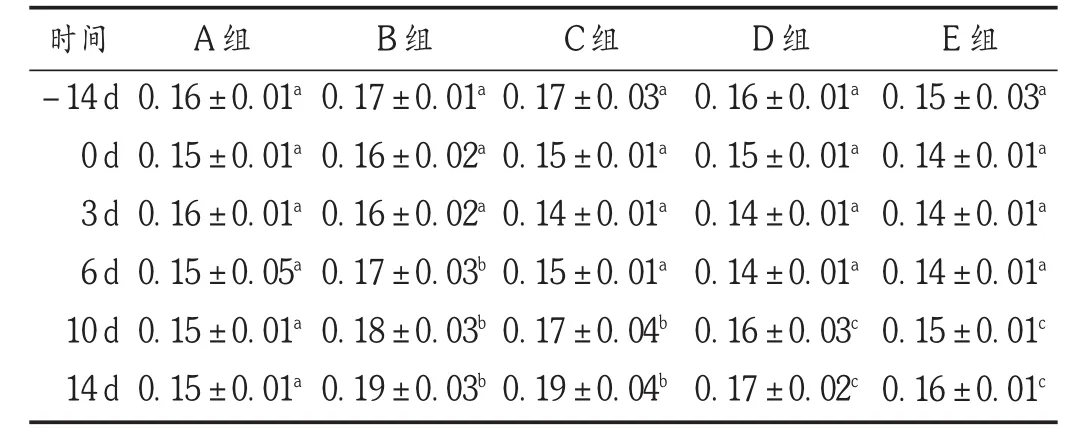
表10 各组小鼠外周血RDW-CV比较(s,%,n=20)
时间-14 d 0 d 3 d 6 d 10 d 14 d A组0.16±0.01a0.15±0.01a0.16±0.01a0.15±0.05a0.15±0.01a0.15±0.01aB组0.17±0.01a0.16±0.02a0.16±0.02a0.17±0.03b0.18±0.03b0.19±0.03bC组0.17±0.03a0.15±0.01a0.14±0.01a0.15±0.01a0.17±0.04b0.19±0.04bD组0.16±0.01a0.15±0.01a0.14±0.01a0.14±0.01a0.16±0.03c0.17±0.02cE组0.15±0.03a0.14±0.01a0.14±0.01a0.14±0.01a0.15±0.01c0.16±0.01c
3 讨论
照射射线后,小鼠机体各个系统、器官、组织都有可能受到损伤,由于造血系统最敏感,故造血组织损伤是机体最早出现的基本损伤之一,也是辐射损伤防治的核心环节。骨髓是机体主要的造血组织,辐射后,骨髓造血功能严重受损,造血细胞有丝分裂停止,细胞更新中断,反映在外周血象中各类血细胞数量剧烈下降,故检测外周血中血细胞数量可了解骨髓的造血功能。不同种类的血细胞种类寿命不同,受到照射影响的程度也不同。
本研究结果显示,小鼠经2.5 Gy60Coγ射线全身照射后,外周血中寿命短暂的WBC变化最明显,照射组小鼠外周血WBC计数均在照后第3天降到最低,然后回升;PLT计数在第3天开始下降,在第10天降到最低水平,之后回升。成熟RBC和HGB的寿命较长,在辐射后第6天开始下降,第14天降到最低;与RBC相关的指标HCT,MCV,MCHC,MCH及RDH-CV的变化与RBC和HGB相关,呈现出RBC计数和HGB含量减少的趋势,表明射线照射使小鼠的骨髓功能遭受严重受损。而连续口服番红花培养细胞的小鼠,经2.5 Gy60Coγ射线全身照射后,其外周血WBC、LYM、RBC、HGB、PLT的减少速度得到延缓,降幅较模型组小,恢复速度更快,而且中、高剂量给药组的效果更显著,表明番红花培养细胞对辐射小鼠的外周血WBC、LYM、RBC、HGB、PLT的提高有显著的促进作用。番红花培养细胞对于被辐射小鼠外周血HCT,MCH,MCV和MCHC等指标还有一定的促进作用。番红花培养细胞对RDW-CV的影响,给药组均低于模型组,其中高剂量给药组显著低于模型组,表明番红花培养细胞具有抑制RDW-CV的作用。
目前,关于番红花培养细胞能提高被辐射小鼠外周血WBC,LYM,PLT,MCH,MCV和MCHC等水平的机理尚不十分清楚,但番红花提取物特别是番红花素能有效抑制氧自由基及黄嘌呤氧化酶的活性,表现出抗氧化生物活性[4]。由于被射线照射的小鼠所受到的损伤是通过细胞膜、核膜及DNA等重要细胞器发生强烈氧化反应而实现的,因此小鼠口服番红花提取物后抑制了各级生物膜和DNA的氧化过程,从而阻止或修复了被照射小鼠外周血各种指标所受到的破坏作用。
[1]朱壬葆,刘 勇,罗祖玉,等.辐射生物学[M].北京:北京科学出版社,1987:151-160.
[2]赵 红,黄黎明,抗辐射中药的研究现状及进展[J].实用药物与临床,2008,11(4):238-240.
[3]毕良文,段 伟,王晓莉,等.中药辐射防护剂的研究进展[J].中国辐射卫生,2006,15(1):118-120.
[4]王 舟,曾令福,肖元梅,等.绿茶抗辐射损伤作用研究[J].四川大学学报:医学版,2003,34(2):303-305.
[5]赵雪英,顾振论,苏燎原.槲皮素抗辐射损伤作用的初步研究[J].苏州医学院学报,1998,18(12):1 233-1 234.
[6]刘 静,刘 梅,李燕思,等.原花青素缓释片对辐射损伤小鼠的保护作用研究[J].解放军药学学报,2010,26(5):406-408.
[7]徐春红,李 鹏,谢 梅,等.五麦党黄口服液对辐射损伤小鼠防护作用的初步研究[J].中国药业,2013,22(15):17-18.
[8]杨 洁,刘 萍.升白口服液对急性辐射损伤小鼠的防治研究[J].中国药业,2006,15(16):7-8.
[9]楼英彪,龚彬荣.益血生胶囊对小鼠辐射损伤的保护作用[J].中国药业,2004,13(7):27-28.
[10]徐春红,李 鹏,卢海波,等.五麦党黄口服液对辐射损伤小鼠脏器中自由基清除能力的影响[J].中国药业,2014,23(7):20-21.
[11]陈 斌,周熙成.天然抗氧化剂对空间辐射的防护作用[J].航天医学与医学工程,2003,16(增刊):514-518.
[12]邓 颖,郭志刚,曾兆麟,等.番红花的药理研究进展[J].中国中药杂志,2002,27(8):565-568.
Protective Effect of Crocus Sativus L.Cultured Cell on the Peripheral Blood Cell of Irradiated M ice
Zhou Xiangjie1,Zhang Lifen1,Zhong Yue1,Chen Zhang1,Zhou Xiaochun1,Wu Fan2,Du Xueli1,Dou Yuelong1,Guo Zhigang2
(1.Clinical Center of Beijing Space City,Logisitics Department of General Armament Headquaters of PLA,Beijing,China 100094; 2.Department of Chemical Engineering,Tsinghua University,Beijing,China 100084)
Ob jective To discuss the effect of Crocus sativus L.cultured cell on peripheral blood index of irradiated mice.M ethods 100 Kunming male mice were random ly divided into 5 groups,in addition to the blank control group,four groups were given 2.5 Gy60Coγ ray irradiation,including model control group and three treatment groups which delivered high,medium and low dose Crocus sativus L.cultured cell after irradiation.The number of white blood cells(WBC),red blood cells(RBC),lymphocyte(LYM),platelets(PLT),the content of hemoglobin(HGB)and red blood cells related indicators in peripheral blood were examined regularly to investigate the Crocus sativus L.cultured cell protective effect on irradiated mice.Results The number of WBC,LYM,RBC,HGB,PLT and the content of HMG in mice peripheral blood were decreased after 2.5 Gy60Coγray radiation.By oral delivery of Crocus sativus L.cultured cell,descent rate of WBC,RBC,HGB,LYM and PLT in mice peripheral blood were significantly delayed.Conclusion Crocus sativus L.cultured cell has protective effect on peripheral blood cells of irradiated mice.
Crocus sativus L.cultured cell;radiation damage;peripheral blood cells
R285.5;R282.71
A
1006-4931(2016)04-0042-05
周湘洁(1974-),女,湖南湘潭人,汉族,硕士研究生,主管药师,研究方向为中药药理学,(电话)010-66361259(电子信箱)zhouxj0924@126.com。
2015-07-23;
2015-10-19)

