IL-1β、IL-6和TNF-α在肩袖损伤大鼠肩峰下滑囊中的表达及作用
郑荣宗 楼超 童勇骏 黄淑明 吴泉州
IL-1β、IL-6和TNF-α在肩袖损伤大鼠肩峰下滑囊中的表达及作用
郑荣宗 楼超 童勇骏 黄淑明 吴泉州
目的 观察肩袖损伤大鼠肩峰下滑囊(SAB)中IL-1β、IL-6和TNF-α的表达,并探讨其在肩袖损伤后疼痛发生中的作用。方法 雌性SD大鼠在减少干扰SAB的情况下,切断同侧前肢冈上肌腱,建立大鼠肩袖损伤的模型作为实验组,对侧行假手术作为对照组。根据大鼠肩袖损伤时间不同,分别于造模后2、4、8周对大鼠SAB进行取样,对标本进行切片,HE染色观察SAB组织病理变化,采用免疫组化及实时RT-PCR测定SAB中IL-1β、IL-6和TNF-α的表达水平。结果 与对照组相比,实验组SAB中可见成纤维细胞数量和血管分布的增加。免疫组化及实时RT-PCR显示实验组的IL-1β、IL-6和TNF-α在SAB中的表达水平在各时间段均明显升高(P<0.05)。结论 肩袖损伤后大鼠SAB中IL-1β、IL-6和TNF-α水平的升高可能是肩袖损伤后肩关节疼痛和功能障碍的病理机制之一。
细胞因子 肩袖 肩峰下滑囊 大鼠模型
肩袖损伤是引起肩周疼痛、肩关节功能障碍最常见的疾病之一,严重影响患者的生活质量[1-2]。目前对肩袖损伤引起肩关节疼痛的病因还没有很好的认识。肩峰下滑囊(subacromial bursa,SAB)被认为与肩袖损伤引起的肩关节疼痛密切相关[3]。有研究发现,肩袖损伤引起肩关节疼痛的发生、发展与SAB内炎症因子IL-1α、IL-1β和TNF-α等的高表达有关[4-6]。但Lho等[7]在冻结肩患者的SAB中仅发现IL-1α和TNF-α高表达。Szomor等[8]研究了17例肩袖损伤患者的SAB标本,均有表达IL-6,仅1例表达TNF-α mRNA,其余均无IL-1β mRNA的表达。而Ko等[9]对14例僵硬肩的肩袖损伤患者进行研究,发现SAB中IL-1β高表达。Yoshida等[10]发现,有粘连的冻结肩或肩袖损伤患者中,SAB中IL-8基因的表达增加,均未检测到IL-1α、IL-1β和TNF-α等的表达。可见,临床中受多因素影响,对于SAB内IL-1、IL-6和TNF-α等炎症因子的表达与否,是否与肩关节疼痛的发生有关等问题还存在争议,有待进一步深入研究。本研究旨在建立大鼠肩袖损伤模型,进而探讨IL-1β、IL-6和TNF-α在肩袖损伤大鼠SAB中的表达及作用。
1 材料和方法
1.1 材料 骨骼成熟的清洁级SD大鼠12只,雌性,鼠龄3个月,平均体重270(250~300)g,术前观察1周,确认体健无疾病。大鼠由温州医科大学实验动物中心提供。本实验通过温州医科大学动物实验伦理委员会伦理审查。
1.2 实验方法 大鼠肩袖损伤模型制备:12只SD大鼠称重后,按40mg/kg体重量腹腔注射戊巴比妥钠进行麻醉[11],将其以俯卧位固定于鼠类固定器上。术区备皮、清洁,常规消毒,铺无菌单。肩袖损伤组(实验组)建立肩袖损伤模型,手术入路采用大鼠右侧前肢肩胛冈肩峰端1cm皮肤切口,沿肩胛冈上缘向肩峰方向寻找并挑起冈上肌腱,在不影响SAB的情况下锐性切断冈上肌肌腱,造成全层肩袖损伤模型。检查无活动性出血后采用5-0可吸收缝线(强生公司)关闭切口。假手术组(对照组)作左侧前肢肩关节后外侧1cm切口,暴露冈上肌腱后同样方式缝合关闭切口。术后分笼饲养,无活动限制。
1.3 标本采集及处理 分别于术后2、4、8周各取4只大鼠注射过量的戊巴比妥处死,两侧(肩袖损伤模型建立侧及假手术侧)SAB进行观察。原切口进入,仔细分离软组织,寻找SAB并予切除作为标本。每1例标本分为2部分,一部分置于深低温冰箱中保存,用于后续细胞总RNA和蛋白的提取,进行RT-PCR检测。另一部分立即置于10%多聚甲醛溶液中,固定48h,石蜡包埋。沿标本纵轴切片,片厚度4μm。石蜡切片行HE染色和免疫组化。同时切取冈上肌腱断端处部分肌腱作HE染色观察造模情况。
1.4 HE染色 用HE染色观察SAB组织病理变化。切片置二甲苯脱蜡,梯度乙醇水化,苏木素染液染色5min,自来水冲洗,分化液分化30s,自来水浸泡15min,伊红染液染2min,流水冲洗,梯度乙醇脱水,二甲苯透明,中性树脂封片后显微镜下观察。
1.5 免疫组化 用免疫组化分别观察IL-1β、IL-6和TNF-α在SAB中的表达。石蜡切片(厚4μm)逐级二甲苯脱蜡,梯度乙醇水化,PBS缓冲液洗,分别经PBS、双氧水室温孵育10min阻断内源性过氧化物酶,用胰蛋白酶37℃孵育30min修复抗原,正常山羊血清室温下封闭30min,滴加一抗兔抗人单克隆抗体(美国Thermo公司),4℃孵育过夜。第2天复温后经山羊抗兔IgG抗体-HRP多聚体(北京中杉金桥生物技术有限公司)37℃孵育30min,然后用链霉亲和素-生物素复合物(strept avidin-biotin complex,SABC)37℃孵育30min,二氨基联苯胺(DAB)显色,苏木素复染核,梯度乙醇脱水,二甲苯透明后,中性树脂封片,显微镜下观察。
1.6 RT-PCR法检测IL-1β、IL-6和TNF-α表达
1.6.1 RNA提取 将标本从液氮中取出,立刻称重。将组织置于预冷的研钵中,边加液氮边研磨,直至成为碎末状。每100mg组织加入TRIZOL试剂(美国Sigma公司)200μl至样品中,裂解后15~30℃孵育5min。将裂解产物移至RNase.free的1.5ml离心管中,每管1ml。加入预冷的氯仿,200μl/管,涡旋混匀,冰浴10min,4℃,12 000r/min离心15min,小心吸取上层水相至新管。加入1.5倍体积的无水乙醇,混匀,-80℃沉淀1h。4℃,12 000 000r/min离心30min,弃上清液。加入体积分数为80%的乙醇1ml/管,4℃,12 000 000r/min离心10min,弃上清。吸净残液,开盖,晾干5min,加入焦碳酸二乙酯(DEPC)水20μl/管,溶解沉淀。使用NanoDrop@ND-1000紫外吸收法测定RNA浓度和纯度。
1.6.2 cDNA合成 配制退火混合物:RNA3μg,0.5g/L Oligo(dT)(美国Thermo公司)1μl,加无RNA酶的H2O至总体积10μl。在70℃水浴(DK-8D型电热恒温水槽,上海森信实验仪器有限公司)3min,降到37℃放置10min。
1.6.3 SYBR Green荧光定量RT-PCR 按照SYBR Green荧光定量RT-PCR试剂盒说明,RT-PCR反应体系为:cDNA模板2μl,ddH2O 8.5μl,SYBR Green PCR Mix 12.5μl,引物2μl,总体系为25μl。IL-1β、IL-6和TNF-α引物的正反义序列见表1。反应条件为:95℃60s,95℃15s,60℃15s,72℃45s,共36个循环。同时作65~95℃溶解曲线(图1,见插页)。所有样本均作3次检测,取平均值进行分析。RT-PCR数据的收集主要由7000 Sequence De-tection System自带软件完成,通过软件计算所有样品的Ct值,用相对定量的方法分析数据,计算各组目的基因表达的差异。
1.7 统计学处理 采用SPSS 16.0统计软件;计量资料以表示,RT-PCR检测IL-1β、IL-6和TNF-α的 mRNA表达量采用单因素方差分析,组间比较采用SNK法。
2 结果
2.1 实验动物数量分析 12只SD大鼠在术后健康状况良好,均于造模当天开始自主进食,术后进食情况良好。观察期间无伤口感染及非预计性死亡发生。在建模操作过程中,手术入路的相关解剖位置比较恒定,模型建立的操作过程可重复性高。所有大鼠均进入结果分析。

表1 RT-PCR使用引物序列
2.2 局部组织学肉眼观察 术后2、4、8周,各实验组大鼠肩袖损伤处均有不同程度的瘢痕组织填补修复,周围粘连均可见。可见冈上肌断端肌腱瘢痕组织明显增生,且随时间增加瘢痕组织范围逐渐增大。对照组无瘢痕组织填补修复,无周围粘连。
2.3 HE染色光学显微镜观察 肩袖损伤侧在第4周和第8周时冈上肌腱中可见成纤维细胞积聚,胶原排列相对紊乱。而对侧假手术只见极少量的成纤维细胞出现,胶原呈波浪状,单轴性(图2,见插页)。
在实验组所有肩袖损伤大鼠的SAB组织,均可见成纤维细胞数量和血管分布的增加。而对侧假手术SAB中成纤维细胞数量和血管分布均很少(图3,见插页)。
2.4 免疫组化普通光学显微镜观察结果 实验组肩袖损伤大鼠SAB组织细胞均能检测到IL-1β、IL-6和TNF-α阳性表达,且表达分布高于对照组(图4-6,见插页)。
2.5 实时荧光定量PCR检测 实验组SAB中IL-1β、IL-6和TNF-α的mRNA在术后2、4、8周时的表达量明显较对照组升高,差异均有统计学意义(均P<0.05),见图7-9。

图7 两组SAB中IL-1βmRNA在术后2、4、8周的表达量

图8 两组SAB中IL-6 mRNA在术后2、4、8周的表达量
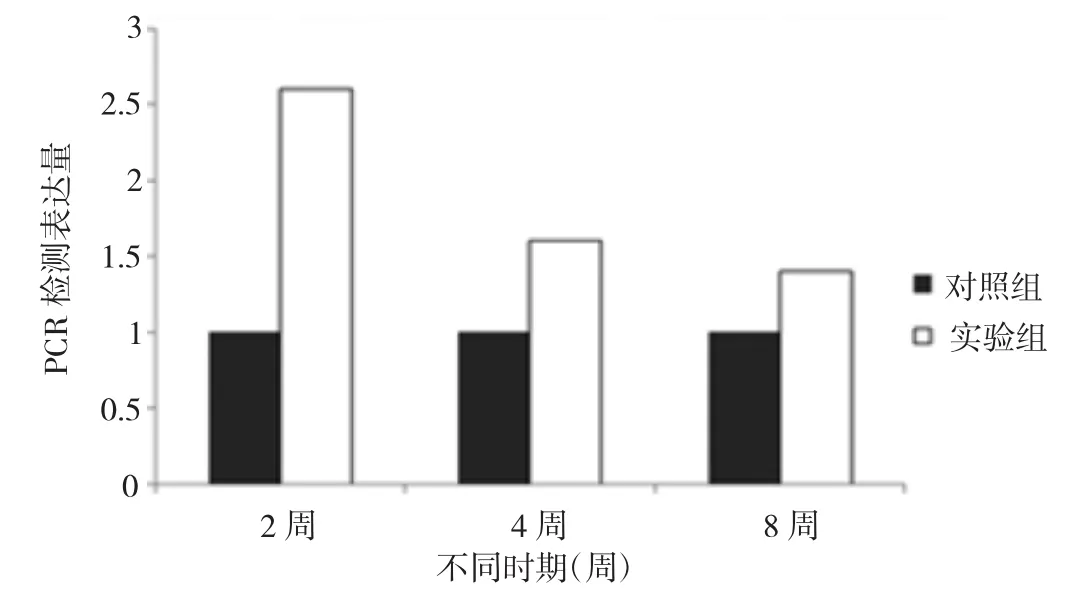
图9 两组SAB中TNF-α mRNA在术后2、4、8周的表达量
3 讨论
SAB位于三角肌深面筋膜、肩峰及喙肩韧带的下方,覆盖在冈上肌腱、二头肌间沟的浅层。为了造成大鼠肩袖全层撕裂损伤,若按Soslowsky等[12]的肩袖损伤模型切断肩袖肌腱,必然要显露和切开SAB的顶部和底部,这样对实验结果就会造成影响,因为切开SAB会激活相关细胞因子的表达。为了减少对SAB的干扰,本研究在造模时沿大鼠前肢肩胛冈肩峰端切断冈上肌,避免肱骨大结节、肩峰下进入对SAB的干扰。根据组织学肉眼及HE染色光学显微镜观察损伤肩袖造模术后不同时期各实验组大鼠肩袖损伤处均有不同程度的瘢痕组织填补修复,可见成纤维细胞积聚。本研究认为,通过这种方式建模,手术入路的相关解剖位置比较恒定,模型建立的操作过程可重复性高。
肩袖损伤患者疼痛的机制目前尚不清楚,关于肩袖损伤患者疼痛机制的研究主要集中在炎症性疼痛和神经源性疼痛两个方面。炎症是机体对体内外致炎因素引起的损伤所发生的防御反应,最近研究发现,肩关节疼痛的发生、发展与SAB的炎症有密切的联系[5-7,13]。IL-1β、IL-6和TNF-α等炎症因子已被证实与疼痛有关,同时在肩袖损伤患者的肩袖和SAB中可以检测到有炎症因子存在[9,14-15]。Voloshin等[5]在一项对104例患者SAB进行活检的组织学研究中发现,与对照组相比,肩峰撞击综合征和肩袖损伤患者的急慢性炎症因子相比较而言在组织学上更常见,而且这种细胞因子水平的高低与损伤的严重程度相关,翻修手术与全层肩袖撕裂患者中表达水平更高。本研究发现,在肩袖损伤造模的2周其SAB的IL-1β、IL-6和TNF-α细胞因子表达水平明显高于4周和8周,这可能与肩袖在修复过程有关。因此可以认为SAB中炎症因子的表达水平升高可能是肩袖损伤疾病的一个重要病理生理过程。
IL-1β和TNF-α作为始动因子,通过改变COX-2水平来调节疼痛[16]。IL-6作为炎症介质被认为是TNF-α等某些生物效应的放大因子。SAB中IL-1β的表达增加与肩袖损伤患者疼痛增加相关[4]。SAB组织同骨关节炎滑膜具有相似的滑膜细胞微环境(基质细胞、成纤维细胞样滑膜细胞),相似的细胞类型和病理特征。因此,可以想象,这些炎症因子也可能与肩袖损伤患者SAB发生病理改变相关。本研究发现,与对照组相比,实验组SAB中可见细胞数量和血管分布的增加。免疫组化及实时RT-PCR显示实验组的IL-1β、IL-6和TNF-α在SAB中的表达水平在各时间段均明显升高,这与Voloshin等[5]在肩袖损伤患者的SAB研究发现基本相符。因此,本研究认为肩袖损伤导致的SAB慢性炎症反应是导致肩袖疾病患者肩痛及功能障碍的重要原因。
当然本研究也存在一些不足,如研究的样本量相对偏小,研究中所使用的实验技术还不够精确及完善,而且只纳入IL-1β、IL-6和TNF-α 3个炎症因子,还不能完全证实本研究的结论。此外,没有检测基质金属蛋白酶和生长因子水平,而这两个指标被证实与肩袖损伤的发生发展密切相关。虽有上述不足,但本研究较早且相对完整地研究肩袖损伤后SAB中炎症因子的变化,对临床上解释肩袖损伤后疼痛的发生、发展有重要的参考意义。
综上所述,本研究结果提示,肩袖损伤后SAB中IL-1β、IL-6和TNF-α水平明显升高,提示该变化可能是肩袖损伤后引起肩关节疼痛和功能障碍的发病机制之一。后期需要更多的研究进一步明确上述炎症因子通过何种通路诱发肩关节疼痛。
[1] BediA,Dines J,Warren R F,et al.Massive tears of the rotator cuff [J].J Bone Joint Surg Am,2010,92(9):1894-1908.
[2] JoshiS K,Kim H T,Feeley B T,et al.Differentialubiquitin-proteasome and autophagy signaling following rotator cuff tears and suprascapular nerve injury[J].J Orthop Res,2014,32(1):138-144.
[3] Gotoh M,Hamada K,Yamakawa H,et al.Increased substance P in subacromialbursa and shoulder pain in rotator cuffdiseases[J]. J Orthop Res,1998,16(5):618-621.
[4] Gotoh M,Hamada K,Yamakawa H,et al.Interleukin-1 induced glenohumeral synovitis and shoulder pain in rotator cuff diseases [J].J Orthop Res,2002,20(6):1365-1371.
[5] Voloshin I,Gelinas J,Maloney M D,et al.Proinflammatory cytokines and metalloproteases are expressed in the subacromial bursa in patients with rotator cuff disease[J].Arthroscopy,2005, 21(9):1076.e1-1076.e9.
[6] Blaine T A,Kim YS,Voloshin I,et al.The molecular pathophysiology of subacromial bursitis in rotator cuff disease[J].J Shoulder and Elbow Surg,2005,14(1):S84-S89.
[7] Lho YM,Ha E,Cho C H,et al.Inflammatory cytokines are overexpressed in the subacromial bursa of frozen shoulder[J].J Shoulder and Elbow Surg,2013,22(5):666-672.
[8] Szomor Z L,Wang M X,Kruller A,et al.Differential expression of cytokines and nitric oxide synthase isoforms in human rotator cuff bursa[J].Ann Rheum Dis,2001,60(4):431-432.
[9] Ko J Y,Wang F S,Huang H Y,et al.Increased IL-1beta expression and myofibroblast recruitment in subacromial bursa is associated with rotator cuff lesions with shoulder stiffness[J].J Orthop Res,2008,26(8):1090-1097.
[10] Yoshida M,Funasaki H,Saito M,et al.Pathologic gene expression in adhesive subacromial bursae of human shoulder[J].Clin Orthop Relat Res,2003(412):57-64.
[11] HironoriY,Nobuyasu O,TomonoriK,et al.Assessment of painrelated behavior and pro-inflammatory cytokine levels in the rat rotator cufftear model[J].J Orthop Res,2013,32(2):286-290.
[12] Soslowsky L J,Carpenter J E,DeBano C M,et al.Development and use ofan animalmodelfor investigations on rotator cuffdisease[J].J Shoulder and Elbow Surg,1996,5(5):383-392.
[13] TzuzakiM,Guyton G,Garret W,et al.IL-1 beta induces COX-2, MMP-1,-3,and-13,ADAMTS-4,IL-1 beta,and IL-6 in human tendon cells[J].J Orthop Res,2003,21(2):256-264.
[14] Yamazaki H,Ochiai N,Kenmoku T,et al.Assessment of painrelated behavior and pro‐inflammatory cytokine levels in the rat rotator cufftear model[J].J Orthop Res,2014,32(2):286-290.
[15] Bunker T D,Reilly J,Baird K S,et al.Expression of growth factors,cytokines and matrix metalloproteinases in frozen shoulder [J].J Bone Joint Surg Br,2000,82(5):768-773.
[16] Feldmann M,Brennan F M,Maini R N.Role of cytokines inrheumatoid arthritis[J].Annu Rev Immunol,1996,14(1):397-440.
Expression of IL-1β,IL-6,TNF-α in subacromial bursa of rat rotator cuff tear model
ZHENG Rongzong,LOU Chao,TONG Yongjun,et al.Department of Orthopedics,Lishui Central Hospital,Lishui 323000,China
【 Abstract】 Objective To investigate the expression of interleukin-1β (IL-1β),interleukin-6(IL-6)and tumor necrosis factor α(TNF-α)in subacromial bursa(SAB)of rat rotator cuff tear model. Methods The rotator cuff tear model was induced by SAB sparing supraspinatus tenotomy in the right shoulders of 12 adult female Sprague-Dawley rats(experimental group),and 12 left shoulders underwent sham surgery as control group.The subacromial bursas were obtained from 4 rats each time at postoperative 2,4,8 weeks.The histological changes were observed by hematoxylin-eosin(HE)staining.The expression of IL-1β,IL-6 and TNF-α proteins and mRNA were measured by immunohistochemistry and real-time reverse transcriptasepolymerase chain reaction(RT-PCR),respectively. Results HE staining showed that there were increase of cell numbers and vascularization in experimental group compared with control group.The expressions of IL-1β,IL-6 and TNF-α proteins and mRNA were significantly higher in experimental group than those in control groups at all time points(P<0.05). Conclusion These findings suggest that elevated levels of IL-1β,IL-6 and TNF-α in the subacromial bursa might be correlated with the pain and limited range of motion in ratator cuff tear.
Cytokine Rotator cuffSubacromialbursa Mouse model
2016-02-21)
(本文编辑:陈丽)
浙江省自然科学基金(Y16H060027);浙江省医药卫生一般研究计划(2012KYB249)
323000 丽水市中心医院骨科(郑荣宗、楼超、黄淑明、吴泉州);浙江医院骨科(童勇骏)
黄淑明,E-mail:smhuang001@163.com

