CXC类趋化因子受体4基因多态性对新辅助化疗宫颈癌患者疗效及预后的影响
, ,,,,
(1.深圳市第七人民医院妇产科,广东 深圳 518081;2.中山大学孙逸仙纪念医院妇科肿瘤)
·妇产科疾病专题·

田春芳 主任医师
田春芳,深圳市第七人民医院产科主任,主任医师,硕士研究生导师。近年来任深圳市妇产科专业委员会委员,感染学组副主任委员,围产医学专业委员会委员,妇产科中西医结合专业委员会委员,深圳市抗癌学会常务理事,是《中华现代妇产科学杂志》常务编委、《中南医学科学杂志》编委。汕头大学医学院硕士研究生导师。近年来开展了新技术、新项目40余项,主编著作2本,发表论文40篇。获得国家发明专利16项。
论文点评:妇科肿瘤与妊娠期糖尿病是严重危害妇女的健康主要疾病。本期温展翀等发表的关于CXCR4基因多态性与宫颈癌的进展和化疗以及患者生存预后的关系,为建立宫颈癌的预防和治疗大数据提供了有价值资料;何海燕关于不同类型紫杉醇治疗复发性卵巢癌的临床效果,为寻找治疗卵巢癌高效低毒的纳米药物进行了探索;刘新玉关于经阴道三维超声和宫腔镜两者在诊断子宫内膜良恶性病变的价值,以及刘华珍等关于妊娠期糖尿病产妇胎盘脂联素与血清脂联素水平、孕妇胰岛素抵抗和胎儿生长发育的相关性,这些研究为妇产科肿瘤和糖尿病的诊断和治疗提供了有价值的参考资料,值得一读。
CXC类趋化因子受体4基因多态性对新辅助化疗宫颈癌患者疗效及预后的影响
温展翀1*,陈勍2,黄妙玲2,巴音吉力2,徐干如1,田春芳1
(1.深圳市第七人民医院妇产科,广东 深圳 518081;2.中山大学孙逸仙纪念医院妇科肿瘤)
目的探讨CXCR4基因多态性对新辅助化疗宫颈癌患者化疗疗效的影响以及与新辅助化疗加广泛子宫切除的宫颈癌患者的预后关系。方法选取妇科肿瘤专科收治的62例IB2-IIB期宫颈癌患者;按照试剂盒说明书的指导蜡块组织提取组织DNA;PCR扩增基因组DNA片段;直接测序法检测DNA片段序列,测序结果采用图像分析软件“Chromas2”进行终点分析。结果扩增PCR产物为236 bp;62例样本中,CC基因型25例(40.3%),CT基因型37例(59.7%),TT基因型0例(0.0%)。T等位基因频率为2.98%;CXCR4基因Ile138Ile位点没有发现突变纯合子;位点Ile138Ile在病人中的基因分布频率与化疗反应无显著的相关性(P=0.771);Ile138Ile位点CC型和CT型分布情况在宫颈浸润深度两组中(P=0.025)、淋巴结转移情况两组中(P=0.031)差异有统计学意义,而在化疗效果显示,患者年龄、组织类型、FIGO分期、肿瘤分化程度、肿瘤大小、脉管浸润、贫血情况各组中差异无统计学意义(P均>0.05);CXCR4基因ATT/ATC (Ile138Ile)位点CC型和CT型两组患者,三年生存率分别为86.4%、70.6%。Log-rank检验结果显示这两个年龄组患者的无病生存率和总生存率差别均无统计学意义。结论
CXCR4基因单核苷酸多态性位点Ile138Ile对宫颈癌的进展有影响; CXCR4基因单核苷酸多态性与新辅助化疗宫颈癌患者的生存预后可能无关。
趋化因子受体4; 新辅助化疗; 宫颈癌; 生存预后; 化疗反应
宫颈癌是女性生殖器官三大恶性肿瘤之一,并且是导致女性肿瘤相关的死亡的第二因素。目前宫颈癌的治疗方法依据国际妇癌联盟(International Federation of Gynecology and Obstetrics,FIGO)分期的不同而有不同的治疗策略,早期宫颈癌(定义为FIGO 分期的ⅠB1 期和肿瘤<4 cm者)的标准治疗方法为根治性手术切除[1]。
局部晚期宫颈癌(locally advanced cervical cancer,LACC),是指具有不良预后因素的高危宫颈癌[2],狭义的局部晚期宫颈癌包括 FIGO临床分期标准的 IB2-IIB期。自从上世纪八十年代开始,新辅助化疗(neoadjuvant chemotherapy,NACT)开始逐渐应用于LACC。大量研究表明NACT对局部晚期宫颈癌的治疗有积极意义,近期疗效肯定[3]。但化疗不敏感的问题仍然尚待解决,部分患者对化疗药物的不敏感,如行NACT治疗将会延误患者进行其它有效的治疗[4]。所以,建立有效的方法来评估患者对化疗的反应以达到个体化的治疗十分必要。
近年发现趋化因子受体4(Chemokine receptor 4,CXCR4)与恶性肿瘤浸润和转移的多个环节有关。目前关于CXCR4多态性与肿瘤发生发展及肿瘤预后的研究较少,而在宫颈癌方面,有研究认为[5],分期越晚的宫颈癌CXCR4的表达水平越高,且CXCR4的表达与淋巴结转移有关,但尚未见CXCR4基因单核苷酸基因多态性在宫颈癌方面的研究报道,也未见到有关CXCR4基因突变与新辅助化疗宫颈癌患者的疗效及远期预后相关性的报道。
1 资料与方法
1.1病例资料收集筛查2006年2月至2012年2月期间在中山大学附属孙逸仙纪念医院住院的宫颈癌病例,纳入标准如下:1)治疗前病理活检确诊为宫颈癌,FIGO临床分期为ⅠB2-ⅡB期;2)手术前行2~3个疗程的以铂类为基础的新辅助化疗,化疗后行根治性手术治疗;3)详细的临床病理资料;4)足够的蜡块标本。排除标准为:1)入院前已接受过治疗的患者;2)曾患过其他部位恶性肿瘤或同时有两个部位的恶性肿瘤;3)资料不足以评价患者的疗效或者生存预后;4)组织量少而不足以分析患者基因型改变。按上述标准,共纳入62例,中位数年龄45岁(25~65岁)。按组织类型分类,鳞状细胞癌52例,腺癌10例。其中,IB2期23例,ⅡA期24例,ⅡB15例。出院后随访计划:术后2年内每3个月随访一次,接下来的3年内每半年随访一次,5年后每年随访一次。随访内容包括盆腔检查、阴道细胞学检查、肿瘤标志物检查及影像学检查。未返院随访的病人,每半年电话随访一次,记录患者一般身体情况,外院随访情况,有无复发等。
1.2患者的治疗方案及评价上述病人治疗前由妇科肿瘤专家行盆腔检查,影像学检查包括盆腔MRI或CT或妇科B超。新辅助化疗方案为顺铂60 mg/m2,紫杉醇60 mg/m2或135 mg/m2,均采用静脉途径化疗1~2个疗程,每个疗程间隔时间为10天或21天,每疗程结束后7~10天评估疗效,评估方法包括体格检查和影像学检查。有效者继续行第2个疗程,效果不明显甚至进展者则在第1个疗程结束后行广泛全子宫切除加盆腔淋巴结清扫术,部分患者行腹主动脉旁淋巴结切除或活检,术后根据病理采取辅助同期放化疗。化疗疗效按照固体肿瘤疗效评价标准(RECIST guideline 1.1版)[6]:完全缓解(CR):肿瘤完全消失;部分缓解( PR):肿瘤体积缩小>30%;疾病稳定或无变化(SD):肿瘤体积缩小<30% 或增大<20%;进展(PD):肿瘤体积增大>20%;统计分析以CR+PR为有效。根据评价标准,其中CR6例,PR35例,SD20例,PD1例。
1.3术后病理资料分析62例患者术后病理资料显示,肿瘤高中分化34例,低分化28例;肿瘤直径以4 cm为界值,直径<4 cm 有18例,≥4 cm有44例;肿瘤浸润深度≤1/2有22例,>1/2有40例。脉管浸润阳性42例,阴性20例。有淋巴结转移25例,无淋巴结转移37例。见表 1。
表12CRP+1444C/TPCR反应体系

试剂用量NucleaseFreewater7uLPrimer(10ummol/L)2uLPrimer(10ummol/L)2uLPremixTaqPolymerase12.5uLTemplateDNA1.5uLTotalVolume25uL
1.4实验方法及步骤
1.4.1 蜡块DNA提取 从病理科申请患者的蜡块组织,按照 QIAamp DNA FFPE Tissue Kit 试剂盒(Qiagen Inc.,Hilden,Germany)说明书的指导提取组织 DNA。
1.4.2 PCR引物设计 参照文献[6]设计引物,引物序列为5′-TCATCTACACAgTCAACCTCTACAgC-3′(前向)和 5′-CAAAgATgAAgTCgggAATAgTCAgC-3′(逆向)。扩增出的CXCR4基因目标序列为236 bp。
1.4.3 PCR扩增蜡块基因组DNA 采用Takara公司的Premix Tag酶,反应体系依次加入下列底物:
反应参数为: 先94 ℃预变性7 min, 然后94 ℃变性1 min, 55 ℃复性30 s, 72 ℃延伸1 min,共35个循环,72 ℃延伸7 min。PCR产物 4 ℃短时保存,-20 ℃长期保存。
1.4.4 琼脂糖凝胶电泳检测PCR产物 称取琼脂糖6g加入0.5×TAE 30 mL混匀,微波炉加热溶解直至琼脂糖溶解透明,待胶温度下降至约 60℃左右将其倒于制胶板中,插入梳子待其凝固即用。取PCR产物5 uL,加10×Loading Buffer 0.5 uL 和 SYBR safe DNA Gel Stain 工作液0.5 uL,点样于2%的琼脂糖凝胶的加样孔中,100V电压,常温电泳30分钟。紫外光透射仪加filter滤光器下观察图像,使用凝胶成像系统成像。
1.4.5 PCR产物序列测定 经琼脂糖凝胶电泳检测PCR成功的产物交广州艾基生物技术有限公司测序服务部(ABI 3730xl激光荧光测序仪)测序。所得数据以图像分析软件“Chromas2”进行终点分析,通过检测不同等位基因所标示的荧光强度,判断各待测样本基因分型为野生纯合子、突变纯合子还是杂合子。
1.5统计学方法①本文所有统计学分析均采用SPSS20.0统计软件分析。②单核苷酸基因多态性与临床病理参数关系的分析采用Pearson χ2检验或Fisher精确检验法。③无病生存时间(DFS)为从明确诊断到复发、死亡或者最后一次随访的时间。总生存时间(OS)为从明确诊断到无论任何原因死亡的时间。生存结局用 Kaplan-Meier生存曲线估计,生存曲线的差异分析采用 Log-rank检验。④多因素生存分析采用Cox比例风险回归模型。以上所有的统计学分析均以P≤0.05 为界值。
2 结 果
2.1入组情况在随访期间,4例失访。在对有随访资料的病例样本进行DNA提取实验后,其中3例样本因组织量不足提取失败。
2.2 PCR扩增结果扩增PCR产物为236 bp,序列为:TCATCTACACAGTCAACCTCTACAGCCAAAGATGAAGTCGGGAATAGTCAGCTCATCTACACAGTCAACCTCTACAGCAGTGTCCTCATCCTGGCCTTCATCAGTCTGGACCGCTACCTGGCCATCGTCCACGCCACCAACAGTCAGAGGCCAAGGAAGCTGTTGGCTGAAAAGGTGGTCTATGTTGGCGTCTGGATCCCTGCCCTCCTGCTGACTATTCCCGACTTCATCTTTG。
经琼脂糖凝胶电泳后在紫外线成像系统得到图片如图1。
图1 CXCR4基因的PCR产物的电泳图 M:为Mark,1~6:为目的基因
2.3基因测序结果CC基因型25例(40.3%),CT基因型37例(59.7%),TT基因型0例。T等位基因频率为2.98%。图像分析软件“Chromas2”终点分析结果如图2。
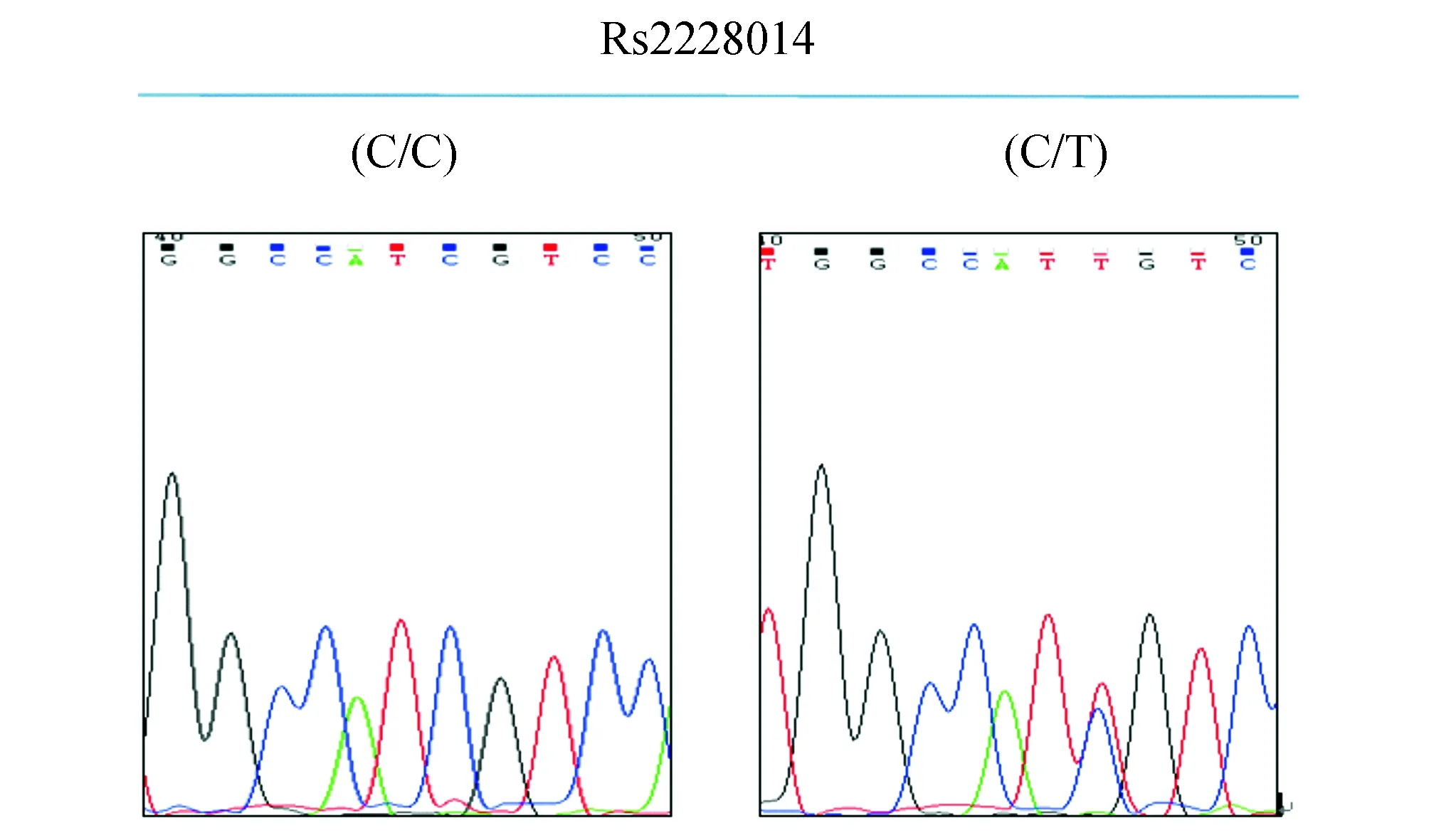
图2 CXCR4基因ATT/ATC (Ile138Ile)位点测序图 其中图C/C为野生型纯合子;图C/T为杂合子,显示出 T 和 C碱基两种峰
2.4基因分布频率与患者化疗效果、临床病理特征的关系62例宫颈癌患者CXCR4基因 ATT/ATC (Ile138Ile)位点分布情况与患者化疗效果、临床病理特征的关系结果见表2。
从表2可知,Ile138Ile位点CC型和CT型分布情况在宫颈浸润深度两组中(P=0.025)、淋巴结转移情况两组中(P=0.031)差异有统计学意义,而在化疗效果、患者年龄、组织类型、FIGO分期、肿瘤分化程度、肿瘤大小、脉管浸润、贫血情况各组中差异无统计学意义(P均>0.05)。
2.5生存预后分析在随访期间,62例宫颈癌患者中有15例出现宫颈癌复发,15例复发中有12例死亡。总体无病生存率为75.8%(47/62),总生存率80.6%(50/62)。62例患者三年无病生存率76.8%(43/56),三年总生存率为73.2%(41/56)。总随访时间介于7~73个月;死亡者生存时间介于7~31个月,死亡者中位生存时间为18个月。结合生存曲线(图3)可以看出,患者在最初两年内生存曲线下降最快,随访期内复发的患者均发生在术后两年内,也就是说患者在术后两年内复发、死亡率较高。
表262例宫颈癌患者CXCR4基因ATT/ATC(Ile138Ile)位点分布情况与患者化疗效果、临床病理特征的关系
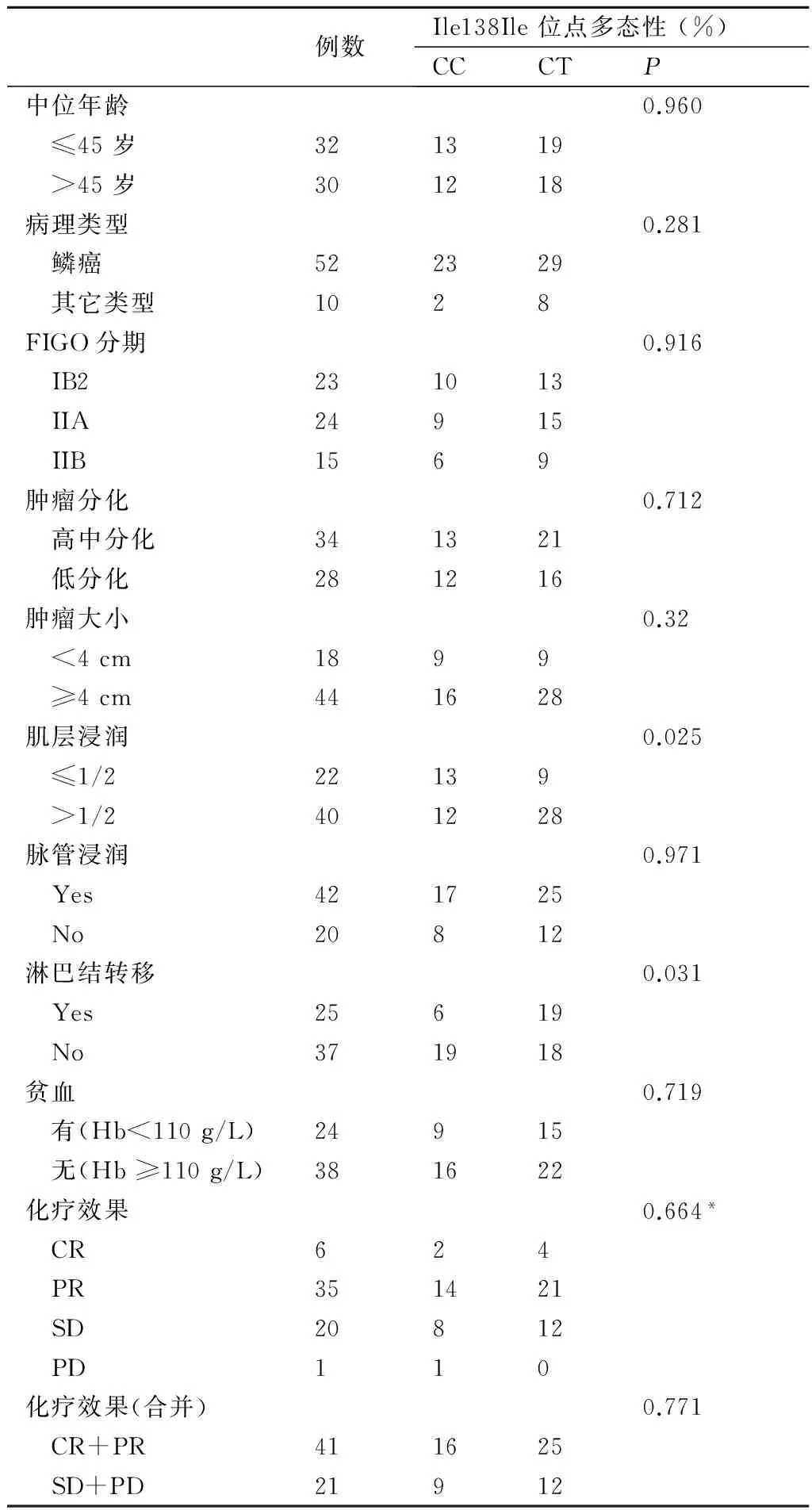
例数Ile138Ile位点多态性(%)CCCTP中位年龄0.960 ≤45岁321319 >45岁301218病理类型0.281 鳞癌522329 其它类型1028FIGO分期0.916 IB2231013 IIA24915 IIB1569肿瘤分化0.712 高中分化341321 低分化281216肿瘤大小0.32 <4cm1899 ≥4cm441628肌层浸润0.025 ≤1/222139 >1/2401228脉管浸润0.971 Yes421725 No20812淋巴结转移0.031 Yes25619 No371918贫血0.719 有(Hb<110g/L)24915 无(Hb≥110g/L)381622化疗效果0.664* CR624 PR351421 SD20812 PD110化疗效果(合并)0.771 CR+PR411625 SD+PD21912
其中*:结果来自Kruskal-Wallis检验
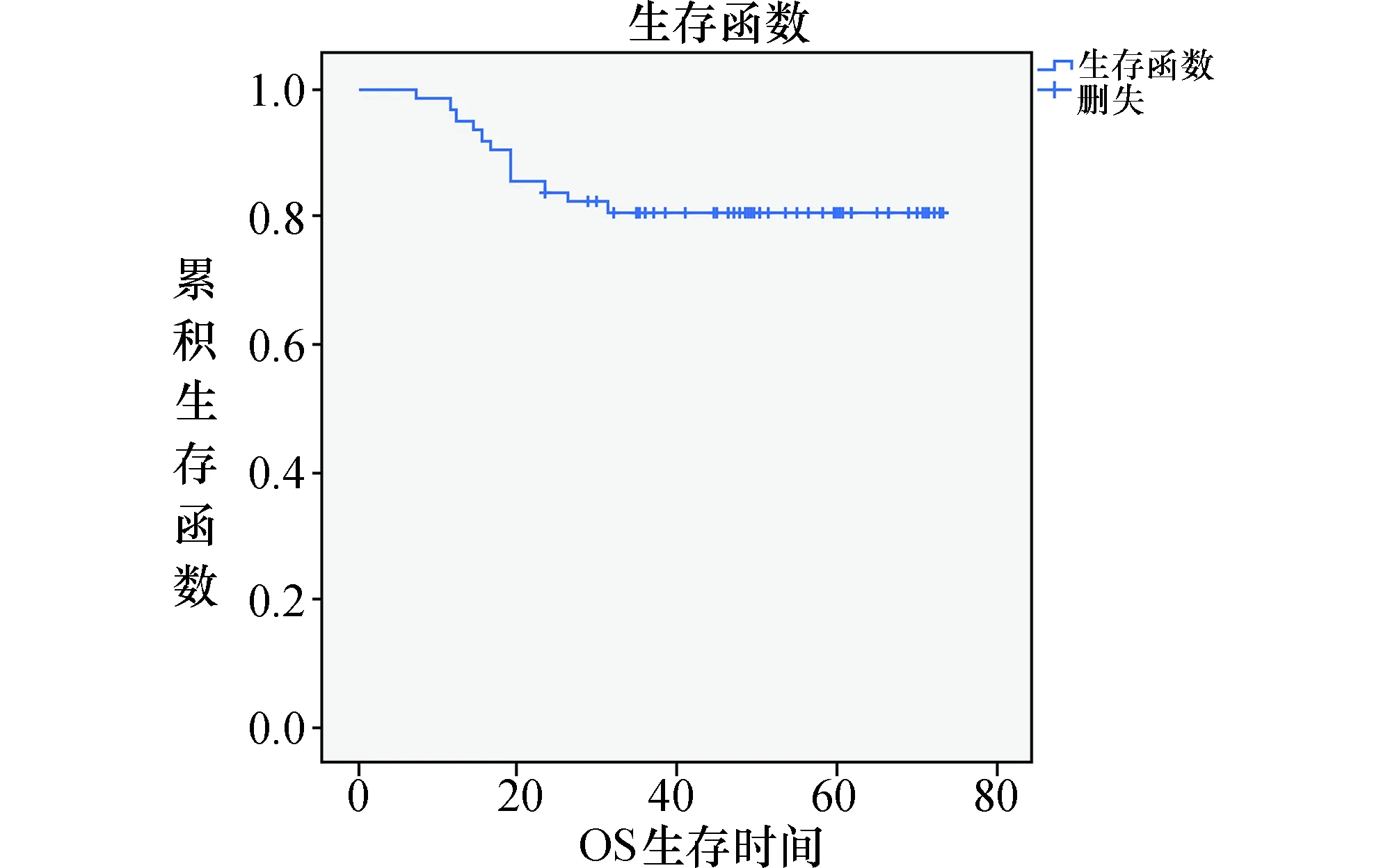
图3 62例宫颈癌患者的生存曲线
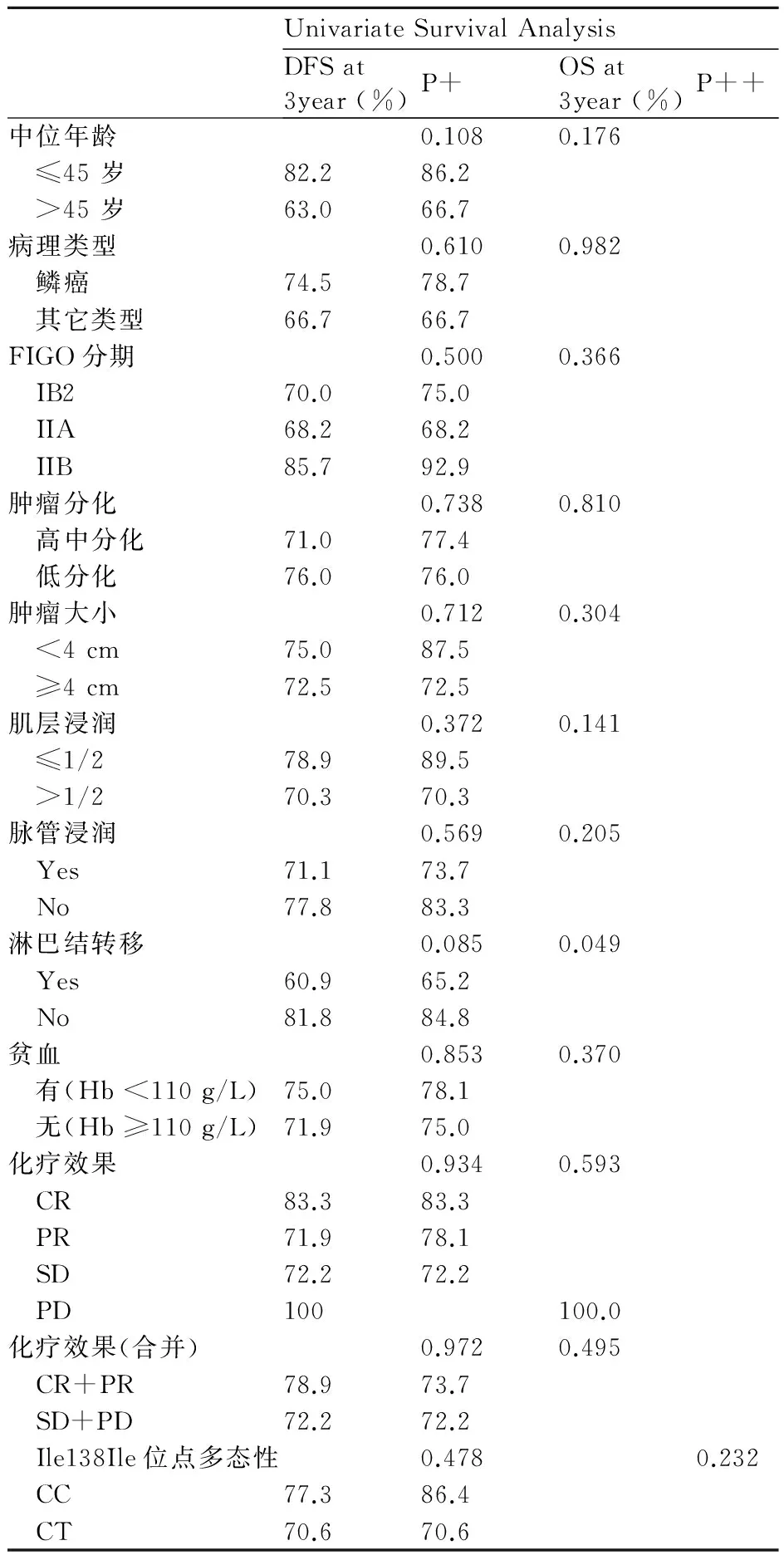
用Kaplan-Meier单因素生存分析计算宫颈癌患者CXCR4基因ATT/ATC (Ile138Ile)位点基因型分布情况、化疗效果、临床病理参数的各个分组的生存率并绘制成图,并用log-rank检验分别分析患者无病生存率、总生存率差别有无统计学意义(表3)。
由上可知,Kaplan-Meier单因素生存分析和log-rank检验表明:淋巴结转移情况是影响宫颈癌患者生存的预后相关因素(P=0.049)。
综上,单因素生存分析表明,淋巴结转移是影响患者生存预后的因素(P=0.049)见表3、图4。CXCR4基因ATT/ATC位点基因型分布频率与患者生存预后无统计学相关,见表1。在多因素的分析中,未能得出有统计学意义的结果。
3 讨 论
3.1 CXCR4基因单核苷酸多态性对肿瘤的影响近年来越来越多的研究发现趋化因子及其受体在恶性肿瘤的增殖转移中发挥重要作用,一方面,趋化因子可抑制肿瘤细胞凋亡、促进细胞外基质降解,从而达到促进肿瘤生长和转移的效应[7,8];另一方面,趋化因子及其受体共同作用可趋化肿瘤细胞定向迁移,协助肿瘤细胞粘附至内皮细胞、穿透血管内皮,并在促进血管、淋巴管形成和肿瘤逃逸等方面均起着帮助作用[9-10]。自2001年Muller,等[11]首先报道人乳腺癌细胞系和组织中高表达CXCR4以来,目前已发现CXCR4至少在23种不同的恶性肿瘤中表达,并与这些疾病的区域淋巴结转移高度相关。
在基因多态性(SNP)方面,Lee,等[12]研究显示,携带CXCR4突变基因T会导致非小细胞肺癌的易感,携带TT基因型的非小细胞肺癌病人与其它基因型病人相比分期较晚,且生存预后较差。Teng,等[13]研究表明,口腔癌病人携带CXCR4突变基因T分别与分期较晚和淋巴转移相关。然而,有其它研究[12,14]未能得出CXCR4多态性与肿瘤预后相关的结论。
表362例宫颈癌患者的单因素(log-rank)生存分析
UnivariateSurvivalAnalysisDFSat3year(%)P+OSat3year(%)P++中位年龄0.1080.176 ≤45岁82.286.2 >45岁63.066.7病理类型0.6100.982 鳞癌74.578.7 其它类型66.766.7FIGO分期0.5000.366 IB270.075.0 IIA68.268.2 IIB85.792.9肿瘤分化0.7380.810 高中分化71.077.4 低分化76.076.0肿瘤大小0.7120.304 <4cm75.087.5 ≥4cm72.572.5肌层浸润0.3720.141 ≤1/278.989.5 >1/270.370.3脉管浸润0.5690.205 Yes71.173.7 No77.883.3淋巴结转移0.0850.049 Yes60.965.2 No81.884.8贫血0.8530.370 有(Hb<110g/L)75.078.1 无(Hb≥110g/L)71.975.0化疗效果0.9340.593 CR83.383.3 PR71.978.1 SD72.272.2 PD100100.0化疗效果(合并)0.9720.495 CR+PR78.973.7 SD+PD72.272.2 Ile138Ile位点多态性0.4780.232 CC77.386.4 CT70.670.6
P+:P来自无病生存率log-rank 检验;P++:P来自总生存率 log-rank 检验
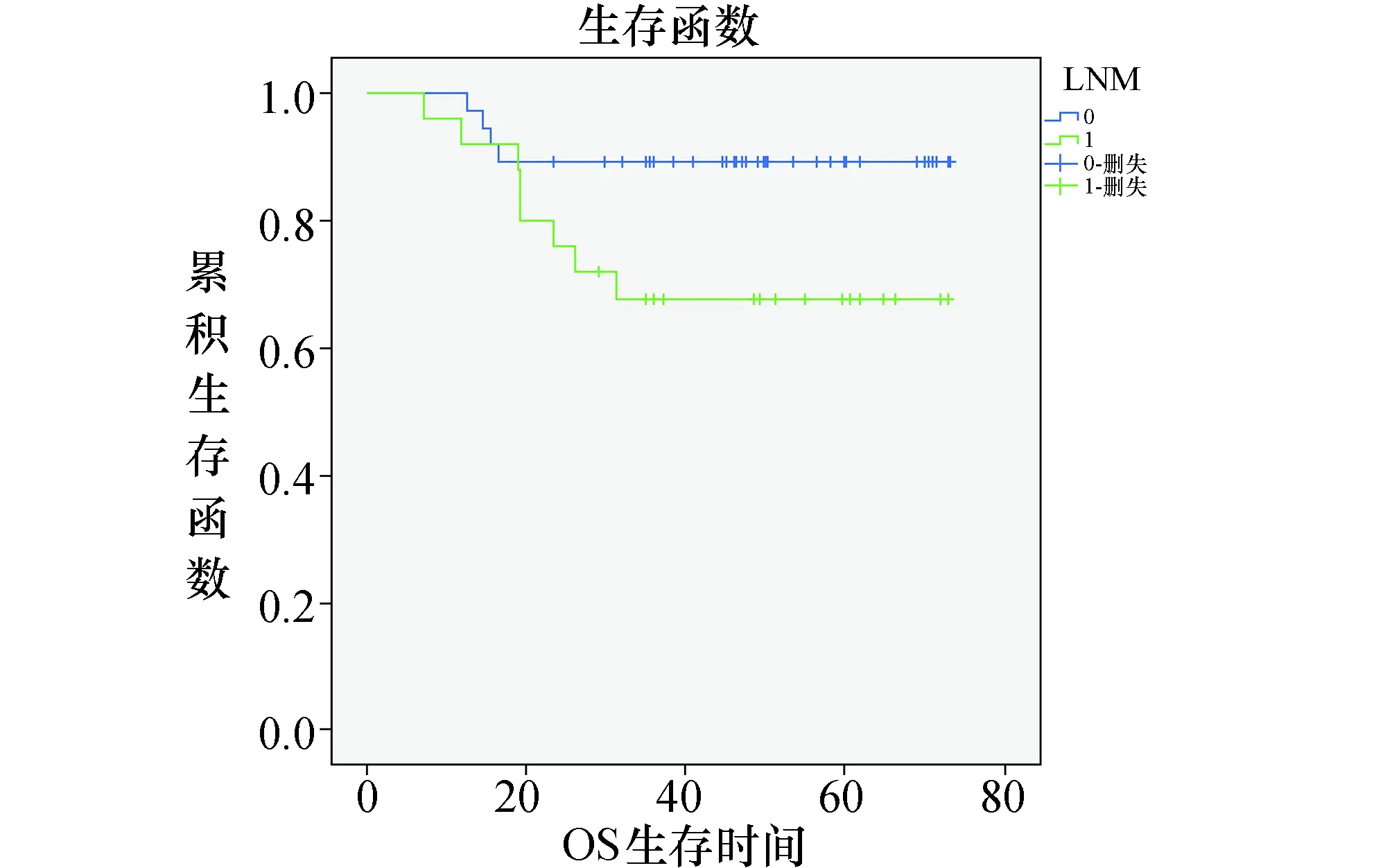
图4 62例宫颈癌患者淋巴结转移情况的生存曲线
3.2 CXCR4基因单核苷酸多态性与宫颈癌预后的关系研究显示[14-15],CXCR4在宫颈癌组织中的表达明显高于在正常宫颈组织中的表达,分期越晚的宫颈癌CXCR4蛋白的表达水平越高,提示CXCR4在宫颈癌的发生发展中起着重要作用。另外,CXCR4的表达还与宫颈癌细胞淋巴结转移密切相关。Yang,等[16]研究发现高表达CXCR4的宫颈腺癌患者比弱表达或不表达CXCR4的宫颈腺癌患者更容易发生盆腔淋巴结转移,故CXCR4还可能提示宫颈癌淋巴结转移的潜能。Kodaman,等[17]也得出类似的研究结论,并认为CXCR4是盆腔淋巴结转移的独立影响因素。本研究在生存预后分析中发现,根据单因素生存分析表明,淋巴结转移是影响患者生存预后的因素(P=0.049),提示CXCR4可能在宫颈癌的淋巴结转移中发挥着重要作用。
3.3 CXCR4基因单核苷酸多态性与化疗反应的关系肿瘤组织的耐药性是肿瘤化疗的主要难题之一,其中一个重要机制就是肿瘤细胞对低氧状态的耐受[18-19]。研究显示:肿瘤内缺氧可通过CXCR4增加肿瘤细胞的侵袭、迁移和附着力。在女性生殖系统恶性肿瘤中,CXCR4对化疗反应的影响尚不明了。在CXCR4蛋白表达的研究中,Nakai,et al[20]发现高表达CXCR4蛋白的病例有更好的化疗效果。在本实验研究中发现CXCR4基因的多态性位点的分布频率与行以铂类为基础的新辅助化疗患者的化疗反应之间不存在显著的统计学关系。
尽管本研究尽力做到实验研究应有的完整性,但是本文仍有几点不足之处,首先,由于本实验为回顾性研究,所有的临床数据均为回顾性资料,尽管近最大努力保证了临床数据的完整性。但是难免存在病例失访及部分数据无法收集而产生的数据不全。第二,样本量较少,检验效能不高,得出假阴性的可能性较大,故实验结果的解读应谨慎。
据文献回顾可知,本研究第一次在行新辅助化疗的宫颈癌患者中研究了CXCR4基因多态性对患者生存预后影响;第一次在宫颈癌病例中探讨了CXCR4基因多态性与新辅助化疗的疗效关系;全面地探讨了CXCR4基因多态性与局部晚期宫颈癌患者的无病生存率、总生存率和临床参数的关系,使本实验的结果结论更加具有说服力。
[1] Pecorelli S.Revised FIGO staging for carcinoma of the vulva,cervix,and endometrium[J].Int J Gynaecol Obstet,2009,105(2):103-104.
[2] Katsaros D,Gribaudo S.The proper use of multimodality treatment in locally advanced cervical cancer[J].Gynecol Oncol,2011,121(2):422-423,422.
[3] Rydzewska L,Tierney J,Vale C L,et al.Neoadjuvant chemotherapy plus surgery versus surgery for cervical cancer[J].Cochrane Database Syst Rev,2012,12:D7406.
[4] Gonzalez-Martin A,Gonzalez-Cortijo L,Carballo N,et al.The current role of neoadjuvant chemotherapy in the management of cervical carcinoma[J].Gynecol Oncol,2008,110(3 Suppl 2):S36-S40.
[5] Hashimoto K,Ikeda Y,Korenaga D,et al.The impact of preoperative serum C-reactive protein on the prognosis of patients with hepatocellular carcinoma.Cancer,2005,103:1856-64.
[6] Eisenhauer E A,Therasse P,Bogaerts J,et al.New response evaluation criteria in solid tumours:revised RECIST guideline (version 1.1)[J].Eur J Cancer,2009,45(2):228-247.
[7] América Martínez-Calleja,1 IrmaQuiróz-Vargas,et al.Haplotypes in the CRP Gene Associated with Increased BMI and Levelsof CRP inSubjectswithType2 Diabetes or Obesity from Southwestern Mexico.Experimental Diabetes Research,2012,8,7.
[8] Jaqdev SP,Greqory W,Vasudev NS,et al.Improving the accuracy of pre-operative survival prediction in renal cell carcinoma with C-reactive protein.Br J Cancer,2010,103:1649-56.
[9] Motoyama S,Miura M,Hinai Y,et al.CRP genetic polymorphism is associated with lymph node metastasis in thoracic esophageal squamous cell cancer.Ann Surg Oncol,2009,16:2479-85.
[10] BjØrge T,Stocks T,Lukanova A,et al.Metabolic Syndrome and Endometrial Carcinoma[ J ].Am J Epidemiol,2010,171 (8):892-899.
[11] Matsuhashi N,Saio M,Matsuo A,et al.p53 dependence and apoptosis in response to FP treatment with p53-transfected colon cancer cell lines by use of thin layer collagen gel[J].Oncol Rep,2004,12(2):357-361.
[12] Arem H,Park Y,Pelser C,et al.Prediagnosis Body Mass Index,Physical Activity,and Mortality in Endometrial Cancer Patients[J].J Natl Cancer Inst.2013;105(5):342-349.
[13] Boon WC,Chow JD,Simpson ER.The multiple roles of estroge ns and the enzyme aromatase.[J]Prog Brain Res.2010;181:209- 2 32.
[14] Slattery ML,Curtin K,Poole EM,et al.Genetic variation in C-reactive protein in relation to colon and rectal cancer risk and survival.Int J Cancer,2011,128:2726-34.
[15] Sekar MD,Martin G,Ramachandran S,et al.Contribution of Clinical Correlatesand 13 C-reactive protein gene polymorphisms to interindividual variability in serum C-reactive protein level.Circulation,2006,113:1415-23.
[16] Dossus L,Rinaldi S,Becker S,et al.Obesity,inflammatory markers,and endometrial cancer risk:a prospective case-control study.Endocr Relat Cancer,2010,17:1007-1019.
[17] Xue F,Michels KB.Diabetes,metabolic syndrome,and breast can cer:areview of the current evidence[ J ].Am J Clin Nutr,2007,8 6 (Suppl 3):S823-S835.
[18] Pisani P,Hyer-insulinaemia and cancer,meta- analyses of epidemiological studies.[J]Arch Physiol Biochem.2008,114 (1):63-70.
[19] Shrive AK,Cheetham GM,Holden D,et al.Three dimensional structure of human C-reactive protein.Nat Struct Biol,1996,3:346-354.
[20] Howard D,Julie E.C-reactive protein and the risk of developing hypertension.BMJ,2003,290:2945-2949.
CXCR-4genePolymorphismandtheResponseinCervicalCancerPatientsTreatedwithNeoadjuvantChemotherapyMajor
WEN Zhanchong,CHEN Qing,HUANG Miaoling,et al
(DepartmentofObstetricsandGynecology,theSeventhPeople’sHospitalofShenzhenCity,Shenzhen,Guangdong518081,China)
ObjectiveTo explore the influence of CXCR-4 gene polymorphism on the chemotherapeutic response and prognosis of cervical cancer patients who
NACT followed radical surgery.Methods62 patients were enrolled in this study;Samples were recruited from the formalin-fixed,paraffin-embedded surgical specimens.DNA was extracted using the QIAamp DNA FFPE Tissue Kit;PCR of paraffin block genomic DNA;Direct sequence of DNA:All PCR products were further purified for commercial sequencing.ResultsThe length of the amplicon is 236bp; The CXCR4 genotype distributions were 25 CC (40.3%),37CT (59.7%) and 0 TT (0.0%);Most clinicopathologic results failed to show a significant relationship with polymorphism except tumor grade.;The association CXCR4 gene polymorphism and response to chemotherapy:A statistically significant association was not found and favorable treatment with platinum based chemotherapy;The influence of CXCR4 gene polymorphism on survival:CXCR4 polymorphisms were not related to DFS or OS(P>0.05).ConclusionThere are associations with CXCR4 polymorphisms and the prognosis of cervical cancer patients;.CXCR4 polymorphism has no significant association with the chemotherapeutic response of cervical cancer patients who received with platinum based neoadjuvant chemotherapy.
CXCR-4 gene; Neoadjuvant chemotherapy; Cervical cancer; Prognosis; Response to chemotherapy
10.15972/j.cnki.43-1509/r.2016.03.001
专题栏目——主持人田春芳主任
2016-04-18;
2016-05-15
*通讯作者,E-mail:13823647291@139.com.
R543
A
秦旭平)

