梅毒螺旋体膜脂蛋白Tp0821促炎活性研究
,,, ,
(江门市皮肤医院检验科,广东 江门 529000)
·基础医学·
梅毒螺旋体膜脂蛋白Tp0821促炎活性研究
吴志周,文美贞,柯建良,祝新,谭雪玲
(江门市皮肤医院检验科,广东 江门 529000)
目的探讨梅毒螺旋体(Tp)膜脂蛋白Tp0821潜在的促炎活性及可能参与的信号转导通路。方法表达重组蛋白Tp0821(rTp0821),去除其中内毒素。rTp0821刺激THP-1细胞,ELISA检测促炎细胞因子IL-6、IL-8和IL-1β的表达水平;ERK1/2、JNK、p38和NF-κB特异性抑制剂分别预处理THP-1细胞30 min,再以rTp0821刺激THP-1细胞,ELISA分别检测IL-6、IL-8和IL-1β的表达水平。结果rTp0821刺激THP-1细胞表达IL-6、IL-8和IL-1β在一定范围内与刺激时间以及蛋白浓度呈正相关,1.0 μg/mL刺激24 h时各细胞因子表达水平最高;rTp0821刺激经ERK1/2、JNK、p38和NF-κB特异性抑制剂预处理后的THP-1细胞,IL-6表达水平分别下降63.4%(P<0.001)、4.3%(P>0.05)、53.4%(P<0.001)和73.1%(P<0.0001),IL-8分别下降49.2%(P<0.001)、6.0%(P>0.05)、41.1%(P<0.001)和71.0%(P<0.001),IL-1β分别下降36.8%(P<0.01)、3.9%(P>0.05)、30.3%(P<0.001)和59.7%(P<0.001)。结论rTp0821可通过ERK1/2、p38和NF-κB通路诱导THP-1细胞表达促炎细胞因子IL-6、IL-8和IL-1β,Tp0821可能是Tp重要的致病因子。
梅毒螺旋体; 膜脂蛋白; Tp0821; 促炎细胞因子; 信号转导通路
梅毒是由梅毒螺旋体(Treponema pallidum,Tp)引起的一种性传播疾病。近年来梅毒发病率居高不下,全球每年大约新发1 200万梅毒病例,已经成为全球严重的公共卫生问题[1]。Tp不能在体外培养的特性严重限制了其致病分子和致病机制研究[2]。目前的研究表明,Tp膜脂蛋白引起的炎症可能是介导Tp感染后机体病理损伤的主要原因[3]。
同其他膜脂蛋白一样[4],Tp0821膜脂蛋白具有良好的免疫原性和抗原性[5],但其是否还具有促炎活性以及是否参与介导机体的炎症反应尚不明确。本研究旨在探讨Tp0821潜在的促炎活性以及可能参与活化的信号转导通路,为阐明Tp致病机制提供实验依据。
1 材料与方法
1.1主要材料和试剂Tp Nichols标准株以及人单核细胞(THP-1细胞)均由南华大学病原生物学研究所馈赠。BamHI和XhoI限制性内切酶购自美国NEB公司,Ni-NTA亲和层析纯化试剂盒、Detoxi-Gel TM内毒素去除胶、T4连接酶、胎牛血清以及Anti-His单克隆抗体购自美国Thermo Fisher Scientific公司,HRP-羊抗小鼠IgG购自美国Millipore公司,ECL蛋白印迹法检测试剂盒、IL-6和IL-8 ELISA试剂盒为英国Abcam公司产品。从南华大学附属第一医院和广东省江门市皮肤医院收集60份梅毒患者血清和40份正常血清。梅毒患者血清由临床诊断确诊(RPR和TPPA血清学试验阳性、特异的临床症状以及不洁性接触史)。
1.2方法
1.2.1 重组Tp0821(rTp0821)的表达、纯化与鉴定
从GenBank中获取tp0821基因序列,设计引物(上海英潍捷基公司合成)。上游引物为F5′-CGCGGATCCATGAAAGGAAAAACGGTGAG-3′,下划线为BamHI酶切位点;下游引物为R5′-CCGCTCGAGCTACAAAGCAGGCGCCACC-3′,下划线为XhoI酶切位点。以Tp Nichols株DNA为模板,PCR扩增tp0821基因,构建pET28a(+)/Tp0821重组质粒。经测序鉴定后转化至E.coli BL21中,0.1 mmol/L IPTG于30 ℃诱导表达4 h,Ni-NTA亲和层析法纯化Tp0821。BCA蛋白浓度测定试剂盒检测rTp0821浓度,Detoxi-GelTM内毒素去除胶去除其中的内毒素,鲎试剂盒检测其中内毒素含量。以Anti-His单抗为一抗,以羊抗鼠为二抗,Western blot鉴定rTp0821。
1.2.2 rTp0821促炎作用测定 THP-1细胞于37 ℃、5%CO2恒温培养箱以含10% FBS、100 U/mL青霉素G、100 μg/mL链霉素、2 mmol/L谷氨酰胺的RPMI1640培养基培养。在细胞布满整个视野时离心,弃去培养基后以无菌PBS漂洗,分装,然后加新鲜培养基继续于37 ℃、5%CO2恒温培养箱中培养。为测定不同浓度对促炎细胞因子表达水平的影响,分别以含0.5、1.0、3.0和5.0 μg/mL的rTp0821预处理THP-1细胞。为检测rTp0821在不同时间对促炎细胞因子表达水平的影响,用1.0 μg/mL rTp0821刺激THP-1细胞6、12、24和48 h。各实验组设置阳性对照(100 ng/mL LPS)、阴性对照(PBS)和空白对照(仅加入培养基),每组设3个平行孔。PBS冲洗上述THP-1细胞3次后以0.1% Triton X-100处理30 min,离心收集上清,按照ELISA试剂盒说明书测定其中IL-6、IL-8和IL-1β浓度。
1.2.3 rTp0821促炎作用的相关信号通路测定 为探讨MAPK与NF-κB是否参与Tp0821诱导THP-1细胞表达促炎细胞因子,分别以ERK1/2特异性抑制剂PD98059、JNK特异性抑制剂SP600125、p38特异性抑制剂SB203580和NF-κB的特异抑制剂BAY11-7082预处理THP-1细胞30 min,rTp0821刺激THP-1细胞24 h后,ELISA检测其分泌IL-6、IL-8和IL-1β浓度。
1.2.4 统计学方法 所有实验均重复3次。采用SPSS 15.0统计软件进行分析,实验数据以均数±标准差表示,均数之间比较采用t检验,P<0.05为差异具有统计学意义。
2 结 果
2.1 rTp0821的表达、纯化与鉴定tp0821基因PCR扩增产物电泳显示在800 bp左右大小处存在一条特异性条带(图1),与预期片段的大小(807 bp)相符。测序结果与GenBank公布结果完全一致。pET-28a/Tp0821在E.coli BL21表达34 kD大小的蛋白,与预期蛋白分子量一致(图2)。Western blot鉴定结果显示其与His单抗和梅毒血清反应(图3),表明该蛋白为Tp0821。
2.2 rTp0821刺激THP-1细胞表达IL-6、IL-8和IL-1β rTp0821诱导THP-1细胞分泌促炎细胞因子IL-6、IL-8和IL-1β在一定范围内与刺激时间和蛋白浓度呈正相关:低于1 μg/mL时,IL-6、IL-8和IL-1β的水平随刺激蛋白浓度增加而增加,1 μg/mL时达到峰值,分别为166.0±16.9 pg/mL、145.3±10.7 pg/mL和118.2±16.3 pg/mL(图4A),随后随浓度增加而表达下降;1 μg/mL rTp0821刺激THP-1细胞时,IL-6、IL-8和IL-1β表达水平在24 h内随刺激时间增加而增加,24 h时均达到峰值,分别为177.8±8.8 pg/mL、147.4±7.6 pg/mL和118.3±7.0 pg/mL(图4B),随后随刺激时间延长而表达下降。

图1 pET-28a/Tp0821菌液PCR鉴定 M:DNA marker;1,2:pET-28a/Tp0821重组质粒的扩增产物
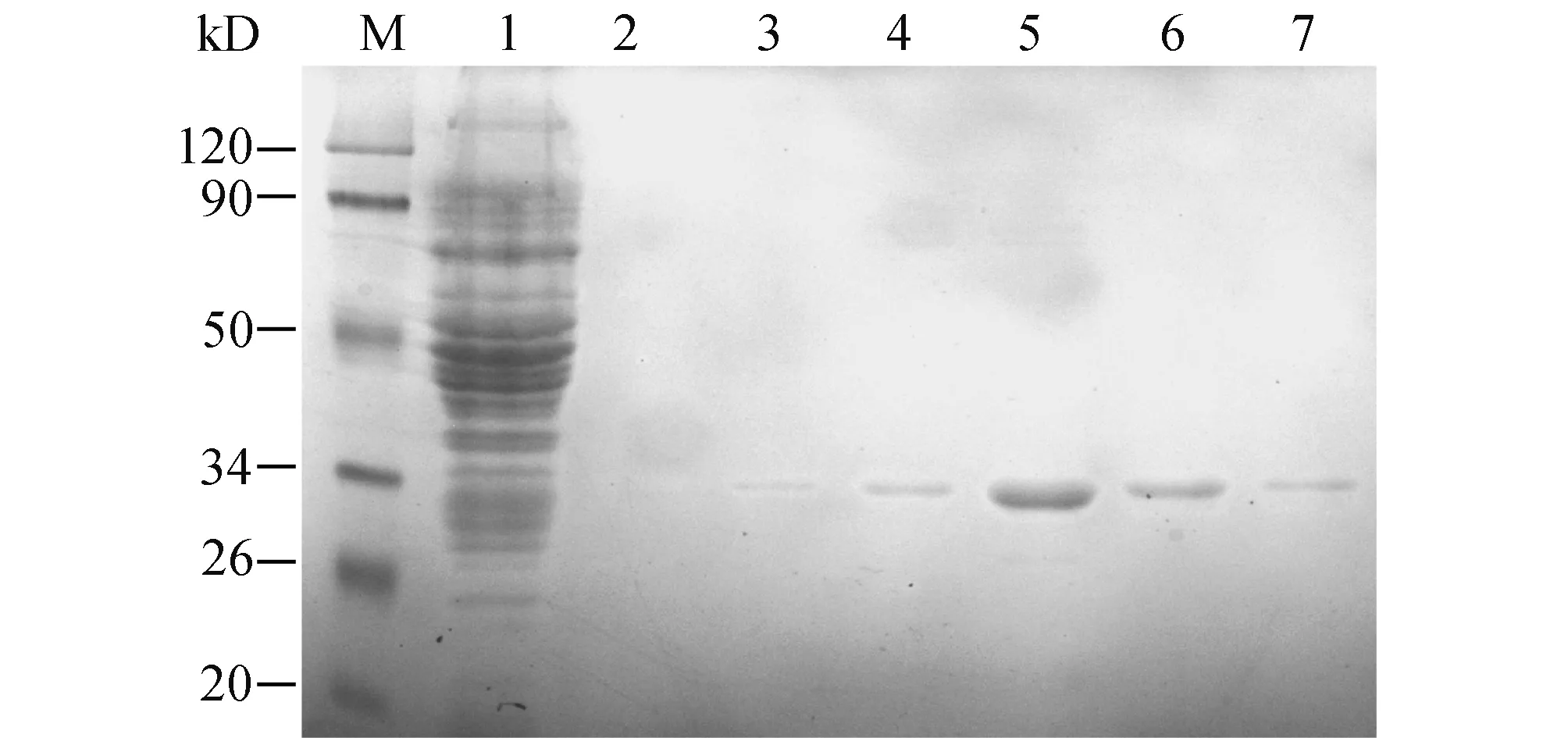
图2 rTp0821的纯化 M:Protein marker;1:流出液;2~7:不同咪唑浓度洗脱液洗脱的rTp0821

图3 rTp0821 Western blot鉴定 C:对照正常人血清;1:Anti-His 单抗;2:梅毒患者血清
2.3 PD98059、SP600125、SB203580和BAY11-7082抑制rTp0821诱导THP-1细胞表达IL-6、IL-8和IL-1β rTp0821刺激经PD98059、SP600125、SB203580以及BAY11-7082预处理后的THP-1细胞,IL-6表达水平分别下降63.4%(P<0.001)、4.3%(P>0.05)、53.4%(P<0.001)和73.1%(P<0.0001),IL-8分别下降49.2%(P<0.001)、6.0%(P>0.05)、41.1%(P<0.001)和71.0%(P<0.001),IL-1β分别下降36.8%(P<0.01)、3.9%(P>0.05)、30.3%(P<0.001)和59.7%(P<0.001)(图5)。以上表明PD98059、SB203580和BAY11-7082能显著抑制rTp0821刺激THP-1细胞表达促炎细胞因子IL-6、IL-8和IL-1β,JNK特异性抑制剂SP600125则无明显影响。
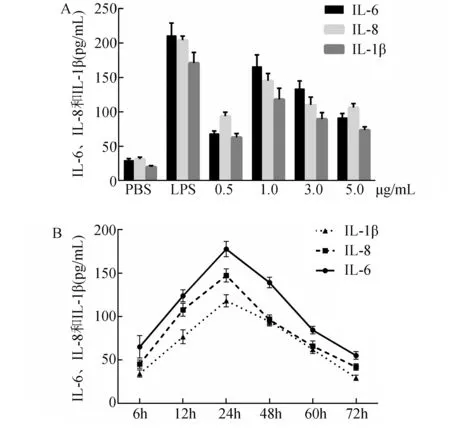
图4 不同浓度rTp821 (A)和不同刺激时间(B)对THP-1细胞表达促炎细胞因子的影响 PBS为阴性对照,LPS为阳性对照
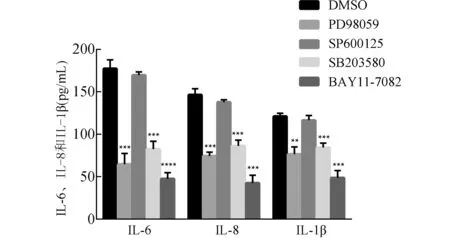
图5 MAPK和NF-κB特异抑制剂对rTp0821诱导THP-1细胞表达促炎细胞因子的影响 与对照组比较,*:P<0.05;**:P<0.01,***:P<0.001,****:P<0.0001
3 讨 论
前期研究表明,Tp膜脂蛋白Tp0663[6]和Tp0751[3]均可诱导THP-1细胞表达促炎细胞因子,与Tp致炎有关。Tp0821也是一种膜脂蛋白,但是否具有促炎活性尚不明确。本研究选择THP-1细胞作为模式细胞主要是由于THP-1细胞比小鼠巨噬细胞对刺激物更敏感,也更接近人体细胞的生理状态,而且其作为巨噬细胞的前体,在抵抗感染的过程中起着不可替代的作用。IL-6、IL-8和IL-1β是启动炎症反应的关键细胞因子,参与介导机体的免疫调控。本研究结果表明Tp0821诱导THP-1细胞表达促炎细胞因子水平在一定范围内与蛋白浓度和刺激时间呈正相关。当1.0 μg/mL Tp0821刺激THP-1细胞24 h时,促炎细胞因子表达水平达到峰值。这可能是由于过高浓度Tp0821和过长刺激时间会干扰THP-1细胞正常生物学功能,进而影响促炎细胞因子的表达。
MAPK由ERK1/2、JNK和p38等构成,是多种病原体活化单核/巨噬细胞的胞内信号转导中枢[7-8]。本研究发现,ERK1/2特异性抑制剂PD98059和p38异性抑制剂SB203580能抑制rTp0821诱导THP-1细胞表达促炎细胞因子,但JNK抑制剂SP600125预处理THP-1细胞后对促炎细胞因子表达却没有明显影响。这表明,ERK1/2和p38可能参与Tp0821介导THP-1细胞表达促炎细胞因子。
NF-κB是一种早期转录因子,参与调控多种促炎细胞因子的基因转录[9]。静息状态时,NF-κB通过与IκB结合成无活性的异二聚体而存在于胞浆[10-11]。当受到外来刺激时,IκB磷酸化后降解,游离的NF-κB随后转位至胞核与特异序列结合,进而发挥调控作用[12]。本研究发现,NF-κB特异性抑制剂BAY 11-7082预处理THP-1细胞30 min后,促炎细胞因子表达水平明显受到抑制,表明NF-κB可能参与rTp0821介导THP-1细胞所致炎症反应。
综上,本研究初步表明ERK1/2、p38和NF-κB参与rTp0821介导THP-1细胞表达促炎细胞因子,Tp0821可能为Tp潜在致病因子。
[1] Gerbase AC,Rowley JT,Heymann DH,et al.Global prevalence and incidence estimates of selected curable STDs[J].Sex Transm Infect,1998,74(Suppl 1):S12-16.
[2] Lafond RE,Lukehart SA.Biological basis for syphilis[J].Clin Microbiol Rev,2006,19(1):29-49.
[3] Liu S,Wang S,Wu Y,et al.Production of proinflammatory cytokines in the human THP-1 monocyte cell line following induction by Tp0751,a recombinant protein of Treponema pallidum[J].Sci China Life Sci,2010,53(2):229-233.
[4] Van Voorhis WC,Barrett LK,Lukehart SA,et al.Serodiagnosis of syphilis:antibodies to recombinant Tp0453,Tp92,and Gpd proteins are sensitive and specific indicators of infection by Treponema pallidum[J].J Clin Microbiol,2003,41(8):3668-3674.
[5] Xie Y,Xu M,Wang C,et al.Diagnostic value of recombinant Tp0821 protein in serodiagnosis for syphilis[J].Lett Appl Microbiol,2016,62(4):336-343.
[6] 刘小军,张跃军,吴移谋,等.梅毒螺旋体重组蛋白Tp0663前炎症活性的研究[J].中国现代医学杂志,2013,(28):15-19.
[7] Yang Y,Kim SC,Yu T,et al.Functional roles of p38 mitogen-activated protein kinase in macrophage-mediated inflammatory responses[J].Mediators Inflamm,2014,2014:352371.
[8] Gaestel M.MAPK-activated protein kinases (MKs):novel insights and challenges[J].Front Cell Dev Biol,2015,3:88.
[9] May MJ,Ghosh S.Signal transduction through NF-kappa B[J].Immunol Today,1998,19(2):80-88.
[10] Kaltschmidt B,Widera D,Kaltschmidt C.Signaling via NF-kappaB in the nervous system[J].Biochim Biophys Acta,2005,1745(3):287-299.
[11] Mitchell S,Vargas J,AUID- Oho,et al.Signaling via the NFkappaB system[J].Wiley Interdiscip Rev Syst Biol Med,2016,8(3):227-241.
[12] Christian F,Smith EL,Carmody RJ.The Regulation of NF-kappaB Subunits by Phosphorylation[J].Cells,2016,5(1).
ProinflammatoryEffectofTreponemaPallidumMembraneLipoproteinTp0821
WU Zhizhou,WEN Meizhen,KE Jianliang,et al
(DepartmentofClinicalLaboratory,JiangmenDermatologyHospital,Jiangmen,Guangdong529000,China)
ObjectiveTo investigate the proinflammatory effect ofTreponemapallidummembrane lipoprotein Tp0821 and related signal transduction pathways and provide experimental basis for the clarification of pathogenesis mechanisms of T.pallidum.MethodsThe recombinant protein Tp0821 (rTp0821) was expressed and the endotoxin in rTp0821 was removed.ELISA was used to detect the expression of proinflammatory cytokines IL-6,IL-8,and IL-1β of human THP-1 cells stimulated with rTp0821.Furthermore,rTp0821 was used to stimulate human THP-1 cells pretreated with the ERK1/2 inhibitor PD98059,p38 inhibitor SB203580,and NF-κB inhibitor BAY11-7082,respectively,and then ELISA was performed for detection of the expression level of proinflammatory cytokines.ResultsrTp0821 possesses the ability to induce THP-1 cells to secret IL-6,IL-8,and IL-1β in dose- and time-dependent manners.The expression level of proinflammatory cytokines peaked when THP-1 cells were stimulated with 1.0 μg/mL of rTp0821 for 24 hours.Moreover,when pretreated with PD98059,SP600125,SB203580,and BAY11-7082,respectively,THP-1 cells decreases expression of IL-6 by 63.4% (P<0.001),4.3% (P>0.05),53.4% (P<0.001),and 73.1% (P<0.0001),IL-8 by 49.2% (P<0.001)、6.0% (P>0.05)、41.1% (P<0.001),and 71.0% (P<0.001),IL-1β by 36.8% (P<0.01),3.9% (P>0.05),30.3% (P<0.001),and 59.7% (P<0.001),respectively.ConclusionThese data indicate that the rTp0821 may activate the THP-1 cells to produce the proinflammatory cytokines via ERK1/2,P38,and NF-κB signal transduction pathways and membrane lipoprotein Tp0821 might be an important pathogenic factor.
Treponemapallidum; membrane lipoprotein; Tp0821; proinflammatory cytokines; signal transduction pathways
10.15972/j.cnki.43-1509/r.2016.05.008
2016-07-03;
2016-08-28
R377.1
A
蒋湘莲)

