偏肿栓菌内生木霉菌株18-21抑菌效果研究
李 强, 李小林, 黄羽佳, 陈 诚, 黄文丽, 熊 川, 郑林用*
(1.四川省农业科学院 生物技术核技术研究所,四川 成都 610066;2.四川省农业科学院 土壤肥料研究所,四川 成都 610066;3.四川省技术创新促进会,四川 成都 610017)
偏肿栓菌内生木霉菌株18-21抑菌效果研究
李 强1, 李小林2, 黄羽佳3, 陈 诚1, 黄文丽1, 熊 川1, 郑林用1*
(1.四川省农业科学院 生物技术核技术研究所,四川 成都 610066;2.四川省农业科学院 土壤肥料研究所,四川 成都 610066;3.四川省技术创新促进会,四川 成都 610017)
为了筛选获得对植物根腐病及食用菌腐败等有效的生防菌,采用抑菌圈法和对峙培养法筛选生防菌株,通过形态学和16S rDNA分子鉴定确定生防菌分类地位。从1株野生偏肿栓菌Trametesgibbosa子实体中分离获得1株具有抑菌效果的生防菌,代号为18-21。筛选获得的这株生防菌对植物根腐病及食用菌腐败病原菌腐皮镰刀菌(Fusariumsolani)、三线镰刀菌(Fusariumtricinctum)的抑制率分别为56.7%、65.8%,并对铜绿假单胞菌(Pseudomonasaeruginosa)、枯草芽胞杆菌(Bacillussubtilis)、侧芽胞杆菌(Bacilluslatersprorus)、表皮葡萄球菌(Staphylococcusepidermidis)等病原细菌均具有显著的抑菌效果,通过形态学和分子生物学分类鉴定,确定为渐绿木霉(Trichodermaviridescens)。研究结果拓宽了生防菌的分离材料来源,丰富了生防资源,具有很大的应用潜力。
偏肿栓菌;内生菌;生物防治;抑菌;镰刀菌
目前化学杀菌剂是常用的植物病害防治方法,但长期使用会使许多病原菌产生抗药性,降低防病效果,频繁、高浓度地使用会污染环境,超标的残毒还会威胁人类健康,限制了我国果蔬等农产品的出口创汇,影响农业的可持续发展,破坏生态平衡[1-2]。生物防治作为一种有前途的替代手段在世界范围内得到认可,因此,大力开展生物防治研究对于农业可持续发展非常必要而又十分迫切[3-7]。内生真菌是一个多样性丰富的生物类群,在生物防治方面有着重要的开发利用价值。植物内生菌是筛选生防菌株的主要来源,目前,已筛选出多种能有效抵抗植物病原菌的生防菌株,并制成了多种生防制剂[8-10]。但尚未有学者从大型真菌中筛选具有生防潜力的菌株。很多大型真菌可产生多种生物活性物质,具有抑菌、抗癌、抗氧化等多种生物学功效[11-13]。这其中一部分可能是大型真菌自身代谢产生的活性物质,但也可能有内生菌的参与。因此从大型真菌子实体中筛选出具有抑菌等生物活性的菌株,是一个创新的尝试,可以拓宽生防菌株的分离材料来源,具有一定的研究潜力。偏肿栓菌Trametesgibbosa(Pers. : Fr.) Fr.是木生食用菌段木栽培的重要害菌之一,属木腐菌,引起木材海绵状白色腐朽。生于柞、榆、椴等树木的枯木、倒木、木桩上。子实体中等至大,一年生,木栓质,无柄,侧生、单生或叠生,菌盖多为半圆形、扁平。目前对偏肿栓菌的研究较少,尚未有人对其内生菌群开展研究。本研究以采集的野生偏肿栓菌为材料,从其子实体中分离内生真菌,并筛选出对病原真菌三线镰刀菌、腐皮镰刀菌,病原细菌铜绿假单胞菌、枯草芽胞杆菌、侧芽胞杆菌、表皮葡萄球菌具有抑制作用的真菌,进行鉴定,并分析其系统发育地位。
1 材料与方法
1.1 材料
1.1.1 供试菌株 偏肿栓菌于2014年7月采自四川德昌县(E 102°07′21″,N 27°23′48″,2 490 m)一株榆树的枯木上,子实体用无菌袋封装,冰盒保存,带回实验室4 ℃保藏,用于内生菌的分离。供试病原菌:三线镰刀菌、腐皮镰刀菌、铜绿假单胞菌、枯草芽胞杆菌、侧芽胞杆菌。上述菌株均由四川省农业科学院提供,标本保藏于四川省农业科学院生物技术核技术研究所。
1.1.2 供试培养基 内生真菌分离及病原真菌对峙培养基:PDA培养基(马铃薯200 g,葡萄糖 20 g,琼脂20 g、蒸馏水1 000 mL);病原细菌抑菌培养基LB培养基(胰化蛋白胨10 g,酵母提取物5 g,NaCl 10 g,蒸馏水1 000 mL)。
1.2 方法
1.2.1 偏肿栓菌子实体内生菌的分离与纯化 将采集的偏肿栓菌子实体用蒸馏水清洗干净,放置于超净台晾干。将晾干的偏肿栓菌子实体用75%的酒精浸泡1~3 min,再用3%次氯酸钠浸泡2 min,75%乙醇浸泡3 min。用无菌水冲洗3~4次,取最后一次清洗的无菌水100 μL涂布于 LB平板上,37 ℃倒置培养72 h,检测表面灭菌效果[14-15]。用无菌解剖刀剖开偏肿栓菌子实体,用无菌镊子取内部组织0.5 g,置于灭菌的研钵中,加入2 mL无菌水,将其捣碎,吸取研磨液,稀释平板涂布法涂布于分离培养基中,28 ℃倒置培养。划线分离法对菌株进一步纯化分离,斜面4 ℃保存,根据形态特征对内生菌进行初步鉴定。
1.2.2 生防菌株的筛选 ①病原真菌生防菌株的筛选(平板对峙法):将分离纯化的内生真菌与病原真菌分别通过打孔器(6 mm)取一小块菌丝组织接种于PDA平板两侧,只接种病原菌不接内生菌的平板做对照,设3次重复,28 ℃培养,分别在3、5、7 d测量病原菌和生防菌的菌落直径,对照病原菌的菌落直径记录生长状况,计算抑制率。抑制率的计算公式:抑制率(%)= ((对照病原菌菌落直径-处理病原菌菌落直径) / (对照病原菌菌落直径-0.6))×100%。②病原细菌生防菌株的筛选:分别吸取病原细菌的菌液200 μL涂布于LB平板,用打孔器取分离纯化的内生真菌菌丝组织块置于平板中央,30 ℃培养观察,7 d后测量抑菌圈直径大小。
1.2.3 生防菌株的分子鉴定 采用D3390-02 E.Z.N.A. TM Fungal DNA Kit(200)真菌DNA提取试剂盒(OMEGA)提取内生真菌基因组DNA。真菌ITS序列扩增采用通用引物:ITS4 (5′-TCCTCCGCTTATTGATATGC-3′)和ITS5 (5′-GGAAGTAAAAGTCGTAACAAGG-3′)[16],PCR采用50 μL反应体系,其中2×TaqPCR Master Mix 25 μL, 10 μmol/L的引物各1 μL,DNA模板1 μL,ddH2O补齐至50 μL。PCR反应程序:95 ℃变性5 min,94 ℃变性1 min,54 ℃退火1 min,72 ℃延伸1 min,35个循环,然后72 ℃延伸10 min。PCR产物用1%的琼脂糖凝胶电泳检测,将目的条带纯化后送上海生工生物技术公司测序。序列提交GenBank数据库(http: / /www. ncbi. nlm. nih. gov),用 Blast 软件在GenBank网站上进行相似性搜索,获取相近典型菌株的ITS基因序列,用CLUSTAL-X进行多重序列比对。
1.2.4 分子系统发育分析 采用 BLAST 和 DNAMAN 序列分析软件对测序结果进行序列一致性分析,在GenBank中搜索同源序列,调出相关菌株的ITS序列片段,利用MEGA5进行多序列比对,用Neighbor-Joining法,Maximum Composite Likelihood模型构建系统进化发育树,Bootstrap(1 000 次) 重复检验。
2 结果与分析
2.1 偏肿栓菌内生真菌分离
取最后一次清洗的无菌水100 μL涂布于 LB平板,37 ℃倒置培养72 h,未发现菌落长出,表明表面消毒成功,从偏肿栓菌子实体内部组织中分离的菌株可判定为偏肿栓菌的内生菌,共分离出5株内生真菌,用于生防菌株的筛选。
2.2 病原真菌生防效果
从分离纯化到的内生真菌中,筛选出1株具有病原真菌抑菌效果的菌株18-21,该菌株对植物根腐病及松茸等食用菌病原菌三线镰刀菌及腐皮镰刀菌都有良好的抑菌效果(图1)。由图1可知,腐皮镰刀菌与菌株18-21在平板中央形成了一条明显的抑制带,腐皮镰刀菌菌落呈白色,绒毛状,菌落突起,边缘为全缘,未见孢子产生;而菌株18-21菌落呈白色,绒毛状,两者菌落边缘接触后,渐渐形成一条高低错落的抑制带,此后,两者的菌落均无法继续扩散或覆盖对方菌落,7 d的抑制率为56.7%。同时,三线镰刀菌与菌株18-21也形成了一条1~2 cm的抑制带,并且在两者菌落接触边缘有黄色色素产生,可能有拮抗物质产生。7 d的抑制率为65.8%,并且三线镰刀菌在对峙培养过程中菌落有衰退的迹象,证明18-21对该菌的抑菌效果良好。
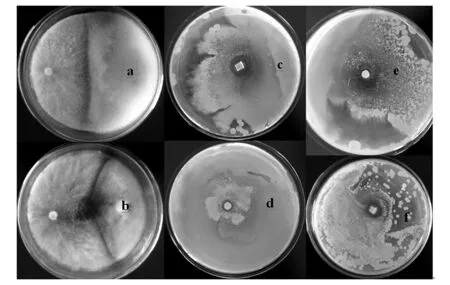
图1 拮抗菌18-21的抑菌效果Fig.1 The inhibition effect of strain 18-21 against
2.3 病原细菌生防效果
分离纯化到的内生真菌18-21对病原细菌同样具有明显的抑菌效果。将6 mm的菌丝培养块接种到涂满病原细菌的LB平板中央,观察发现,会形成一定直径的抑菌圈。其中对铜绿假单胞菌的抑菌效果最为明显,抑菌圈直径达到(1.68±0.15) cm; 对表皮葡萄球菌的抑菌直径达到(1.45±0.05) cm; 对枯草芽胞杆菌的抑菌直径达到(1.18±0.09) cm;对侧芽胞杆菌的抑菌直径达到(0.78±0.10) cm(见表1)。
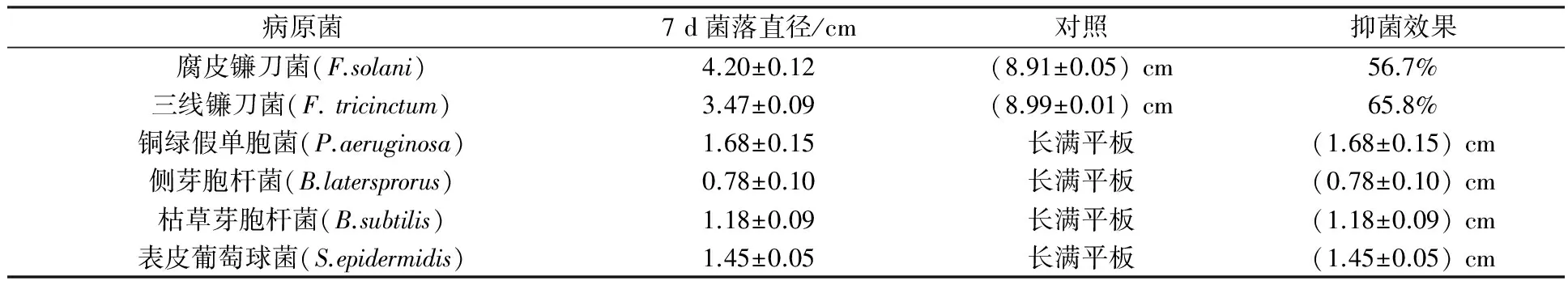
表1 拮抗菌18-21的抑菌效果
2.4 生防菌株的鉴定及系统发育
提取具有一定生防效果的菌株18-21的菌丝体DNA,扩增后序列通过BLAST比对,其与菌株Hypocreaviridescenswxm60(HM051062)的相似度100%,可确定为渐绿木霉(Trichodermaviridescens)的有性世代。查找到相关菌株同源序列,并构建了系统发育树(图2)。确定了该菌株属于木霉种群,进一步丰富了木霉生防资源。
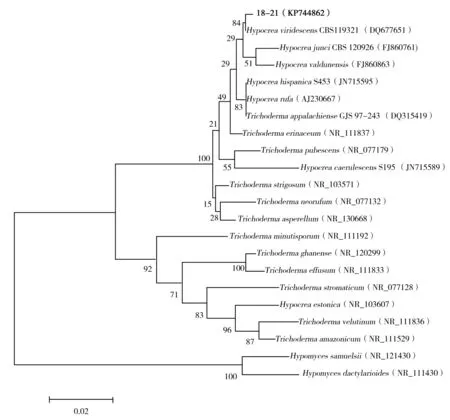
图2 根据菌株18-21及其相关菌株的ITS序列构建的系统发育树Fig.2 Phylogenetic tree constructed by the Neighbor-Joining approach based on the ITS gene of strain 18-21 and related strains
3 讨 论
大量研究证明,内生菌可以在寄主生长发育过程中发挥重要作用,如促生、抑菌等,甚至影响寄主的产量与品质[17-18]。同时,由于与寄主长期协同进化,内生菌已经成为提取生物活性物质的重要来源[19-21]。但目前对内生菌的研究主要集中于植物方面,对大型真菌的内生菌研究则鲜有报道。很多大型真菌具有多种生物活性功能,从中分离出具有特殊功效的微生物,拓宽了功能微生物的分离材料来源,具有一定的研究潜力,同时也对实现珍贵野生食用菌驯化栽培具有一定意义。
本研究从偏肿栓菌子实体中分离出1株具有广谱抗菌能力的菌株18-21。该菌株对植物及食用菌病原真菌三线镰刀菌、腐皮镰刀菌和多种病原细菌都具有一定的抑制作用。腐皮镰刀菌及三线镰刀菌是多种植物及动物的病原真菌,可引起植物根腐病、动物角膜炎等病症,同时还能导致松茸、块菌等野生及栽培食药用菌腐败,对农业生产危害极大[22]。本研究分离的生防菌株18-21,对这两种病原真菌的抑菌效果甚至优于部分经常被用作生防的菌株,显示出该菌株具有良好的应用潜力。同时,由于该木霉菌株是从大型真菌中分离,与其他食用菌有相似的代谢环境,因此将其应用于食用菌栽培中,用来防治食用菌的病原菌,具有良好的前景。
木霉菌是一个重要微生物种群,该种群具有较强的生命力。被广泛用作生防菌株,并应用于生物防治[23]。但以往对木霉生防潜力的研究,往往集中于哈茨木霉、绿色木霉、康氏木霉、钩状木霉、长枝木霉5种[24],很少有关于渐绿木霉生防潜力的报道。本研究分离的渐绿木霉18-21具有高效的生防潜力,拓宽了生防菌株的选择范围,进一步增强了对木霉生防潜力的认识。而且研究发现,该菌株在拮抗时会产生1~2 cm的抑菌带,并且产生一些色素,这可能是对峙过程中木霉菌株产生了抑制病原菌生长的代谢产物,也可能是木霉菌株改变病原菌的代谢途径或代谢方式。关于其抑菌机理及抑菌化合物,有待进一步研究。
[1] 刘佳,张建垒,王祥红,等. 海洋生防酵母菌的筛选及对果实采后病害的防治[J]. 食品科学, 2011, 32(S1): 39-43.
[2] 孙宏伟, 元野, 杨晓敏, 等. 烟草野火病拮抗生防菌的筛选、鉴定与应用[J]. 烟草科技, 2012,(8): 84-88.
[3] 王光华, Jos M.Raaijmakers. 生防细菌产生的拮抗物质及其在生物防治中的作用[J]. 应用生态学报, 2004, 15(6): 1100-1104.
[4] 王靖, 郭岩彬, 王建辉, 等. 葡萄根癌生防菌株E26生防效果的离体检测方法研究[J]. 中国农业科学, 2007,40(7): 1395-4102.
[5] 葛慈斌, 肖荣凤, 曹宜,等. 生防菌ANTI-8098A对青枯雷尔氏菌的抑菌特性[J]. 中国生物防治, 2009, 25(4): 316-321.
[6] 魏彩燕,毛雪琴,柴荣耀,等. 草莓炭疽病生防菌株MT-06 的鉴定及生物学特性[J]. 菌物学报, 2010, 9(4): 481-487.
[7] 许秀兰, 黄晓丽, 张翅, 等. 云杉内生优势毛壳菌的筛选及其生防机制研究[J]. 中国生物防治学报, 2014, 30(4): 511-519.
[8] 文才艺,吴元华,田秀玲. 植物内生菌研究进展及其存在的问题[J]. 生态学杂志,2004, 23(2): 86-91.
[9] 汪军, 黄俊生. 植物内生菌研究技术及应用研究进展[J]. 广西热带农业, 2008, (5): 18-20.
[10]史应武, 娄恺, 李春. 植物内生菌在生物防治中的应用[J]. 微生物学杂志, 2009, 29(6): 61-64.
[11]Ding X, Tang J, Cao M. Structure elucidation and antioxidant activity of a novel polysaccharide isolated fromTricholomamatsutake[J]. IntJBiolMacromol, 2010, 47(2): 271-275.
[12]Yin XL, You QH, Jiang ZH. Immunomodulatory activities of different solvent extracts fromTricholomamatsutake(S. Ito et S. Imai) singer (higher basidiomycetes) on normal mice[J]. Int J Med Mushrooms, 2012, 14(6): 549-556.
[13]Chen XQ, Wang QQ, Li JM. Comparison of simultaneous distillation and extraction, static headspace and headspace-solid phase microextraction coupled with GC/MS to measure the flavour components ofTricholomamatsutake[J]. Asian J Chem,2013, 25(11): 6059-6063.
[14]张雪兵, 史应武, 王晓霞, 等. 醉马草内生菌的分离、鉴定及杀虫效果[J]. 微生物学报, 2010, 50(4): 530-536.
[15]李强, 李小林, 黄文丽, 等. 四川松茸内生细菌群落结构与多样性[J]. 应用生态学报, 2014, 25(11): 3316-3322.
[16]刘春来, 文景芝, 杨明秀, 等. rDNA-ITS在植物病原真菌分子检测中的应用[J]. 东北农业大学学报, 2007, 38(1): 101-107.
[17]张国霞, 茅庆, 何忠义, 等. 陵水普通野生稻 (Oryzarufipogon)内生菌的固氮及溶磷特性[J]. 应用与环境生物学报, 2006, 12(4): 457-460.
[18]雍彬, 张超, 马沁沁, 等. 华重楼内生菌Iun35的分离及其抗菌蛋白的性质[J]. 应用与环境生物学报, 2011, 13(4): 537-540.
[19]田新莉, 曹理想, 杨国武, 等. 水稻内生放线菌类群及其对宿主病原菌的抗性研究[J]. 微生物学报, 2004, 44(5): 641-646.
[20]王秀呈, 曹艳花, 唐雪, 等. 水稻内生固氮菌HerbaspirillumseropedicaeDX35的筛选及其促生特性[J]. 微生物学报, 2014, 54(3): 292-298.
[21]杨本寿, 苗翠苹, 张建华, 等. 飞龙斩血内生菌种群分布及抑菌活性检测[J]. 微生物学报, 2014, 54(3): 276-284.
[22]鲁占魁, 王国珍, 张丽荣, 等.枸杞根腐病的发生及防治研究[J]. 植物保护学报, 1994, 21(3): 249-254.
[23]张广志,杨合同,张新建,等. 木霉现有种类名录[J]. 菌物学报,2014, 33(6): 1210-1230.
[24]田娜, 姚瑞丽, 张作刚, 等. 生防木霉菌的分离和筛选[J]. 山西农业大学学报(自然科学版), 2013, 33(4): 313-318.
Biocontrol Effect of Trichoderma viridescens Strain 18-21 Screened from Fruiting Bodies of Trametes gibbosa
LI Qiang1, LI Xiao-lin2, HUANG Yu-jia3, CHEN Cheng1,HUANG Wen-li1, XIONG Chuan1, ZHENG Lin-yong1
(1.Inst.ofSoil&Fert.., 2.Inst.ofBiol. &NuclearTechnol.,SichuanAcad.ofAgric.Sci.,Chengdu610066;3.Technol.Innov'nFound'nofSichuan,Chengdu610017)
In order to screen and obtain effective biocontrol microbes (BM) against plant root rot and rot of edible fungi, inhibition ring and confrontation culture methods were used to screen the BM. The classification site of the BM were identified according to the morphology characters and ITS sequence analysis.One BM isolated from wild fruiting bodies ofTrametesgibbosaand with the ability of inhibition the pathogen was obtained, coded name 18-21. The screened obtained BM had strong antagonism against plant root rot and edible fungi rot (FusariumsolaniandFusariumtricinctum) with inhibition rate at 56.7% and 65.8% respectively. It also had significant inhibition effects against pathogens likePseudomonasaeruginosa,Bacillussubtilis,Bacilluslatersprorus,Staphylococcusepidermidisetc. The strain was identified and classified asTrichodermaviridescensthrough morphology, molecular biology. The results of the study had widened the isolation material source of BM and enriched biocontrol resources, showing promising potential applications.
Trametesgibbosa; endophytes; biocontrol; inhibition;Fusarium
四川省科技支撑计划项目(2013NZ0029,2014FZ0004)
李强 男,硕士研究生。主要从事资源微生物学研究。E-mail:leeq110@126.com
* 通讯作者。男,博士,研究员。主要从事食用菌学研究。E-mail:zly6559@126.com
2015-03-20;
2015-06-09
Q939.92
A
1005-7021(2016)01-0017-05
10.3969/j.issn.1005-7021.2016.01.004

