Fonsecaeamonophora多聚酮合酶基因的扩增及敲除载体的构建
肖星 张军民 冯姣 陈志文 陈春梅 何娅 贺丹 孙九峰 席丽艳
(1.中山大学孙逸仙纪念医院皮肤科,广州 510120;2.吉林大学基础医学院病原生物学系,吉林大学真菌研究中心·教育部人兽共患病重点实验室,长春 130021;3.广东省疾病预防控制中心,广州 510120)
·论著·
Fonsecaeamonophora多聚酮合酶基因的扩增及敲除载体的构建
肖星1张军民1冯姣1陈志文1陈春梅1何娅1贺丹2孙九峰3席丽艳1
(1.中山大学孙逸仙纪念医院皮肤科,广州 510120;2.吉林大学基础医学院病原生物学系,吉林大学真菌研究中心·教育部人兽共患病重点实验室,长春 130021;3.广东省疾病预防控制中心,广州 510120)
目的 扩增Fonsecaeamonophora中控制黑素合成的多聚酮合酶 (polyketide synthases,PKS)基因并测序,构建PKS基因敲除载体。方法 扩增PKS基因,根据测序结果设计引物,从Fonsecaeamonophora基因组DNA扩增PKS基因5’-同源臂和3’-同源臂,从质粒pBHt1中扩增潮霉素B抗性标记基因 (hyg),最后将各片段插入载体PDHt/sk中。结果 测序得到5 389 bp大小的PKS基因序列,构建了PKS基因的敲除载体,用酶切及测序等方法鉴定载体构建成功。结论 成功构建FonsecaeamonophoraPKS基因敲除载体,为研究PKS基因及黑素的生物学功能奠定了良好的基础。
Fonsecaeamonophora;多聚酮合酶基因;根癌农杆菌;载体构建
[Chin J Mycol,2016,11(2):70-74]
黑素是一类常见于微生物和动植物体内的非均质、高分子量、多功能、结构复杂的聚合体,具有带负电荷、疏水、不溶于酸和大部分有机溶剂等特点。黑素是真菌细胞壁的重要成分,具有吸收紫外线、抗氧化、抗溶菌酶、增强病原真菌表面的黏附性,抵御宿主吞噬细胞的吞噬,缓冲外界不良环境对细胞的伤害作用[1]。另外,一些研究表明,黑素具有免疫活性,与病原真菌致病关系密切,它能影响细胞因子的分泌,调节宿主免疫类型[2-3]。在真菌黑素的合成途径中,两种最重要的途径分别是1,8-二羟基萘 (DHN)途径和二羟苯基丙氨酸 (DOPA)途径,合成两种不同黑素,即DHN-黑素和DOPA-黑素。不同真菌合成黑素的途径不同,DHN-黑素主要见于子囊菌真菌,是着色霉菌属的重要特征[4-5]。多聚酮合酶 (polyketide synthases,PKS)是控制DHN-黑素合成的关键酶,故常被用作获得黑素合成缺陷株的突变靶位,从而研究黑素在病原真菌中的作用。
Fonsecaeamonophora是从多株裴氏着色霉 (Fonsecaeapedrosoi)菌株中发现的一种新种,被证实为我国南方地区着色芽生菌病 (Chromoblastomycosis,CBM)的主要致病菌[6-7]。研究证明,F.monophora能够抑制TH1和TH17型免疫反应,诱导宿主细胞向TH2型免疫转换,导致固有免疫的不足,感染慢性化[8]。在新生隐球菌感染的鼠模型中,无色素减毒株能更强的诱导T细胞介导的保护性反应,其TNF-α、IL-12、iNOS转录水平显著升高,用减毒株免疫过的小鼠再次注射野生株,其存活时间延长[9]。黑素为何导致宿主对F.monophora免疫反应差异,是否参与F.monophora和宿主的相互识别过程,是否与感染慢性化相关,尚不十分明确。本研究设计引物扩增F.monophoraPKS基因并测序,构建PKS基因的敲除载体,以期利用根癌农杆菌介导的遗传转化技术 (Agrobacteriumtumefaciens-mediated transformation,ATMT)获得PKS基因缺陷株,为研究F.monophoraPKS基因及黑素的生物学功能奠定基础。
1 材料和方法
1.1 材料
F.monophora是本实验室鉴定并保存的特有的分生孢子变异株CBS122845 (SUMS0505),于2009年分离自一位81岁男性患者皮损。质粒PDHt/sk由北大医院李若瑜实验组馈赠。pBHt1双元载体质粒提供潮霉素B抗性标记基因 (hyg),由吉林大学白求恩医学院王丽教授馈赠。In-fusion®HD Cloning Kit (美国Clontech公司);Q5®High-Fidelity DNA Polymerase (美国NEB公司)。Pfu DNA Polymerase、切胶回收试剂盒、质粒提取试剂盒、D2000 DNA Marker、1kb DNA Marker、TOP10感受态细胞 (北京天根生化科技有限公司)。PrimerSTAR Max DNA Polymerase、dNTPs (2.5 mmol/L )、HindⅢ限制性内切酶 (大连宝生物工程有限公司)。PCR仪 (美国伯乐BIO-RAD公司)。扩增F.monophoraPKS基因及敲除PKS基因的相关引物如表1所示。所有引物合成 (PAGE纯化方式)及测序工作由上海生工生物工程技术服务有限公司完成。
1.2 方法
F.monophora基因组的抽提 将F.monophora接种于PDA斜面培养基上,28℃培养7 d,刮取适量菌,液氮研磨后,采用酚/氯仿抽提法提取基因组DNA。
确定F.monophoraPKS基因序列并设计引物 在前期的研究中,通过对F.monophora转录组的测序,获得了PKS基因的cDNA全长序列。并在NCBI上的BLAST (http://blast.ncbi.nlm.nih.gov/Blast.cgi)对cDNA序列进行比对,经过同源性分析,根据与同源基因的比较,获得了5 326 bp大小的PKS基因序列,用primer primer 5.0 (PP5)软件针对PKS基因设计引物F1、F2 (见表1)。

表1 引物序列
注:15 bp的同源序列用小写字母表示
扩增PKS基因 因PKS基因片段总长5 300 bp左右,为大片段,普通的Taq酶难以满足要求,兼测序需要高保真性,因此本实验采用了保真性能高的Q5®High-Fidelity DNA Polymerase。PCR反应体系:模板DNA 1 μL,5×Q5反应缓冲液10 μL,dNTPs (2.5 mmol/L )4 μL,Q5®High-Fidelity DNA Polymerase 0.5 μL,5×Q5 High GC Enhancer (GC≥65%时可选)10 μL,引物1 (10 μmol/L)2.5 μL,引物2 (10 μmol/L)2.5 μL,加水补齐至50 μL。扩增程序为:98℃预变性30 s;98℃变性8 s,56℃退火20 s,72℃延伸3 min,35个循环,最后72℃延伸2 min。电泳,利用切胶回收试剂盒回收目的片段,送测序。
设计引物扩增同源序列及抗性标记基因 采用传统的同源重组方法设计F.monophoraPKS基因根癌农杆菌敲除载体,即在潮霉素抗性标记基因的两端分别连接F.monophoraPKS基因的5’-同源臂和3’-同源臂。In-fusion技术的原理是在扩增目的片段的过程中由引物5’添加待连接片段的15 bp同源序列,从而实现任意片段融合。根据引物设计的一般原理和In-fusion引物15 bp同源序列添加原理,分别设计待敲除区域的5’-同源臂 (1 303 bp)和3’-同源臂 (1 331 bp)引物,即引物对F3/F4和F7/F8 (见表1);同理设计引物扩增潮霉素抗性标记基因,即引物对F5/F6 (见表1)。各引物的5’端为待连接片段的15 bp同源序列。
获取目的片段及线性化载体 选取Q5®High-Fidelity DNA Polymerase扩增各目的片段。PCR反应体系:模板DNA (F.monophora基因组DNA、pBHt1质粒)1 μL,5×Q5反应缓冲液10 μL,dNTPs (2.5 mmol/L)4 μL,Q5高保真DNA聚合酶0.5 μL,5×Q5 High GC Enhancer (GC≥65%时可选)10 μL,引物1 (10 μmol/L)2.5 μL,引物2 (10 μmol/L)2.5 μL,加水补齐至50 μL。扩增程序为:98℃预变性30 s;98℃变性8 s,56℃退火20 s,72℃延伸1 min,35个循环,最后72℃延伸2 min。电泳,回收目的条带。酶切体系:10×QC Green Buffer 5 μL,PDHt/sk质粒3 μL (1 000 ng/μL),HindⅢ 1 μL,加水补齐至50 μL。反应条件为:37℃,5 min。电泳,回收目的条带。
多个片段载体构建 依照回收目的片段的浓度,各目的片段分别加1 μL,线性化载体加3 μL,5×In-Fusion HD Enzyme Premix加2 μL,ddH2O补齐至10 μL。50℃反应15 min后,取连接产物5 μL用于转化50 μL的大肠杆菌 (TOP10),经菌液PCR及测序获得目的克隆。
重组质粒酶切验证 挑取测序正确的单克隆,200 r/min培养过夜,用质粒提取试剂盒提取质粒,采用ApaⅠ单切,BamHⅠ单切,KpnⅠ单切,BamHⅠ和KpnⅠ双切,ApaⅠ和BamHⅠ双切验证。酶切体系:10×QC Green Buffer 5 μL,重组质粒3 μL (1 000 ng/μL),酶1 μL,加水补齐至50 μL。反应条件为:37℃,5 min。电泳检测酶切结果。
2 结 果
2.1F.monphoraPKS基因片段扩增及测序结果
本实验选取PrimerSTAR Max DNA Polymerase、Pfu DNA Polymerase、Q5®High-Fidelity DNA Polymerase三种高保真酶扩增PKS基因,电泳结果显示仅Q5®High-Fidelity DNA Polymerase获得目的片段,长度约为5 300 bp (见图1)。通过分析测序结果,获得了5 389 bp大小的F.monophoraPKS基因序列。
2.2 目的片段扩增结果
以F.monophora基因组DNA为模板,表1中的F3/F4引物,扩增PKS基因5’端1 303 bp的DNA片段,F7/F8引物,扩增PKS基因3’端的1 331 bp的DNA片段,以pBHt1为模板,F5/F6引物,扩增潮霉素抗性标记基因共1 601 bp (见图2)。
2.3 目的片段与载体连接、转化结果
混合克隆片段按1.2中“设计引物扩增同源序列及抗性标记基因”的条件进行连接,即得到敲除载体 (见图3),产物转化大肠杆菌 (Top10),取200 μL涂布于含50 mg/mL卡那霉素的固体LB培养基上,37℃倒置培养16 h后,观察菌落 (见图4)。挑取克隆,37℃,200 r/min培养2 h,用F3、F4引物进行菌液验证,选取阳性克隆菌株酶切验证,送测序。
2.4 重组质粒的酶切验证及测序结果
ApaⅠ、BamHⅠ和KpnⅠ为单切位点,片段大小为11 718 bp,BamHⅠ和KpnⅠ双切应该切下4 307 bp大小的目的条带,ApaⅠ和BamHⅠ双切应该切下4 301 bp大小的目的条带 (见图5)。选取酶切结果正确的质粒和引物对F1/F2,送上海生工生物工程技术服务有限公司双向测通插入片段 (4 253 bp),并与目的序列通过Vector NTI (Invitrogen公司,美国)软件进行比对,结果与目的序列100%相同。
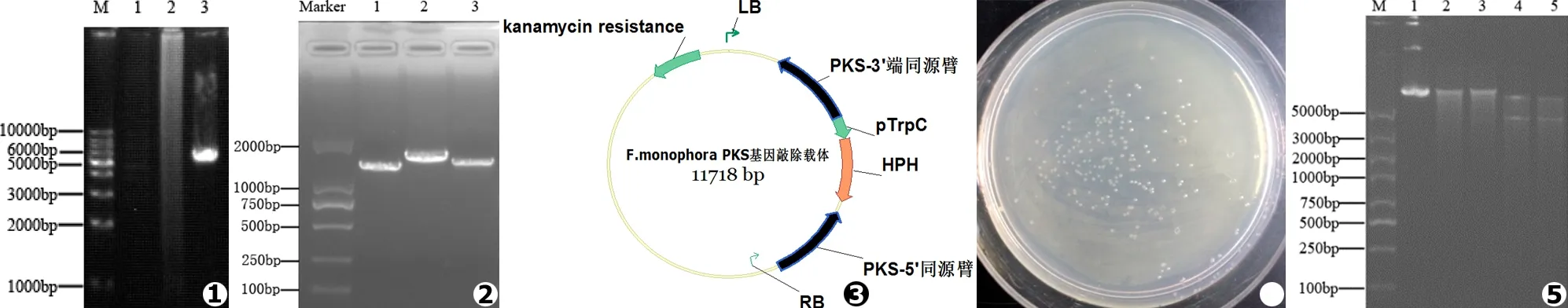
图1 PKS基因PCR扩增结果 (Marker.1 kb DNA Marker,1.PrimerSTAR Max DNA Polymerase PCR结果,2.Pfu DNA Polymerase PCR结果,3.Q5®High-Fidelity DNA Polymerase PCR结果) 图2 目的片段PCR扩增结果 (Marker.D2000 DNA Marker,1.PKS上游序列片段,2.潮霉素B抗性基因片段,3.PKS下游序列片段) 图3 PKS基因敲除载体图谱 图4 大肠杆菌转化结果 图5 重组质粒酶切验证结果 (M.D5000 DNA Marker,1.ApaⅠ酶切结果,2.BamHⅠ酶切结果,3.KpnⅠ酶切结果,4.BamHⅠ和KpnⅠ双酶切结果,5.ApaⅠ和BamHⅠ双酶切结果)
Fig.1 PCR results of PKS (Marker.1 kb DNA Marker,1.PCR result of PrimerSTAR Max DNA Polymerase,2.PCR result of Pfu DNA Polymerase,3.PCR result of Q5®High-Fidelity DNA Polymerase) Fig.2 PCR results of target fragment (Marker.D2000 DNA Marker,1.upstream of PKS fragment,2.hygromycin B resistance gene,3.downstream of PKS fragment) Fig.3 The picture of PKS knockout vector Fig.4 Result of escherichia coli transformation Fig.5 Results of recombinant plasmid verified by digestion (M.D5000 DNA Marker,1.Result ofApaⅠ digestion,2.Result ofBamHⅠ digestion,3.Result ofKpnⅠ digestion,4.Result ofBamHⅠ andKpnⅠ digestion,5.Result ofApaⅠ andBamHⅠ digestion)
3 讨 论
PKS基因编码的多聚酮合酶被认为是子囊菌真菌中DHN-黑素合成途径的限速酶。Feng B等[10]通过打断皮炎外瓶霉的PKS基因,成功获得了黑素缺陷株,此种缺陷株的毒力明显下降,且对中性粒细胞的抵抗能力减弱。Paolo WJ[11]的研究证实,PKS基因缺陷的皮炎外瓶霉细胞壁表面的高电子密度颗粒层出现缺失,且表现出对伏立康唑、两性霉素B等抗真菌药物的敏感性增强。由此可见,PKS基因在黑素合成过程中起至关重要的作用,而PKS基因缺陷的菌株不仅致病性降低,对多种抗真菌药物敏感性也有增强。
F.monophora是我国南方着色芽生菌病的主要病原体,但国内外并无针对F.monophora的PKS基因功能学的研究。在前期的实验中,我们通过对F.monophora基因转录组进行分析,发现产生大量黑素色素株CBS122845 (SUMS0505)与白化突变株CBS125149 (SUMS0510)间PKS基因表达差异明显 (数据未发表)。研究还发现色素株能够上调IL-10等TH2细胞因子,下调IL-12、TNF-α等TH1细胞因子,抑制巨噬细胞对其的炎症反应[12]。通过建立F.monophora与小鼠巨噬细胞共培养,发现色素株组与白化突变株组中巨噬细胞Dectin-1、TLR-2、TLR-4等受体表达存在差异[13]。为更深入地探讨为何色素株和白化突变株会导致宿主免疫反应的差异,黑素及PKS基因在其中起到的作用,本实验选取PKS基因为研究对象,以期阐明PKS基因的生物学功能。
根癌农杆菌介导的遗传转化技术被广泛应用于真菌基因功能的研究。目前,ATMT技术已成功运用于多种真菌,如烟曲霉[14]、土曲霉[15]、申克孢子丝菌[16]、马尔尼菲青霉[17]、尖孢镰刀菌[18]等。基因的敲除方法有插入法、同源重组法、基因沉默的RNAi和近几年兴起的Crispr/Cas9等方法,但是对于稳定敲除株的获取,传统的同源重组方法有无可替代的稳定性和优势。本研究获得了5 389 bp大小的F.monophoraPKS基因序列,且成功构建了由根癌农杆菌介导的PKS基因敲除载体,为研究F.monophora的PKS基因及黑素的生物学功能奠定了基础。
[1] 周真,杜妍娴,李希清.黑色素与常见病原真菌致病性的关系[J].中国真菌学杂志,2011(06):373-376.
[2] Da Silva MB,Marques AF,Nosanchuk JD,et al.Melanin in the dimorphic fungal pathogenParacoccidioidesbrasiliensis:effects on phagocytosis,intracellular resistance and drug susceptibility[J].Microbes Infect,2006,8(1):197-205.
[3] Nosanchuk JD,Casadevall A.Impact of melanin on microbial virulence and clinical resistance to antimicrobial compounds[J].Antimicrob Agents Chemother,2006,50(11):3519-3528.
[4] Cunha MM,Franzen AJ,Seabra SH,et al.Melanin inFonsecaeapedrosoi:a trap for oxidative radicals[J].BMC Microbiol,2010,10(16):80.
[5] Pal AK,Gajjar DU,Vasavada AR.DOPA and DHN pathway orchestrate melanin synthesis inAspergillusspecies[J].Med Mycol,2014,52(1):10-18.
[6] Queiroz-Telles F,Esterre P,Perez-Blanco M,et al.Chromoblastomycosis:an overview of clinical manifestations,diagnosis and treatment[J].Med Mycol,2009,47(1):3-15.
[7] Xi L,Sun J,Lu C,et al.Molecular diversity ofFonsecaea(Chaetothyriales) causing chromoblastomycosis in southern China[J].Med Mycol,2009,47(1):27-33.
[8] Wevers B A,Kaptein TM,Zijlstra-Willems E M,et al.Fungal engagement of the C-type lectin mincle suppresses dectin-1-induced antifungal immunity[J].Cell Host Microbe,2014,15(4):494-505.
[9] Barluzzi R,Brozzetti A,Mariucci G,et al.Establishment of protective immunity against cerebral cryptococcosis by means of an avirulent,non melanogenicCryptococcusneoformansstrain[J].J Neuroimmunol,2000,109(2):75-86.
[10] Feng B,Wang X,Hauser M,et al.Molecular cloning and characterization of WdPKS1,a gene involved in dihydroxynaphthalene melanin biosynthesis and virulence inWangiella(Exophiala)dermatitidis[J].Infect Immun,2001,69(3):1781-1794.
[11] Paolo WJ,Dadachova E,Mandal P,et al.Effects of disrupting the polyketide synthase gene WdPKS1 inWangiella[Exophiala]dermatitidison melanin production and resistance to killing by antifungal compounds,enzymatic degradation,and extremes in temperature[J].BMC Microbiol,2006,6:55.
[12] Zhang J,Wang L,Xi L,et al.Melanin in a meristematic mutant ofFonsecaeamonophorainhibits the production of nitric oxide and Th1 cytokines of murine macrophages[J].Mycopathologia,2013,175(5-6):515-522.
[13] 蒋丽,张军民,孙九峰,等.Fonsecaeamonophora对巨噬细胞TLR2、TLR4、Dectin-1和TNF-α表达的影响[J].中国真菌学杂志,2014,9(3):134-138.
[14] Sugui JA,Chang YC,Kwon-Chung KJ.Agrobacteriumtumefaciens-mediated transformation ofAspergillusfumigatus:an efficient tool for insertional mutagenesis and targeted gene disruption[J].Appl Environ Microbiol,2005,71(4):1798-1802.
[15] Wang D,He D,Li G,et al.An efficient tool for random insertional mutagenesis:Agrobacteriumtumefaciens-mediated transformation of the filamentous fungusAspergillusterreus[J].J Microbiol Methods,2014,98(13):114-118.
[16] Zhang Y,Li G,He D,et al.Efficient insertional mutagenesis system for the dimorphic pathogenic fungusSporothrixschenckiiusing Agrobacterium tumefaciens[J].J Microbiol Methods,2011,84(3):418-422.
[17] Kummasook A,Cooper CR,Vanittanakom N.An improvedAgrobacterium-mediated transformation system for the functional genetic analysis ofPenicilliummarneffei[J].Med Mycol,2010,48(8):1066-1074.
[18] Mullins ED,Chen X,Romaine P,et al.Agrobacterium-mediated transformation ofFusariumoxysporum:an efficient tool for insertional mutagenesis and gene transfer[J].Phytopathology,2001,91(2):173-180.
[本文编辑] 王 飞
The amplification and targeting vector construction of a polyketide synthases gene ofFonsecaeamonophora
XIAO Xing1,ZHANG Jun-min1,FENG Jiao1,CHEN Zhi-wen1,CHEN Chun-mei1,HE Ya1,HE Dan2,SUN Jiu-feng3,XI Li-yan1
(1.DepartmentofDermatology,SunYat-SenHospital,SunYat-SenUniversity,Guangzhou510120,China;2.DepartmentofPathogenobiology,JilinUniversityMycologyResearchCenter,CollegeofBasicMedicalSciences,JilinUniversity,Changchun130021,China;3.GuangdongProvincialCenterforDiseaseandPrevention,Guangzhou510120,China)
Objective To amplify and sequence a polyketide synthases gene ofFonsecaeamonophora,and to construct its targeting vector.Methods A polyketide synthases gene ofFonsecaeamonophorawas amplified and sequenced.Then we designed primers to amplify the 5’ and 3’ flanking region of PKS gene fromFonsecaeamonophoragenomic DNA,and the Hygromycin B resistance gene (hyg) from plasmid pBHt1.At last,all fragments were inserted into the vector PDHt/sk.Result The sequence of PKS gene was acquired,and its length was 5 389 bp.The targeting vector of PKS gene was constructed,and the vector was identified by restriction enzyme digestion and nucleotide sequencing.Conclusion This study acquired the targeting vector of PKS gene ofFonsecaeamonophorasuccessfully,and laid a good foundation for biological functions research of PKS gene and melanin.
Fonsecaeamonophora;polyketide synthases gene;Agrobacteriumtumefaciens;vector construction
国家自然科学基金 (81571970)
肖星,女 (汉族),硕士研究生在读.E-mail:136591052@qq.com
张军民,E-mail:junminmx@163.com
R 379.9
A
1673-3827(2016)11-0070-05
2015-12-22

