一种基于环介导等温扩增技术原理的组织胞浆菌分子诊断技术
李娟 陈敏 潘搏 雷文知 方文捷 刘加 洪南 李颖芳 廖万清 潘炜华
(上海市医学真菌分子生物学重点实验室 上海长征医院皮肤病与真菌病研究所全军皮肤病重点实验室 第二军医大学附属长征医院皮肤科,上海 200003)
·论著·
一种基于环介导等温扩增技术原理的组织胞浆菌分子诊断技术
李娟 陈敏 潘搏 雷文知 方文捷 刘加 洪南 李颖芳 廖万清 潘炜华
(上海市医学真菌分子生物学重点实验室 上海长征医院皮肤病与真菌病研究所全军皮肤病重点实验室 第二军医大学附属长征医院皮肤科,上海 200003)
目的 研发一种基于环介导等温扩增 (1oop-mediated isothermal amplification,LAMP)技术原理的组织胞浆菌感染的分子诊断技术。方法 以组织胞浆菌为研究对象,针对其种特异性的M抗原基因序列,设计并筛选数套基于LAMP技术的特异性引物,同时优化其反应条件,建立一种针对组织胞浆菌感染的快速分子鉴定技术。结果 该LAMP技术在65℃、90 min反应条件下,对组织胞浆菌基因组DNA的检测敏感度达到5.3 pg/反应 (即5.3×10-12g,约160个基因组DNA拷贝),且与其相近种属真菌无交叉反应。结论 我们研发的这种基于LAMP技术原理的组织胞浆菌分子诊断技术具有操作简便、特异性及敏感性高等优点,具有临床推广应用的潜力。
组织胞浆菌;环介导等温扩增技术;分子诊断;快速检测
[Chin J Mycol,2016,11(2):79-84]
组织胞浆菌病 (histoplasmosis,HP)是人类被荚膜组织胞浆菌 (Histoplasmacapsulatum)感染所引起的侵袭性真菌病。该病目前有全球性分布趋势,临床表现不典型,尤以进行性播散性组织胞浆菌病 (progressive disseminated histoplasmosis,PDH)最为危重,预后凶险[1-2]。荚膜组织胞浆菌属双相型真菌,目前的真菌分类学研究将其划分为3个变种:荚膜组织胞浆菌荚膜变种 (Histoplasmacapsulatumvar.capsulatum),又称美洲型荚膜组织胞浆菌;荚膜组织胞浆菌杜氏变种 (Histoplasmacapsulatumvar.duboisii),又称非洲型荚膜组织胞浆菌;马皮疽荚膜组织胞浆菌 (Histoplasmacapsulatumvar.farciminosum)[3]。累及人类导致侵袭性感染的主要是荚膜组织胞浆菌荚膜变种 (Histoplasmacapsulatumvar.capsulatum)与荚膜组织胞浆菌杜氏变种 (Histoplasmacapsulatumvar.duboisii)。以往的研究多认为该病是一种地方性真菌病,主要流行于美洲 (主要是北美大陆)[3],非洲及亚洲等地区偶见报道,欧洲较少见。但近30 a来,国内相关报道也呈上升趋势[4-5]。
目前,临床明确组织胞浆菌感染的诊断方法主要是培养和血清血试验,费时费力,且漏诊率较高,不能满足临床的实际需要。然而,组织胞浆菌病的临床预后与是否能早期明确诊断密切相关。因此,研发出快速、特异、易于操作的早期诊断方法,是临床工作的迫切需求。环介导等温扩增 (1oop-mediated isothermal amplification,LAMP)技术是一种新型的恒温核酸扩增技术[6],具有灵敏度高、反应时间短、操作简单等优点,已被成功应用于临床的HIV、禽流感、结核等疾病的快速分子检测。目前,该技术在病原真菌的分子检测研究领域则相对较少。因此,我们决定针对组织胞浆菌基因组DNA的M抗原基因,研发一种基于LAMP技术原理的组织胞浆菌感染的快速分子诊断的技术方法,为解决临床相关需求提供必要的工作基础及技术储备。
1 材料与方法
1.1 实验材料
菌株 选用组织胞浆菌标准菌株6株、实验室分离株2株,相关种属菌株14株,详见表1。菌株购于荷兰皇家科学与艺术研究院CBS真菌多样性研究中心 (Centraalbureau voor Schimmelcultures,CBS,Utrecht,The Netherlands)美国标准培养物集存中心 (American type culture collection,ATCC,Manassas,Virginia,U.S.A)及第二军医大学长征医院皮肤病真菌病研究所真菌库。

表1 LAMP特异性测试 (n=22)
注:P.Positive,阳性反应;N.Negative,阴性反应
培养基及试剂 基础培养基为沙保氏培养基 (SDA)、玉米培养基 (CMA)、脑心浸萃血培养基 (BHIB)、梅里埃双相培养基 (MLI)均购自生工生物工程 (上海)股份有限公司。Loopamp DNA amplification kit、Loopamp Fluorescence Detection Reagent购自日本荣研化学株式会社;TIANGEN 2×pfu PCR MasterMix高保真酶购自北京天根生物科技有限公司;DNA Marker (DL2000)购自上海宝生物工程有限公司 (TAKARA);真菌DNA抽提液:1 mL 1 mol/L Tris-HCl,4 mL 500 mmol/L EDTA,加ddH2O定容至10 mL。引物由生工生物工程 (上海)股份有限公司合成。
主要仪器和设备 Loopamp LA-320C实时浊度仪 (北京蓝谱生物科技有限公司),电泳仪 (国产TAN ETS 300),凝胶成像分析系统 (FR-980复日生物电泳图像分析系统),Eppendorf Biophotometer分光分度计。
1.2 试验方法
靶序列确定 经过序列分析,选定组织胞浆菌M抗原基因为靶序列,并从美国NCBI Genbank核酸数据库中 (http://www.ncbi.nlm.nih.gov/nuccore/)选取一株组织胞浆菌荚膜变种菌株相应靶基因序列。
引物设计 根据PrimerExplorer V4 LAMP引物设计程序软件 (http://primerexplorer.jp/elamp4.0.0/index.html)设计出M抗原对应的LAMP反应引物,根据适当筛选条件筛选适合的引物如表2。

表2 引物列表
LAMP反应体系 将设计出的引物分别与模板DNA (组织胞浆菌)按照LAMP反应体系加样,置于Loopamp LA-320C实时浊度仪中反应,预设反应温度为65℃,反应时间为90 min。LAMP反应体系如下:总体积25 μL,包括1 μL FIP (40 μmol/L)、1 μL BIP (40 μmol/L)、1 μL F3 (5 μmol/L)、1 μL B3 (5 μmol/L)、1 μL Loop primer F (20 μmol/L)、1 μL Loop primer B (20 μmol/L)、12.5 μL Buffer 2X、3.5 μL ddH2O、2 μL DNA sample,1 μL Bst DNA Polymerase。可见性反应为加入1 μL钙黄绿素-氯化锰 (Calcein-MnCl2)做指示剂在紫外线下可视化显示实验结果[7]。反应结束后观察引物反应扩增曲线,并对引物进行特异性和敏感性实验。
待验证菌株培养及全基因组DNA抽提 (1)菌株的复苏与培养:取出-20℃保藏的菌株,置于20℃下复苏24 h,使其恢复繁殖活力,转菌至预制培养基增殖培养。取菌株标本接种于MLI中,25℃培养,获单个菌落后转种SDA、CMA、BHIB各2份,分别于25℃和35℃培养。组织胞浆菌为双相型真菌,培养时间较长,通常需要2~6周。酵母相比霉菌相生长慢,且对培养基的营养要求高。(2)氯化苄法[8]抽提组织胞浆菌基因组DNA,并用分光分度计检测各菌株基因组DNA及其浓度。
特异性实验及LAMP可见性实验 (1)将设计好的M抗原引物分别与上述步骤已准备好的各菌株DNA按照LAMP体系,65℃,90 min进行反应,观察分别的扩增反应情况。设立组织胞浆菌作为阳性对照,双蒸水组作为阴性对照。(2)LAMP凝胶电泳检查:用HE120电泳仪提供的灌胶模具灌制12 cm×6 cm的1.4%琼脂糖凝胶,于LAMP管中取10 μL扩增产物分别与5 μL Ladder Buffer充分混合后上样于1.4%的琼脂凝胶,120 V电压电泳30 min后取出琼脂凝胶经FR-980复日生物电泳图像分析系统拍照。(3)LAMP可见性实验:配有指示剂的LAMP反应体系反应结束后,取出反应管观察各组颜色变化。
敏感性实验及LAMP可见性实验 (1)扩增曲线:将组织胞浆菌全基因组DNA浓度分别以十倍梯级稀释,使DNA含量分别为5.3×10-8g、5.3×10-9g、5.3×10-10g、5.3×10-11g、5.3×10-12g、5.3×10-13g、5.3×10-14g、0 g (ddH2O)。将上述不同浓度梯度的DNA 分别按照LAMP体系,65℃,90 min反应,结束后观察扩增情况。设立不含DNA组为阴性对照。(2)LAMP可见性实验:重复上述步骤,在配好各组LAMP反应体系后,在LAMP管中依次加入1 μL 钙黄绿素以指示实验结果。65℃ 90 min反应结束后,取出反应管观察各组颜色变化。
2 结 果
2.1 真菌培养
25℃呈菌丝相:SDA及CMA上约2周可形成直径3~4 mm的白色绒毛状菌落,背面棕色,不产生红色色素,未见其渗入培养基现象。35℃呈酵母相:BHIB及MLI上约4周可见直径3~4 mm的圆形、隆起、光滑、棕黄色菌落。
2.2 特异性结果
将筛选出的引物分别与各菌株DNA按照LAMP体系进行反应,观察分别的扩增反应情况。具体如表2所示。
菌株凝胶电泳结果如图1a所示。由此可知:基于组织胞浆菌M抗原序列设计的引物在LAMP反应体系具有良好的特异性,除了组织胞浆菌菌株均出现阳性结果外,其他菌株包括粗球孢子菌、申克孢子丝菌、马尔尼菲青霉菌、胶囊青霉菌、烟曲霉、雅致鳞质霉、锯形放线菌、絮状表皮癣菌、白念珠菌、新生隐球菌等均未出现扩增反应。初步验证了基于M抗原序列设计的LAMP引物具有较好的特异性。
LAMP反应后可见性实验,各管浊度表现结果见图1b。根据扩增反应结束后LAMP管浊度的变化可以初步判断是否发生了扩增,如发生扩增,则表示该反应管内含有目的基因,反之,如反应管清亮则表示无监测的目的基因,为未发生扩增反应。
2.3 敏感性结果
不同浓度梯度的DNA与引物反应后扩增曲线如图2所示。由图2a的扩增曲线可以看出,基于组织胞浆菌核糖体内基因间隔区M抗原序列的LAMP敏感程度可以达到5.3 pg (即10-12g)。
菌株凝胶电泳结果如图2b所示;不同浓度梯度的组织胞浆菌DNA可见性实验反应结果如图2c所示。
3 讨 论
组织胞浆菌可侵犯全身,最常累及肺,免疫缺陷患者表现为进行性播散性感染,死亡率超过90%[9],延误PDH的抗真菌治疗的死亡率在30%~42%[10-12]。该病临床易误诊为普通的病毒性或细菌性肺炎、马尔尼菲青霉菌病 (penicilliposis marneffei,PM)[13]。故临床常误诊为细菌性肺炎病例而予抗菌治疗;而马尔尼菲青霉菌也会导致致命的播散性感染,且在亚洲多见报道[14]。虽然组织胞浆菌素皮试有助于慢性患者的诊断,但免疫缺陷者常不出现反应,故该试验主要用于流行病调查。目前,以培养为代表的形态学诊断方法仍是临床上组织胞浆菌病诊断的金标准,但耗时长、阳性率低等缺陷并不能符合临床实际需求。因此,近年来以核酸检测为代表的非培养诊断技术逐渐成为国内外侵袭性真菌病早期诊断技术研究的热点。
分子生物学的检测技术的快速发展,各种核酸扩增技术在病原菌检测方面的研究越来越多。LAMP技术具备特异性强特点,其中2对引物针对靶序列的6个特异序列区的识别,保证了LAMP扩增的高度特异性,本研究中包含了组织胞浆菌属 (n=8)荚膜组织胞浆菌、荚膜组织胞浆菌杜氏变种、马皮疽荚膜组织胞浆菌3个变种和相近种属 (n=14)的粗球孢子菌、副球孢子菌、申克孢子丝菌、马尔尼菲青霉菌、胶囊青霉菌、皮炎芽生菌、烟曲霉、雅致鳞质霉、锯形放线菌、絮状表皮癣菌、白念珠菌、克柔念珠菌、新生隐球菌、格特隐球菌菌株,特异性达100%。而传统血清学检测例如国外常用的ELISA检测患者血清抗Hc抗体,包被抗原主要有3种:HMIN (荚膜组织胞浆菌素)、pHMIN (纯化荚膜组织胞浆菌素)和ptHMIN (处理后的纯化荚膜组织胞浆菌素)[15]。但因HMIN含有多种糖抗原决定簇而与多种病原菌发生交叉反应,特异性仅有80%[16-17]。
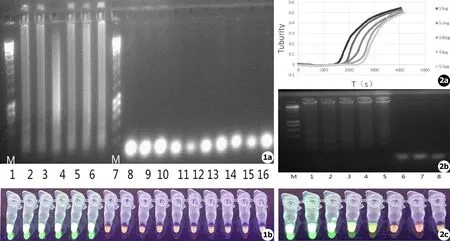
图1 凝胶电泳结果 (a)及LAMP 反应后各管浊度表现结果 (b),LAMP反应体系下表现为阳性样本显示荧光绿:从左至右M代表Marker条带起始处,1~6为组织胞浆菌属:CBS114.388、CBS215.53、CBS136.72、CBS633.91、CBS205.35、CBS537.84;7~16为相近种属:CBS144.34、ATCC10268、ATCC201013、CBS134186、ATCC60916、ATCC64704、CBS130793、CBS221.64、ATCC20735、H99 图2 不同浓度DNA LAMP敏感性扩增效率曲线 (a)、扩增后电泳图 (b)及可见性实验反应结果 (c),阳性样本显示荧光绿。其中M代表Marker条带起始处,1~7为5.3×10-8g、5.3×10-9g、5.3×10-10g、5.3×10-11g、5.3×10-12g、5.3×10-13g、5.3×10-14g,8为ddH2O阴性对照
Fig.1 After gel electrophoresis (a) and LAMP reaction each tube turbidity performance results (b),under LAMP reaction system performance display positive green fluorescence samples.From left to right:Marker,1 to 6 are Histoplasma:CBS114.388,CBS215.53,CBS136.72,CBS633.91,CBS205.35,CBS537.84;7 to 16 is similar to the species:CBS144.34,ATCC10268,ATCC201013,CBS134186,ATCC60916,ATCC64704,CBS130793,CBS221.64,ATCC20735,H99 Fig.2 Different concentrations of DNA LAMP sensitive amplification efficiency curve (a),after amplification electrophoresis (b) and the visibility of the experimental results of the reaction (c),positive samples showed fluorescent green.From left to right:Marker,5.3×10-8g,5.3×10-9g,5.3×10-10g,5.3×10-11g,5.3×10-12g,5.3×10-13g,5.3×10-14g,ddH2O negative
该LAMP技术在65℃、90 min反应条件下,对组织胞浆菌基因组DNA的检测敏感度达到5.3 pg/反应 (即5.3×10-12g,约160个基因组拷贝),优于聚合酶链式反应 (Polymerase Chain Reaction,PCR)对Hc DNA的检测敏感性 (约300个基因拷贝)[18],与实时荧光定量聚合酶链式反应 (Quantitative Realtime-PCR,qPCR)对组织胞浆菌的 DNA检测的敏感性相当[19]。但PCR、qPCR需要比Bst聚合酶更贵且不稳定的Taq酶和较昂贵的高精度热循环仪,在资源受限的国家和地区很难推广应用。
目前,虽然以核酸检测技术为代表的分子检测技术尚未成熟,但已经凸显出对经典真菌学检测技术的技术优势与临床应用潜力。美国HOLOGIC Gen-Probe公司虽早在十余年前就已经开发出了针对Hc的基因探针测试盒 (The AccuProbe H.capsulatum culture identification test)[20-21],但是此产品价格高昂且操作复杂,即使在美国等发达国家也未推广应用,更遑论发展中国家和地区。而本研究中开发的LAMP方法操作简便,不需要特殊仪器,只需恒温水浴锅即可完成整个反应,且特异性可靠、敏感高;结果鉴定简明直接,肉眼即可直接观察结果,具有较好的开发潜力和临床应用前景。
[1] Singgh N.Fungal infections in the recipients of solid organ transplantaion[J].Infect Dis Clin North Am,2003,17(1):113-134.
[2] Kauffman CA.Histoplasmosis:a clinical and laboratory update[J].Clin Microbiol Rev,2007,20(1):115-132.
[3] Craig SC.The tropical world of Samuel Taylor Darling:parasites,pathology,and philanthropy[J].J Hist Med Allied Sci,2009,64(3):375-377.
[4] 赵蓓蕾,施毅,印洁,等.我国部分地区组织胞浆菌感染的流行病学调查[J].医学研究生学报,2003,16(3):199-202.
[5] 廖万清,潘搏,潘炜华.警惕在我国长江流域的组织胞浆菌病[J].皮肤性病诊疗学杂志,2014,21(3):171-172.
[6] Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Res,2000,28(12):E63.
[7] Tomita N,Mori Y,Kanda H,et al.Loop-mediated isothermal amplification (LAMP) of gene sequences and simple visual detection of products[J].Nat Protoc,2008,3(5):877-882.
[8] 朱衡,瞿峰,朱立煌.利用氯化苄提取适于分子生物学分析的真菌 DNA[J].真菌学报,1994,13(1):34-40.
[9] Ramos-e-Silva M,Lima CM,Schechtman RC,et al.Systemic mycoses in immunodepressed patients (AIDS)[J].Clin Dermatol,2012,30(6):616-627.
[10] Baddley JW,Sankara IR,Rodriquez JM,et al.Histoplasmosis in HIV-infected patients in a southern regional medical center:poor prognosis in the era of highly active antiretroviral therapy[J].Diagn Microbiol Infect Dis,2008,62(2):151-156.
[11] Florence H,Matthieu N,Christine A,et al.AIDS-relatedHistoplasmacapsulatumvar.capsulatum infection:25 years experience of French Guiana[J].Aids,2008,22(9):1047-1053.
[12] Pontes LB,Leitão Tdo M,Lima GG,et al.Clinical and evolutionary characteristics of 134 patients with disseminated histoplasmosis associated with AIDS in the State of Ceara[J].Rev Soc Bras Med Trop,2010,43(1):27-31.
[13] 桂希恩,管立人.内脏利什曼病、播散型组织胞浆菌病及马内菲青霉菌病的诊断和鉴别[J].中国寄生虫学与寄生虫病杂志,2007,25(1):69-72.
[14] Supparatpinyo K,Khamwan C,Baosoung V,et al.Disseminated Penicillium marneffei infection in southeast Asia[J].The Lancet,1994,344(8915):110-113.
[15] Guimarães AJ,Pizzini CV,De Matos Guedes HL,et al.ELISA for early diagnosis of histoplasmosis[J].J Med Microbiol,2004,53(6):509-514.
[16] Hung MN,Sun HY,Hsueh PR,et al.Meningitis due toHistoplasmacapsulatumand Mycobacterium tuberculosis in a returned traveler with acquired immunodeficiency syndrome[J].J Formos Med Assoc,2005,104(11):860-863.
[17] Garringer TO,Wheat LJ,Brizendine EJ.Comparison of an established antibody sandwich method with an inhibition method ofHistoplasmacapsulatumantigen detection[J].J Clin Microbiol,2000,38(8):2909-2913.
[18] Scheel CM,Zhou Y,Theodoro RC,et al.Development of a loop-mediated isothermal amplification method for detection ofHistoplasmacapsulatumDNA in clinical samples[J].J Clin Microbiol,2014,52(2):483-488.
[19] Gago S,Esteban C,Valero C,et al.A multiplex real-time PCR assay for identification ofPneumocystisjirovecii,Histoplasmacapsulatum,andCryptococcusneoformans/Cryptococcusgattiiin samples from AIDS patients with opportunistic pneumonia[J].J Clin Microbiol,2014,52(4):1168-1176.
[20] Hall GS,Pratt-Rippin K,Washington JA.Evaluation of a chemiluminescent probe assay for identification ofHistoplasmacapsulatumisolates[J].J Clin Microbiol,1992,30(11):3003-3004.
[21] Chemaly RF,Tomford JW,Hall GS,et al.Rapid diagnosis ofHistoplasmacapsulatumendocarditis using the AccuProbe on an excised valve[J].J Clin Microbiol,2001,39(7):2640-2641.
[本文编辑] 卫凤莲
A loop-mediated isothermal amplification method for molecular detection ofHistoplasmacapsulatum
LI Juan,CHEN Min,PAN Bo,LEI Wen-zhi,FANG Wen-jie,LIU Jia,HONG Nan,LI Ying-fang,LIAO Wan-qing,PAN Wei-hua
(ShanghaiKeyLaboratoryofMolecularMedicalMycology,Instituteofdermatologyandfungaldiseases,PLAKeylaboratoryofthefungaldiseases,Departmentofdermatology,Changzhenghospital,Shanghai200003)
Objective To develop a molecular diagnostic approach for the diagnosis ofHistoplasmacapsulatumbased on the LAMP technology.Methods To establish and optimize a specific primer set of the LAMP technology targeting the sequence of M Antigen for rapid and molecular detection ofHistoplasmacapsulatumat species level.Results In our study,no cross-reaction was observed after 90 min of LAMP reaction,including DNA of the phylogenetically related species such asCoccidioidesimmitis,Sporothrixschenckii,Penicilliummarneffei,etc.The limit-of-detection of the LAMP for genomicHistoplasmacapsulatumDNA was approximately 5.3×10-12g per run (approximately 160 genomic copies).Conclusion Our proposed LAMP assay could represent a potential molecular detection tool for rapid diagnosis ofHistoplasmacapsulatumas a point of care test to be used in clinics in the future.
histoplasmosis;loop-mediated isothermal amplification;molecular diagnostics;rapid detection
重大传染病防治科技重大专项 (2013ZX10004612);国家973项目 (2013CB531601,2013CB531606);国家自然科学基金 (81201269);上海市科委专项 (14DZ2272900)
李娟,女 (汉族),硕士研究生在读.E-mail:lijuanluck@gmail.com
潘炜华,E-mail:panweihua@medmail.com.cn
R 379.9
A
1673-3827(2016)11-0079-06
2015-12-29

