铜绿假单胞菌质粒介导的喹诺酮耐药机制研究
李梅 王文香 潘发愤 沈跃飞
铜绿假单胞菌质粒介导的喹诺酮耐药机制研究
李梅 王文香 潘发愤 沈跃飞
目的 探讨铜绿假单胞菌对质粒介导喹诺酮类耐药(PMQR)机制,为控制其耐药性传播提供依据。方法 筛选住院患者对环丙沙星耐药的69株铜绿假单胞菌,PCR筛选质粒介导的喹诺酮类耐药基因[qnr,aac(6')-Ib-cr],阳性产物进行DNA测序,接合转移试验验证PMQR基因。结果 69株受试株中,12株aac(6')-Ib-cr基因阳性,经DNA测序、BLAST比对,3株携带aac(6')-Ib-cr基因(含有Trp-102→Arg和Asp-179→Tyr突变),另有3株为aac(6')-Ib野生型;质粒接合转移试验结果阴性;未检出qnr基因。结论 铜绿假单胞菌PMQR基因以aac(6')-Ib-cr基因为主,未检出qnr基因,aac(6')-Ib-cr基因介导低水平耐药。
铜绿假单胞菌 质粒介导喹诺酮耐药 环丙沙星
铜绿假单胞菌是临床最常见的非发酵革兰阴性杆菌,近年来其对喹诺酮类药物的耐药性越来越强,这对临床治疗构成严峻挑战。研究发现,质粒qnr基因介导细菌对喹诺酮类耐药[1],氨基糖苷乙酰转移酶的变异基因aac(6′)-Ib-cr[2]以及喹诺酮类药物特异性外排系统qepA和oqxAB[3],均为质粒介导喹诺酮类耐药(PMQR)。国内外关于PMQR的研究集中在肠杆菌科细菌,而在非发酵菌铜绿假单胞菌中报道较少。因此,笔者对我院69株对环丙沙星耐药的铜绿假单胞菌进行PMQR(qepA和oqxAB除外)检测,探讨其耐药机制,为临床合理使用抗生素提供依据。
1 材料和方法
1.1 菌株来源 筛选我院2012年1月至2014年12月住院患者对环丙沙星耐药的69株铜绿假单胞菌(同一例患者同一部位重复分离株除外)。质控菌株铜绿假单胞菌ATCC27853和大肠埃希菌ATCC25922购自卫生部临检中心;叠氮化钠耐药大肠埃希菌J53及aac(6′)-Ib-cr、qnrA、qnrB、qnrS阳性菌株由浙江大学附属邵逸夫医院俞云松教授惠赠;qnrC、qnrD阳性菌株由复旦大学附属华山医院王明贵教授惠赠。
1.2 仪器及试剂 VITEK60全自动微生物分析仪、比浊仪(法国生物梅里埃公司),PCR扩增仪(德国Eppendorf公司),DYY-5型稳压稳流电泳仪(北京市六一仪器厂),WP-200A型紫外透射反射分析仪和UV-8000全自动凝胶成像分析系统(温州奥利生物医学仪器厂)。哥伦比亚琼脂、MH琼脂、胰蛋白胨(英国Oxoid公司),PCR试剂、引物(上海生物工程有限公司),环丙沙星标准品(中国卫生部生物制品药品检定所)。
1.3 方法
1.3.1 基因组DNA提取 采用煮沸法提取细菌基因组DNA制备模板。
1.3.2 DNA电泳定量 制备0.8%的琼脂糖凝胶,将1μl的DNA稀释5倍后与1μl 6×上样缓冲液混匀,加样,电泳后在紫外灯下观察并估约DNA的浓度,-20℃冰箱保存备用。
1.3.3 引物 引物由上海生物工程公司合成,详见表1。
表1PCR所用引物
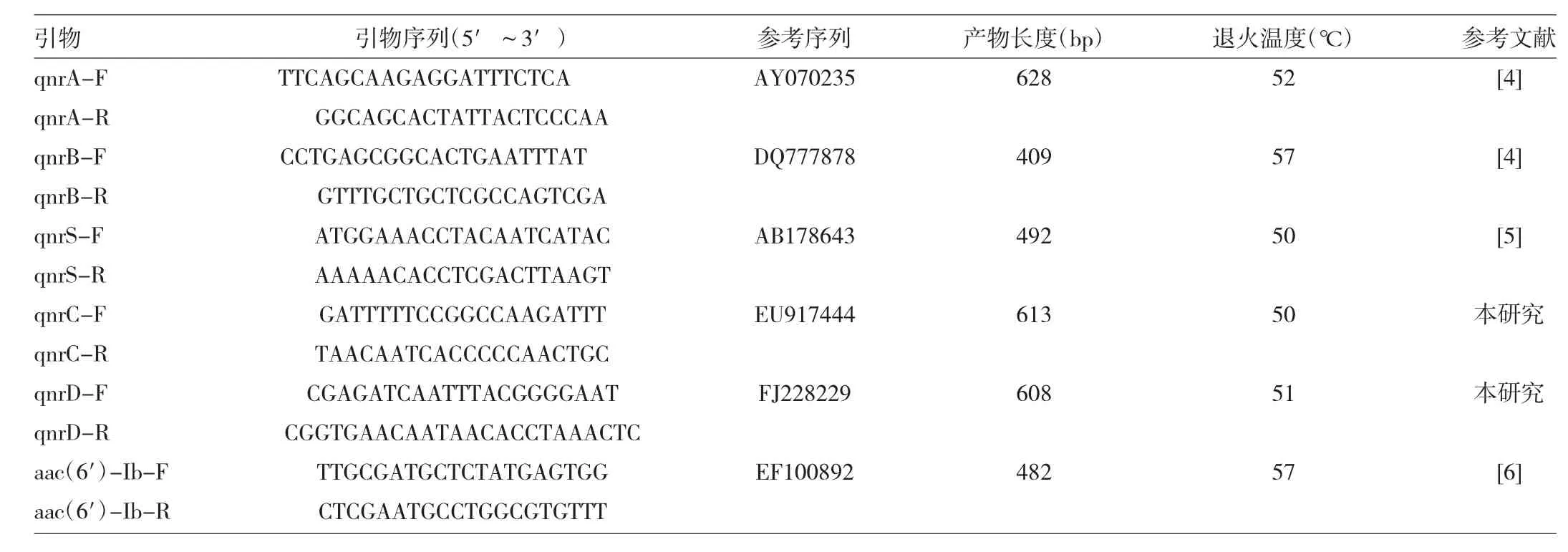
表1 PCR所用引物
1.3.4 PCR检测PMQR基因 初筛PMQR基因用25μl反应体系见表2,阳性菌株测序用50μl反应体系见表3,PCR反应循环参数:先94℃预变性3min,再按变性94℃30s→退火47℃30s→延伸72℃1min,循环35个周期,最后72℃延伸10min。

表2 PCR初筛体系

表3 PCR测序体系
1.3.5 PCR产物电泳检测 PCR产物在含溴化乙啶1%的琼脂糖中电泳后,用全自动凝胶成像分析系统观察结果。
1.3.6 阳性PCR产物DNA测序 由北京华大基因公司进行正反双向测序,测序结果先在本地数据库比对,然后在NCBI中用BLAST比对分析。
1.3.7 质粒接合转移实验 参照王明贵等[7]方法,以大肠埃希菌J53AZR(对叠氮化钠耐药)为接合实验受体菌,携带aac(6′)-Ib-cr的铜绿假单胞菌为供体菌。取对数生长期的供体菌及受体菌到LB液体培养基中过夜培养,用胰蛋白胨大豆琼脂平板[内含叠氮化钠(300μg/ml)及头孢曲松(2μg/ml),为TSA平板]筛选接合子,提取接合子DNA进行PCR扩增。接合转移实验判断标准见表4。

表4 接合转移实验判断标准
2 结果
2.1 aac(6′)-Ib-cr基因 69株受试株中检出aac(6′)-Ib阳性菌株12株,阳性率17.4%,经DNA测序、BLAST比对,3株携带aac(6′)-Ib-cr基因(含有Trp-102→Arg和Asp-179→Tyr突变),阳性率25%;另有3株为aac(6′)-Ib野生型。部分菌株的PCR扩增产物电泳结果见图1,aac(6′)-Ib-cr部分测序结果见图2。

图1 部分aac(6′)-Ib基因PCR电泳结果[1、2为aac(6′)-Ib基因阳性菌株,3为aac(6′)-Ib基因阴性菌株,M为分子量标准]

图2 部分aac(6′)-Ib-cr测序结果
2.2 aac(6′)-Ib-cr基因的接合转移实验 在TSA筛选平板上无菌落生长,提示体外接合实验阴性。
2.3 qnr基因检测 69株受试株未检出qnr基因,即未检出qnrA、qnrB、qnrC、qnrD、qnrS基因。
3 讨论
喹诺酮类药物是一类重要的广谱抗生素,抗菌作用强,可大量人工合成。随着其广泛应用,耐药性问题也日益突出,既往研究集中在药物靶位DNA旋转酶(gyrA和gyrB)和拓扑异构酶Ⅳ(parC和parE)基因突变,此染色体介导的突变仅能将耐药性垂直传播给下一代。qnr基因由1998年在多重耐药的肺炎克雷伯菌质粒上发现[1],随后PMQR机制成为研究热点,质粒水平传播的特点,使PMQR基因的耐药性在不同菌种间快速传播,给临床抗感染治疗带来威胁。
PMQR在各地报道检出率从1%到40%~50%不等,与菌种有关,而大部分检出菌株为肠杆菌科细菌,对非发酵菌报道较少,本研究探讨PMQR在临床铜绿假单胞菌中的分布。我院铜绿假单胞菌PMQR以aac(6′)-Ib-cr为主,aac(6′)-Ib-cr是氨基糖苷乙酰转移酶aac(6′)-Ib的变异基因,仅由aac(6′)-Ib突变2个氨基酸后形成,可乙酰化含游离氨基的喹诺酮类[8],说明耐药基因的变异对耐药性有重要作用。
本实验对aac(6′)-Ib的研究改变了以往通过酶切首先定位是否有aac(6′)-Ib-cr,然后再对变异菌株测序确证的方法[9-10],而是直接对aac(6′)-Ib阳性的菌株进行DNA测序,研究aac(6′)-Ib-cr基因是否存在。本研究共检出3株铜绿假单胞菌携带aac(6′)-Ib-cr基因(含有Trp-102→Arg和Asp-179→Tyr突变),占 aac(6′)-Ib阳性菌株的17.4%,低于在MDRPA中的检出率[9]。Trp102→Arg和Asp179→Tyr两次突变赋予了aac(6′)-Ib-cr修饰喹诺酮类的能力,可使细菌对环丙沙星及诺氟沙星的MIC值上升4倍,机制为此基因编码的灭活酶可使环丙沙星及诺氟沙星中的氨基氮“-NH”乙酰化,从而使其抗菌活性下降[8]。我院aac(6′)-Ib-cr基因在2012年中即有检出,但3年检出率不高,提示aac(6′)-Ib-cr介导低水平耐药。本研究中aac(6′)-Ib-cr基因的接合转移实验阴性,这可能与供体菌数量较少有关,目前国内关于非发酵菌的此类转移性报道也较少。
本研究69株铜绿假单胞菌中未检出qnr基因,说明目前此基因未在我院流行。qnr家族的检出率非常低,Ogbolu等[11]曾在134株临床菌株中仅发现l株铜绿假单胞菌携带qnrD。
虽然PMQR耐药基因只引起低水平耐药,但此耐药性可使细菌数量达到突变浓度,从而出现高水平耐药[12],导致医院内甚至更大范围流行,且aac(6′)-Ib-cr所介导喹诺酮类耐药机制比qnr更为常见,本研究对本地区菌株流行、院感控制提供了第一手资料,应加强对耐药菌株监测,合理选用抗生素,从而控制aac(6′)-Ibcr基因在医院的传播。
[1]Martinez-Martinez L A,Pascual G A,Jacoby.Quinolone resistance from a transferable plasmid[J].Lancet,1998,351(9105): 797-799.
[2]Robicsek A J,Strahilevitz G A,Jacoby,et al.Fluoroquinolonemodifying enzyme:a new adaptation of a common aminoglycoside acetyltransferase[J].Nat Med,2006,12(1):83-88.
[3]PoirelL,Cattoir V,Nordmann P.Plasmid-mediated quinolone resistance;interactions between human,animal,and environmental ecologies[J].Front Microbiol,20l2,3(24):1-7.
[4]Wu J J,Ko W C,Tsai S H,et al.Prevalence of plasmid-mediated quinolone resistance determinants QnrA,QnrB,and QnrS among clinical isolates of Enterobacter cloacae in a Taiwanese hospital [J].Antimicrob Agents Chemother,2007,51(4):1223-1227.
[5]Whichard J MK,Gay J E,Stevenson,et al.Human Salmonella and concurrent decreased susceptibility to quinolones and extended-spectrum cephalosporins[J].Emerg Infect Dis,2007,13(11): 1681-1688.
[6]Park C H,Robicsek A,Jacoby G A,et al.Prevalence in the United States ofaac(6′)-Ib-cr encoding a ciprofloxacin-modifying enzyme[J]Antimicrob Agents Chemother,2006,50(11):3953-3955.
[7]Wang M,Tran J H,Jacoby G A,et al.Plasmid-mediated quinolone resistance in clinicalisolates of Escherichia coli from Shanghai,China[J].Antimicrob Agents Chemother,2003,47(7):2242-2248.
[8]Mac Gowan A P,Bowker K E.Mechanism of fluoroquinolone resistance is an important factor in determining the antimicrobialeffect of gemifloxacin against Streptococcus pneumoniae in an in vitro pharmacokinetic model[J].Antimicrob Agents Chemother, 2003,47(3):1096-1100.
[9]姜梅杰,冯莉,赵书平.多药耐药铜绿假单胞菌相关耐药基因研究[J].中华医院感染学杂志,2009,19(1):8-12.
[10]Yang H,Chen H,Yang Q,et al.High prevalence ofplasmid-mediated quinolone resistance genes qnr and aac(6′)-Ib-cr in clinicalisolates ofEnterobacteriaceae from nine teaching hospitals in China[J].Antimicrob Agents Chemother,2008,52(12): 4268-4273.
[11]Ogbolu D O,Daini O A,Ogunledun A,et al.High levels of multidrug resistance in clinical isolates of Gram-negative pathogens from Nigeria[J].Int J Antimicrob Agents,2011,37(1):62-66.
[12]朱恒乾,彭斌,廖晓萍.质粒介导喹诺酮类耐药机制研究进展[J].中国畜牧兽医,2010,37(10):81-86.
Identification of multidrug resistance genes in quinolone-resistance Pseudomonas aeruginosa with plasmid conjugation method
LI Mei, WANG Wenxiang,PAN Fafen,et al.Department of Infectious Diseases,the First Xiaoshan People's Hospital,Hangzhou 311200, China
Objective To identify multidrug resistance genes in quinolones resistance-Pseudomonas aeruginosa(PMQR). Methods Sixty nine clinical isolated of ciprofloxacin-resistant Pseudomonas aeruginosa were collected.Quinolone resistance genes[qnr,aac (6')-Ib-cr]were screened with PCR plasmid-mediated method,positive products were DNA sequenced,and PMQR genes were verified with plasmid conjugation method. Results Among 69 strains tested,12 were aac (6')-Ib-cr gene positive shown by DNA sequencing,BLAST comparison,including 3 contained mutated aac (6')-Ib-cr gene (Trp-102→Arg and Asp-179→Tyr),and another 3 carried wild type aac(6')-Ib;while plasmid conjugation test was negative and qnr gene was not detected. Conclusion The clinical isolates of Pseudomonas aeruginosa are aac (6')-Ib-cr-based low-level resistance PMQR,and qnr gene is not detected.
Pseudomonas aeruginosa Plasmid-mediated quinolone resistance Ciprofloxacin
2015-08-27)
(本文编辑:严玮雯)
311200 杭州市萧山区第一人民医院感染科(李梅、王文香、沈跃飞);温州医科大学附属第一医院感染科(潘发愤)
李梅,E-mail:limei.china@163.com

