颈内静脉原位导丝法换置中心静脉长期血液透析导管的临床应用
何援军 金劼 蒋国霞
颈内静脉原位导丝法换置中心静脉长期血液透析导管的临床应用
何援军 金劼 蒋国霞
目的 探讨经颈内静脉原位导丝法换置中心静脉长期血液透析导管在维持性血液透析(MHD)患者中的应用价值。方法 选取近3年在颈内静脉留置的中心静脉长期血液透析导管因功能障碍后,并经颈内静脉原位导丝法换置长期导管,术后及每次透析后均改用尿激酶封管患者16例(原位换置组);选取同期首次经颈内静脉留置中心静脉长期血液透析导管,普通肝素封管患者20例作为对照组;分析两组患者围术期泵控血流量及随访期的反应及开存期率、次开存期率。结果 围术期泵控血流量原位换置组高于对照组,有统计学差异(P<0.05);两组比较感染例次/1000导管日0.9%与1.0%,无统计学差异(P>0.05)。原位换置组围术期未发生中重度并发症,12个月开存期率81.2%、次开存期率93.8%;对照组开存期率为65%、次开存期率85%;两组比较无统计学差异(P>0.05)。结论 颈内静脉原位导丝法换置中心静脉长期血液透析导管,在MHD患者中的使用是安全的、可行的。
颈内静脉 导丝法换置 中心静脉长期导管 血液透析
建立一种理想的血管径路是维持性血液透析(MHD)患者维持生存的生命线,采用自体动静脉内瘘(s-AVF)所重建的血管径路具有开存期长、感染率低、生活限制少等优点,目前仍是MHD患者首选的血管径路[1]。但是,随着透析治疗普及,因糖尿病、高血压及老年人等并发血管病变或外周血管耗竭导致无法建立和长期维持以s-AVF为血液透析径路的患者逐渐增多,因此近年来临床上开始采用带涤纶毡袖套的长期中心静脉导管(CVC)径路作为半永久血管径路。我院2010年透析血管径路采用Permcath中心静脉径路者达26%,2012年增至30%,相应长期导管并发症发生率增加,其中导管血栓形成堵塞和感染明显影响了开存期导管径路寿命,并威胁MHD患者的生存质量。临床常用方法是改变透析方式(如改为腹膜透析),或撤导管后换位重置CVC,笔者采用颈内静脉原位导丝法换置Palindrome导管重建CVC成功16例,临床效果满意,现将结果报道如下。
1 对象和方法
1.1 对象 选择2010年3月至2013年2月在我科接受治疗时首次置入颈内静脉中段隧道式带cuff的双腔导管MHD患者133例,置管12个月平均开存期率65%的采用Permcath长期导管为血液透析径路的患者共43例(32.3%),其中21例(48.8%)并发导管相关感染和导管功能障碍,5例不适宜作原位换置长期中心静脉导管中,2例颈内、上腔静脉血栓形成,改为腹膜透析,3例用换位重置插管法后继续MHD;其余16例(76.2%)选用原位导丝法换置Palindrome导管成功继续MHD,其中男10例,女6例,年龄32~85岁,平均(63.8± 11.1)岁;原发病为慢性肾小球肾炎7例,糖尿病肾病5例,高血压肾病2例,病因不明2例;导管功能障碍原因包括:(1)血栓栓塞(单腔7例,双腔3例);(2)出口处或隧道感染经换药抗感染治疗无效4例;(3)导管滑移1例;(4)导管破损1例。选取同期首次颈内静脉置入中心静脉导管行长期血液透析患者20例作为对照组,其中男13例,女7例,年龄26~82岁,平均(59.6±9.8)岁;原发病为慢性肾小球肾炎8例,糖尿病肾病7例,高血压肾病3例,病因不明2例。两组患者性别、发病年龄、原发病等比较差异均无统计学意义(均P>0.05)。Permcath长期导管功能障碍原因和处理详见表1。
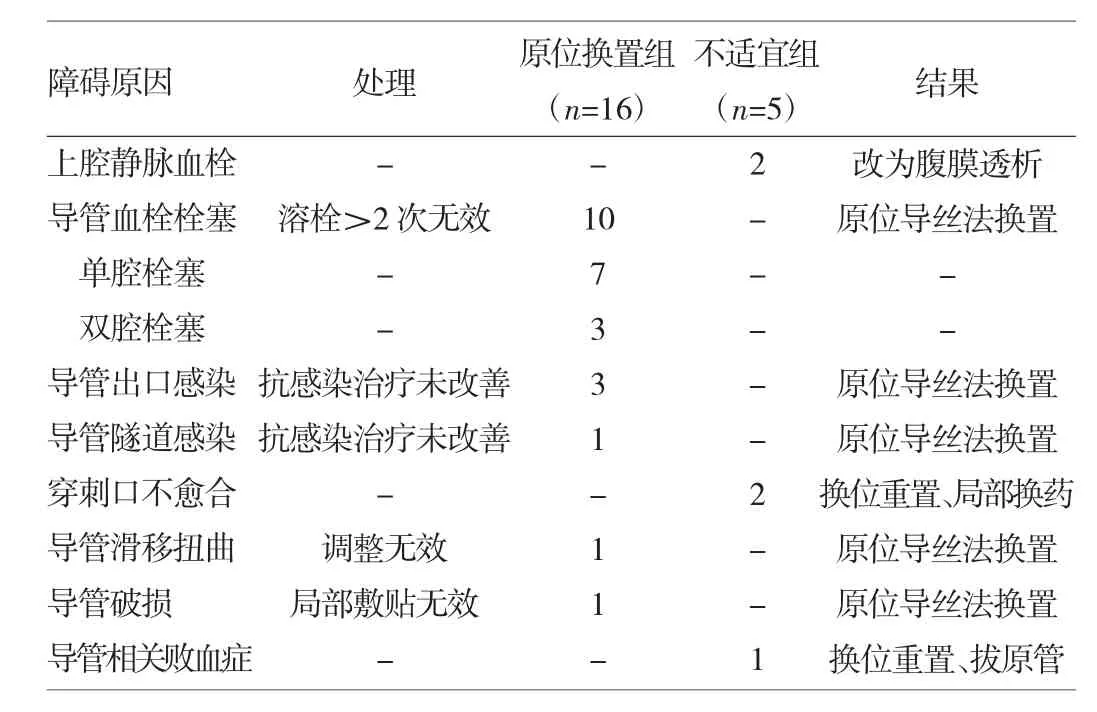
表1 Permcath长期导管功能障碍原因和处理
1.2 方法
1.2.1 换置导管品牌及材料 换置管选泰尔·帕玲珑长期带毡袖套14.5Fr双腔导管,导管长度36~40cm,管顶端设计为对称式开口,聚氟乙丙烯橡胶组织相容性材料;根据患者身高和体表标志预测设计皮下隧道与进入右心房相应距离(导管头端约在胸骨右侧平第2肋下缘)。
1.2.2 换置操作步骤 (1)按质控标准消毒手术室或导管室,导管包经过肝素盐水灌洗。(2)患者头低平卧位,常规消毒铺巾。(3)1%利多卡因局麻,在导管侧胸锁乳突肌锁骨三角区(注意局麻针勿刺伤原导管)作1cm小切口,游离皮下组织,暴露原导管。另在原导管隧道皮肤出口区麻醉,切开出口,分离导管毡袖套,创口区域组织如有感染则另换手术器械。(4)从原导管分支接管口(首选无堵塞动脉支)插入引导丝头端通过导管腔,到达上腔静脉右心房口。(5)将原导管从皮肤出口拔出,助手按压小切口区止血,引导丝仍留原位,导丝出口为小切口区。(6)修复新导管皮下隧道:用合适的隧道通管针从小切口逆行至新皮肤出口,换置新管Palindrome导管至小切口,与引导丝会合。(7)扩张进入颈内静脉通道:沿引导丝的角度及深度通过12~15Fr组织扩张杆后,立即沿引导丝把新导管插入颈内静脉,抽出引导丝。调整皮下隧道,推注0.9%氯化钠注射液10ml,抽吸使导管腔通畅度,按导管腔容量予尿激酶(1万U/ml)正压封管,切口缝合。床边X线检查证实导管头端位于上腔静脉右心房附近。(8)如原导管两腔完全栓塞引导丝不能插入,则从小切口处切开管侧壁暴露管腔抽取血栓,随后插入引导丝,但务必夹住管壁防止断裂残端缩入静脉腔,余步骤同前述。
1.3 观察指标 观察两组患者围术期泵控血流量、不良反应及导管相关感染情况;记录两组术后3、6、12、41个月的开存期率(导管建立到采取干预措施对并发症进行处理期间的开通率)和次开存期率(导管功能障碍后经处理再恢复开存期)。
1.4 统计学处理 应用SPSS16.0统计软件,计量资料以表示,组间比较采用t检验,计数资料组间比较采用χ2检验。
2 结果
2.1 术后情况 16例患者原位导丝法换置导管均获成功,平均时间(20.0±6.5)min,患者安静接受,未发生意外,平均失血量(10.0±3.2)ml,次日开始接受MHD治疗。换置导管时床边X线检查导管头端调整位置在颈内静脉近心端3例,右心房12例,上腔静脉1例(该例患者身材高大,体型较肥胖)。
2.2 泵控血流量及导管相关感染情况 原位换置组透析平均泵控血流量较对照组高,差异有统计学意义(P<0.05);两组患者在围术期出现的发热等全身反应、区域肿痛、导管隧道感染、导管出口相关感染及随访期观察导管感染次/1 000导管日等比较均无统计学差异(均P>0.05),详见表2。
2.3 两组患者导管开存期率与次开存期率 两组患者前3个月开存期率均为100%,随后6、12、41个月两组开存期率与次开存期率比较均无统计学差异(均P>0.05),详见表3。

表2 两组患者围术期反应及导管相关感染情况
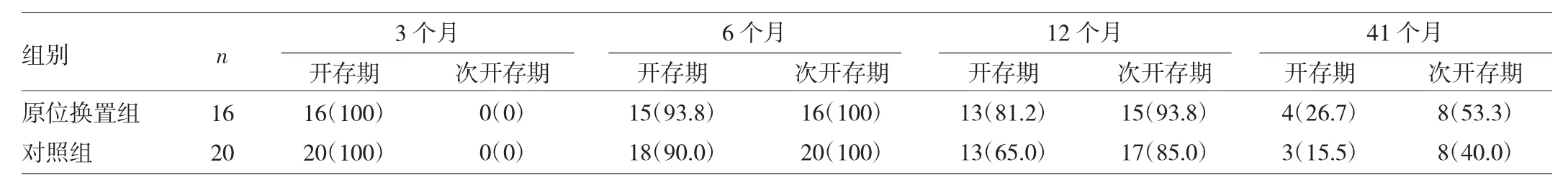
表3 两组开存期率与次开存期率比较[例(%)]
2.4 两组患者死亡情况 原位换置组1例于MHD开存期9个月头颅CT检查确诊脑出血,最终死亡。对照组1例于MHD次开存期15个月因急性心肌梗死死亡。
3 讨论
血液透析是肾衰竭患者赖以生存的重要肾脏替代治疗方法之一,MHD患者最佳血液透析的径路目前仍是自身或移植血管的动静脉内瘘。但在临床实践工作中常因各种原因导致无法建立动静脉内瘘,如肥胖、老年人、糖尿病、心力衰竭等MHD患者血管病变或外周血管耗竭等,需选择接受长期CVC血液通路,但随着透析生存期延长,相应并发症的发生率增加,甚至导致导管功能障碍,是我们急需解决的一道难题。既往从原位换置管法因顾虑栓塞脱落、感染等,所以开展不多,临床处理上一般采用改变透析方式(如短期导管过渡行腹膜透析),或采用更换位重置插管法深静脉插管,部位有对侧颈内静脉、锁骨下静脉、股静脉至髂静脉置管等,但由于左侧颈内静脉置管必须通过左头臂静脉到达上腔静脉,操作较右侧难度高,也仍有相应的血栓、感染并发症发生。使用HeRO血管通路(一种新型的永久性皮下动静脉血管通路,通过阻塞锁骨下静脉的取栓并插入有机硅导管达上腔静脉右心房连接处,远心端与延展性肱动脉相接人造血管建立的通路),可为部分MHD患者血管通路的建立提供一个新的选择[2],但该种导管尚未普及。杨涛等[3]报道从颈内静脉原位重新置入长期导管获得成功。
笔者认为,在控制原置管处感染、排除右侧颈内静脉及上腔静脉血栓、狭窄外,可筛选颈内静脉CVC导管功能障碍患者,经原位导丝法换置长期导管,特别在B超引导静脉定位和床边X线定位下提高换置导管的安全度。其次,笔者选择换置近年推出的泰尔·帕玲珑导管,该导管是聚氟乙丙烯橡胶良好生物相容性材料,顶端对称式,14.5Fr大管腔双D设计,2009年已开始在我国应用,Palindrome导管具有低流量发生少、感染发生率低等特点[4]。其三,置管后早期控制感染,促进创口愈合。其四,加强导管护理,重视透析环境清洁,操作者手的清洗和手套隔离,二次消毒和导管皮肤口清洁、消毒或敷药;改尿激酶封管,防止导管相关感染和血栓形成栓塞,延长导管开通率。
本研究中原位换置组6、12个月开存期率、感染次/ 1 000导管日换置组与对照组比较均无统计学差异(均P>0.05),而围术期泵控血流量高于对照组,有统计学差异(P<0.05),说明本方法近期是可行及安全的。
MHD患者首选的透析径路仍是s-AVF,不可轻易放弃重建s-AVF的机会[5]。确实无法建立,或已经在颈内静脉建立长期导管出现功能障碍时,原位导丝法换置导管不失为MHD患者血管径路重建的较好方法,但要求操作者有较高的技术,术后作好长期导管管理,真正达到符合“长期”的要求,让透析医务人员和患者一起重视建设和捍卫“最后生命线”。
[1] 叶朝阳,程烨.血液透析的血管通路[J].临床肾脏病杂志,2012,12(9): 388-389.
[2] 王沫,刘丁,刘永光,等.HeRO血管通路[J].中国血液净化,2013,12(8): 458-461.
[3] 杨涛,张丽红,崔锐,等.永久性中心静脉导管纤维鞘形成患者异位穿刺再次置管的方法探讨[J].中国血液净化,2012,12(12):689-691.
[4] MoossaviS,VachharajaniTJ.Palindrome dialysis catheter with or without peel-away sheath[J].J Vasc Access,2010,11(4):359.
[5] 中华医学会.临床技术操作规范-肾脏病学分册[M].北京:人民军医出版社,2009:39-43.
In situ displacement of central venous catheter with internal jugular vein guide wire in patients with maintenance hemodialysis
HE Yuanjun,JIN Jie,JIANG Guoxia.Department of Internal Medicine,Zhejiang Quhua Hospital,Quzhou 324004,China
Objective To assess the application of in situ displacement of central venous catheter with internal jugular vein guide wire in patients with maintenance hemodialysis(MHD). Methods Centralvenous hemodialysis catheter was displaced with internaljugular vein guide wire in 16 MHD patients and the tube was sealed with urokinase after dialysis;at the same time,20 MHD patients with long-term central venous catheter using heparin tube sealing was randomly selected as control group.The performance was analyzed and compared between two groups. Results The perioperative blood flow in replacement group was higher than that in controlgroup(P<0.05).The 12-month catheter open rate and time catheter open rate in replacement group and controlgroup was 81.2%,65%and 93.8%,85%respectively(both P>0.05).The infection rates in two groups were 0.9%and 1.0%, (χ2=0.79,P>0.05). Conclusion The internal jugular vein in situ guide wire hypallage of central venous catheter is safe and feasible for patients with MHD.
The internaljugular vein Guide wire displacementLong-term centralvenous catheter Hemodialysis
2014-10-17)
(本文编辑:严玮雯)
324004 浙江衢化医院肾内科
何援军,E-mail:qhfh1999@163.com

