卵巢癌患者外周血调节性T细胞的变化及其临床意义
吴杰 骆骥才 陈文虎 许志良 张剑英 张毅敏 金元 刘鹏 徐笑红
卵巢癌患者外周血调节性T细胞的变化及其临床意义
吴杰 骆骥才 陈文虎 许志良 张剑英 张毅敏 金元 刘鹏 徐笑红
目的 探讨卵巢癌患者外周血调节性T细胞(Treg)水平变化的意义及其临床意义。方法 采用流式细胞术测定130例卵巢癌患者和50例体检健康女性的外周血中CD4+、CD8+、NK以及Treg等不同淋巴细胞亚群的比例,比较两组间的差异,分析卵巢癌不同临床病理因素患者Treg水平的差异,并比较手术和化疗患者手术前后或化疗前后Treg水平的变化。结果 卵巢癌组外周血CD4+、NK细胞比例以及CD4+/CD8+比值均明显低于正常对照组,而Treg细胞比例明显高于正常对照组;淋巴结转移卵巢癌患者其Treg水平高于淋巴结未转移,且在不同的FIGO分期中III、IV期患者的Treg细胞比例要高于I、II期,差异均有统计学意义(均P<0.05);手术后Treg细胞比例较手术前明显下降,差异有统计学意义(P<0.05);化疗后Treg细胞比例与化疗前的差异无统计学意义(P>0.05)。结论 卵巢癌患者外周血Treg水平与卵巢癌的分期和进展有关,在卵巢癌预后判断以及疗效监测中有重要意义。
调节性T细胞 卵巢癌 流式细胞术
卵巢癌是目前常见的妇科肿瘤之一,虽然发病率低于宫颈癌和子宫内膜癌,但由于早期诊断困难,70%~80%的患者发现时已为中晚期,治疗效果不理想,其病死率已跃居妇科恶性肿瘤的首位[1]。有研究发现,卵巢癌的发生、发展除与癌细胞的恶性增殖和侵袭有关外,还与患者自身的免疫调节功能失衡密切相关[2],而淋巴细胞亚群的变化在这一过程中起重要作用。在淋巴细胞亚群与免疫功能的研究中调节性T细胞(Treg)已成为近年来研究的热点,Treg是一类高表达CD4、CD25而弱表达CD127抗原(CD4+CD25+CD127low)的T细胞亚群,通过抑制机体CD4+和CD8+细胞的活化和增殖、抑制NK细胞的增殖在维持机体免疫自稳和调控免疫应答等方面起重要作用,但在肿瘤患者中Treg的表达水平异常升高从而抑制了自身的抗肿瘤作用[3]。笔者通过检测卵巢癌患者血浆中Treg等淋巴细胞亚群水平的变化,分析Treg对卵巢癌患者免疫功能的影响及其与临床病理因素间的关系,探讨Treg在卵巢癌研究中的意义。
1 对象和方法
1.1 对象 2013年6月至2014年12月于浙江省肿瘤医院妇科住院的卵巢癌患者130例,年龄27~76(53± 11)岁;所有患者均经病理检查确诊,排除严重感染和自身免疫病史。其中浆液性癌82例,黏液性癌29例,子宫内膜样癌10例,混合性上皮癌9例;选取同期在浙江省肿瘤医院体检健康50例女性作为正常对照组,年龄28~70(49±10)岁;两组间年龄差异无统计学意义(P>0.05)。同时从130例患者中选取30例手术患者和30例未手术的化疗患者,其中30例手术患者为Ⅰ~Ⅱ期卵巢癌患者,年龄31~68(49±9)岁,30例化疗患者为Ⅲ~Ⅳ期晚期患者,年龄35~74(54±10)岁;化疗均采用TP方案:紫杉醇(175mg/m2)+卡铂(AUC=5)。
1.2 方法 采用流式细胞术测定卵巢癌患者和健康者外周血中CD4+、CD8+、NK以及Treg等不同淋巴细胞亚群的比例。采集清晨空腹静脉血,EDTA-K2抗凝,采用Beckman Coulter公司生产的CytomicsTMFC 500仪器,所用抗体均为Beckman Coulter公司仪器的配套产品,检测CD4+、CD8+T细胞和NK细胞的比例以及Treg占CD4+T细胞的比例,其中T细胞亚群以CD4-FITC/ CD8-PE/CD3-PC5组合标记,NK细胞以CD3-FITC/CD(16+56)-PE组合标记,Treg细胞以 CD25-FITC/ CD127-PE/CD4-PC5组合标记,以同荧光素标记同源的IgG1或IgG2作为同型对照。实验步骤:取流式试管加入100μl抗凝全血,分别加入标记单克隆抗体各20μl,涡旋混匀后室温避光孵育20min,加入500μl红细胞裂解液OptiLyse C,涡旋混匀,室温避光10min,加入PBS 500μl洗2次,离心弃上清液,再加入PBS 500μl,混匀后上机检测。比较术前和术后1个月以及化疗前和化疗1周期后Treg水平的变化。
1.3 统计学处理 应用SPSS 18.0统计软件。计量资料用表示,两组间比较采用t检验,多组间比较采用方差分析。
2 结果
2.1 卵巢癌组和正常对照组淋巴细胞亚群的比较 卵巢癌组CD4+、NK比例以及CD4/CD8比值明显低于正常对照组,差异均有统计学意义(均P<0.05);卵巢癌组Treg细胞比例明显高于正常对照组,差异有统计学意义(P<0.01),详见表1。
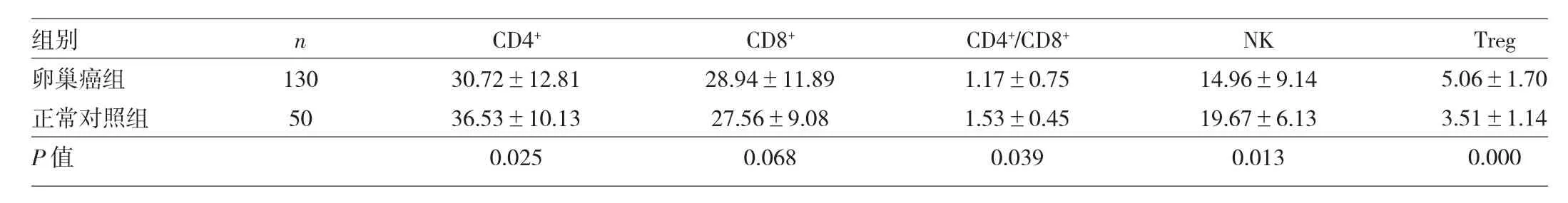
表1 卵巢癌组和正常对照组淋巴细胞亚群的比较(%)
2.2 不同临床病理因素卵巢癌患者Treg水平的比较 淋巴结转移的卵巢癌患者Treg水平高于淋巴结未转移的患者,在FIGOⅢ、Ⅳ期组患者的Treg水平明显高于Ⅰ、Ⅱ期组,差异均有统计学意义(均P<0.05);而Treg水平在年龄、分化程度、病理分型中的差异均无统计学意义(均P>0.05),详见表2。
2.3 手术及化疗前后卵巢癌患者血浆Treg水平的变化 手术1个月后患者Treg比例为(4.16±1.01)%,较术前 [(4.86±1.43)%]有明显下降,差异有统计学意义(P<0.05);化疗后Treg比例为(5.11±1.52)%,较化疗前[(5.43±1.81)%]略有下降,但差异无统计学意义(P>0.05)。
3 讨论
Treg是目前研究渐热的一种免疫抑制细胞,由Sakaguchi等[4]在1995年首次报道。Treg具有低反应性和免疫抑制性两大功能,通过抑制CD4+和CD8+细胞的活化和增殖、抑制NK细胞的增殖,下调树突状细胞(DC)的表面共刺激分子的表达、降低抗原递呈的效率等发挥作用[5-7],研究表明Treg在多种实体肿瘤组织和外周血中均有显著增加[8-11],并且其水平与肿瘤的分级、进展以及患者的预后相关[12-15],本研究旨在通过分析Treg对卵巢癌患者免疫功能的影响以及在不同临床病理因素分组下的变化,探讨Treg在卵巢癌研究中的意义。
本研究发现卵巢癌患者体内免疫功能处于低下和失衡状态,其CD4+、NK细胞的水平以及CD4+/CD8+的比值明显低于正常对照组,而Treg水平高于正常对照组,提示卵巢癌患者体内免疫功能低下与异常增加的Treg细胞相关,这一结果与Dowlatshahi等[16]的研究结果一致,另有研究者发现下调肿瘤患者Treg水平后患者的抗肿瘤功能得到显著改善[17-18],进一步证实Treg通过抑制CD4+、NK等淋巴细胞的活化、增殖从而限制了机体的抗肿瘤免疫功能。

表2 卵巢癌患者Treg在不同临床病理因素中的比较
在卵巢癌不同临床病理因素分组比较中,笔者发现Treg水平在不同年龄阶段表达较为稳定,在≥50岁和<50岁中无统计学差异,与Santner-Nanan等[19]的研究结果相同。同时Treg在卵巢癌不同的病理分型和分化程度中均无统计学差异,但在FIGOⅢ、Ⅳ期组的Treg水平明显高于Ⅰ、Ⅱ期,同时淋巴结转移组患者的Treg水平也明显高于淋巴结未转移组,提示Treg水平与肿瘤的分期和转移扩散密切相关,因此对卵巢癌患者的预后有重要价值。此外笔者对其中部分患者手术前后和化疗前后的Treg水平进行比较,结果显示术后Treg水平较术前有显著下降,而化疗后Treg水平较化疗前有一定程度下降但无统计学差异。对这一结果认为术后Treg水平的下降可能是由于术后肿瘤细胞对Treg的诱导作用消失所致,已有研究证实肿瘤细胞能产生某些细胞因子和CCL22趋化因子从而导致Treg的增生分化和局部聚集,并构成一个免疫耐受的微环境[20-21],而术后这一作用消失Treg水平也随之下降。化疗作为卵巢癌治疗的另一种重要手段,其作用机制较为复杂。有研究认为化疗药物可通过抑制肿瘤微环境中的血管生成,促进Treg细胞调亡减少,从而有效控制肿瘤的发展[22],国内有学者报道化疗后Treg水平在乳腺癌、直肠癌、肺癌等肿瘤中均有明显下降[23-25],在本研究中化疗后Treg水平较化疗前水平有下降但无统计学差异,可能是因为入选的研究样本相对偏少,另一方面则与患者不同的免疫状态以及化疗敏感性的个体差异有关,笔者将在增加样本量和化疗周期以及统一给药时间、方法等基础上作进一步的研究。
综上所述,卵巢癌患者中Treg抑制了机体正常的抗肿瘤免疫功能,其水平与卵巢癌患者的免疫状态及肿瘤分期密切相关,因此能够作为卵巢癌预后以及疗效监测的重要指标,但Treg水平与肿瘤细胞间的具体作用机制尚未明确,需作更深入的研究。
[1] JemalA,SiegelR,Xu J,et al.Cancer statistics,2010[J].CACancer J Clin,2010,60(5):277-300.
[2] Winkler I,Wilczynska B,Bojarska-Junak A,et al.Regulatory T lymphocytes and transform-ing growth factor beta in epithelialovarian tumors-prognostic significance[J].J Ovarian Res,2015,8 (1):39.
[3] Curiel T J.Tregs and rethinking cancer immunotherapy[J].J Clin Invest,2007,117(5):1167-1174.
[4] SakaguchiS,SakaguchiN,Asano M,et al.Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25):breakdown of a single mechanism of self-tolerance causes various autoimmune diseases[J].J Immunol,1995,155(3):1151-1164.
[5] Horwitz D A,Zheng S G,Gray J D.The role of the combination of IL-2 and TGF-β or IL-10 in the generation and function of CD4 CD25+and CD8+regulatory Tcellsubsets[J].J Leukoc Biol,2003, 74(4):471-478.
[6] Piccirillo C A,Shevach E M.Cutting edge:control of CD8+T cell activation by CD4+CD25+immunoregulatory cells[J].J lmmunol, 2001,167(3):1137-1140.
[7] Azuma T,TakahsshiT,Kunisato A,et al.Hu man CD4+CD25+regulatory T cells suppress NKT cell function[J].Cancer Res,2003, 63(15):4516-4520.
[8] Maruyama T,Kono K,Izawa S,et al.CCL17 and CCL22 chemokines within tumor microenvironment are related to infiltration of regulatory T cells in esophageal squamous cell carcinoma[J].Dis Esophagus,2010,23(5):422-429.
[9] Liu F,Lang R,Zhao J,et al.CD8(+)cytotoxic Tcelland FOXP3(+) regulatory Tcellinfiltration in relation to breast cancer survivaland molecular subtypes[J].Breast Cancer Res Treat,2011,130(2): 645-655.
[10] Ormandy LA,Hillemann T,Wedemeyer H,et al.Increased populations of regulatory T cells in peripheral blood of patients with hepatocellular carcinoma[J].Cancer Res,2005,65(6):2457-2464.
[11] Beyer M,Schultze J L.Regulatory T cells in cancer[J].Blood,2006,108(3):804-811.
[12] Sasada T,Kimura M,Yoshida Y,et al.CD4+CD25+regulatory T cells in patients with gastrointestinal malignancies:possible involvement of regulatory T cells in disease progression[J].Cancer,2003,98(5):1089-1099.
[13] Kim S,Lee A,Lim W,et al.Zonal difference and prognostic significance of foxp3 regulatory T Cell infiltration in breast cancer[J]. J Breast Cancer,2014,17(1):8-17.
[14] Gobert M,Treilleux I,Bendriss-Vermare N,et al.Regulatory T cells recruited through CCL22/CCR4 are selectively activated in lymphoid infiltrates surrounding primary breast tumors and lead to an adverse clinical outcome[J].Cancer Res,2009,69(5): 2000-2009.
[15] Tae Jung Jang.Progressive increase of regulatory T cells and decrease ofCD8+Tcells and CD8+Tcells/regulatory Tcells ratio during colorectal cancer development[J].The Korean Journal of Pathology,2013,47(5):443-451.
[16] Dowlatshahi M,Huang V,Gehad A E,et al.Tumor-specific T cells in human Merkel cell carcinomas:a possible role for Tregs and T-cell exhaustion in reducing T-cell responses[J].J Invest Dermatol,2013,133(7):1879-1889.
[17] DannullJ,Su Z,RizzieriD,et al.Enhancement of vaccine-mediated antitumor immunity in cancer patients after depletion of regulatory Tcells[J].J Clin Invest,2005,115(12):3623-3633.
[18] Pastille E,BardiniK,Fleissner D,et al.Transient ablation ofregulatory T cells improves antitumor immunity in colitis-associated colon cancer[J].Cancer Res,2014,74(16):4258-4569.
[19] Santner-Nanan B,SeddikiN,Zhu E,et al.Accelerated age-dependent transition ofhuman regulatory Tcells to effector memory phenotype[J].Int Immunol,2008,20(3):375-383.
[20] CurielTJ,Coukos G,Zou L,et al.Specific recruitment of regulatory T cells in ovarian carcinoma fosters immune privilege and predicts reduced survival[J].Nat Med,2004,10(9):942-949.
[21] LiYQ,Liu F F,Zhang XM,et al.Tumor secretion of CCL22 activates intratumoralTreg infiltration and is independent prognostic predictor ofbreast cancer[J].PLoS One,2013,8(10):e76379.
[22] Chu Y,Wang LX,Yang G,et al.Efficacy Efficacy of GM-CSF-producing tumor vaccine after docetaxel chemotherapy in mice bearing established Lewis lung carcinoma[J].J Immunother, 2006,29(4):367-380.
[23] 卢晓婷,刘俊田,任秀宝,等.化疗对乳腺癌患者外周血中treg细胞数目的影响及意义[J].中国肿瘤临床,2008,35(9):508-511.
[24] 刘海义,王海波,张毅勋,等.直肠癌新辅助治疗对外周血CD4+CD25HighCD127low调节性T细胞的抑制作用[J].中华实验外科杂志, 2014,31(11):2505.
[25] Chen C,Chen Z,Chen D,et al.Suppressive effects of gemcitabine plus cisplatin chemotherapy on regulatory Tcells in nonsmall-celllung cancer[J].J Int Med Res,2015,43(2):180-187.
Regulatory T cell levels in peripheral blood of patients with ovarian cancer and its clinicopathological significance
WU Jie,LUO Jicai,CHEN Wenhu,et al.Department of Clinical Laboratory,Zhejiang Cancer Hospital,Hangzhou 310022,China
【 Abstract】 Objective To investigate the levels of CD4+CD25+CD127low regulatory T cells in peripheral blood of patients with ovarian cancer and its relation to clinicopathological features of the disease. Methods Plasma levels of CD4,CD8,NK and regulatory T cells were measured in 130 ovarian cancer patients and 50 healthy controls by flow cytometry.The relation between the plasma levels of regulatory T cells and clinicopathologic features of the disease was analyzed,and changes of regulatory T cells levels in 30 ovarian cancer patients before and after surgery and chemotherapy were compared. Results The percentages of CD4+,NK and CD4+/CD8+ratio in ovarian cancer group were significantly lower than those in control group.The percentage of regulatory T cells in ovarian cancer group was significantly higher than that in controls;the percentage of regulatory T cells in patients with lymphatic metastasis was significantly higher than that in those without lymphatic metastasis;and the percentage of regulatory T cells in advanced cancer patients was significantly higher than that in early cancer patients(P<0.05).The levels of regulatory T cells dropped significantly after surgery(P<0.05),but had no significant changes after chemotherapy(P>0.05). Conclusion The results indicate that regulatory Tcells may be a valuable marker for prognosis and treatment monitoring in patients with ovarian cancer.
Regulatory Tcells Ovarian cancerFlow cytometry
2015-09-09)
(本文编辑:严玮雯)
浙江省卫生厅资助项目(2015KYA042)
310022 杭州,浙江省肿瘤医院检验科(吴杰、陈文虎、张剑英、张毅敏、金元、刘鹏、徐笑红);浙江大学医学院附属第一医院检验科(骆骥才);中国科学院(杭州)生命科学院(许志良)
徐笑红,E-mail:zjhzxxh@163.com

