乙醇摄入对乙醛脱氢酶2不同基因型小鼠急性心肌梗死及DNA氧化损伤的影响
赵强 周立英 赖红梅 马丽 彭辉
乙醇摄入对乙醛脱氢酶2不同基因型小鼠急性心肌梗死及DNA氧化损伤的影响
赵强 周立英 赖红梅 马丽 彭辉
目的 探讨大剂量乙醇摄入对乙醛脱氢酶2(ALDH2)不同基因型小鼠急性心肌梗死及DNA氧化损伤的影响。方法将23只ALDH2基因敲除型(KO)和19只野生型(WT)小鼠随机分为4组:KO组11只,KO+乙醇(E)组12只,WT组9只,WT+E组10只,其中KO+E组及WT+E组经口灌胃大剂量乙醇[2g/(kg·d),连续8d],而KO组及WT组每日经口予以等量0.9%氯化钠溶液连续8d。所有小鼠均制备急性心肌梗死模型,建模4周后经超声诊断仪检测心功能,采用伊文蓝颜料测定心肌梗死面积,ELISA法测定心肌8-羟基脱氧鸟苷(8-OHdG)水平。结果 (1)急性心肌梗死造模后4周,KO组、KO+E组、WT组、WT+E组小鼠存活数量分别为7、8、7、7只,病死率分别为18.2%、33.3%、22.2%、30.0%,4组间差异无统计学意义(P>0.05)。(2)WT组小鼠左室短轴缩短率、射血分数均高于KO组小鼠,4组间差异均有统计学意义(均P<0.05)。(3)心肌梗死面积由大至小依次为:KO+E组>KO组>WT+E组>WT组,4组间差异均有统计学意义(均P<0.05)。(4)心肌8-OHdG水平由高至低依次为:KO+E组>KO组>WT+E组>WT组,4组间差异均有统计学意义(均P<0.05)。结论 增强ALDH2表达可有效地拮抗大剂量乙醇摄入对急性心肌梗死的损害作用,其发挥保护作用的机制可能与减轻心肌细胞DNA氧化损伤有关。
乙醛脱氢酶2 急性心肌梗死 心功能 DNA氧化损伤
急性心肌梗死(acute myocardial infarction,AMI)是在某些诱因作用下冠状动脉粥样硬化斑块破裂导致冠状动脉完全或不完全闭塞,引起的心肌缺血坏死现象,其病死率高、预后差,已成为全球性的公共卫生问题[1-2]。冠心病家族史、高血压、糖尿病、吸烟、饮酒等已被公认为AMI的危险因素。其中,大剂量乙醇摄入可明显增加冠心病的发病率及病死率[3]。乙醛脱氢酶2(aldehyde dehydrogenases-2,ALDH2)是哺乳动物体内代谢乙醇的关键酶。研究发现,ALDH2表达缺乏可导致心肌细胞凋亡增加,而增强ALDH2表达则可对抗心力衰竭的发生和心功能的降低[4]。因此,ALDH2在心血管疾病的发生、发展中发挥着重要的作用。然而,ALDH2具有高度遗传多态性,随编码基因不同,其活性亦不同,从而影响乙醇及其代谢产物在体内的作用效果。本研究通过对ALDH2不同基因型的小鼠实施大剂量乙醇干预,观察小鼠心肌梗死面积、心肌梗死后的心功能及8-羟基脱氧鸟苷(8-hydroxy-2′-deoxyguanosine,8-OHdG)水平,探讨大剂量乙醇摄入对ALDH2不同基因型小鼠AMI及DNA氧化损伤的影响。
1 材料和方法
1.1 材料 23只ALDH2基因敲除型(KO)及19只野生型(WT)小鼠均由日本大学医学部提供,为8~12周龄C57BL/6雄性小鼠。主要试剂:DNA ExtractorTIS Kit(日本Wako公司,货号296-67701),核酸酶P1(美国Sigma公司,货号N8630),碱性磷酸酶(美国Sigma公司,货号1197075001),8-羟基脱氧鸟苷ELISA试剂盒(美国OXIS公司,货号21026)等。主要仪器:小动物高分辨率超声系统(加拿大Visual Sonics公司),倒置显微镜(德国Zeiss公司)、酶标仪(美国Bio Tek公司),小动物呼吸机(中国青松生物医学仪器有限公司),冰冻切片机(德国Leica公司)等。
1.2 方法
1.2.1 动物饲养 小鼠饲养于SPF环境中,室温22~25℃,湿度50%~60%,光照控制12h明/12h暗,颗粒饲料购自新疆医科大学实验动物中心。
1.2.2 实验分组及乙醇干预 将小鼠随机分为4组,即KO组11只、KO+乙醇(E)组12只、WT组9只、WT+E组10只,KO+E组、WT+E组小鼠均经口灌胃施以大剂量乙醇造成亚急性的乙醇中毒,具体剂量:乙醇2g/(kg· d),1次/d,连用8d[5],KO组、WT组每日经口给予等量的0.9%氯化钠溶液,连续8d。
1.2.3 小鼠AMI模型制备 小鼠用乙醚麻醉后固定,置于4×10放大倍数的倒置显微镜下。予气管插管,用呼吸机维持呼吸,其间用乙醚维持麻醉状态。乙醇消毒皮肤,自颈正中切开,断2、3肋骨,充分暴露主动脉和心脏。用眼科纤维手术镊子撕开心包膜,充分暴露心脏左室前壁,在肺动脉圆锥和左心耳交界处,略靠近左心耳下方分离左冠状动脉前降支,穿10号医用缝合线结扎。术后正常饮食,每日定时观察。
1.2.4 心功能检测 术后4周乙醚麻醉小鼠,将其仰卧位固定,用小动物高分辨率超声诊断仪行超声检查。在二维切面上显示胸骨旁左心长轴,用M型超声心动图法分别测量左室舒张末期内径(left ventricular end-diastolic diameter,LVEDD)、左室短轴缩短率(fraction shortening,FS)、左室射血分数(left ventricular ejection fraction,LVEF)。超声检测仪所用参数均相同,每个数据测量5个不同的心动周期取其平均值。
1.2.5 心肌梗死面积测定 术后4周时乙醚麻醉小鼠,将20g/L的伊文蓝颜料经主动脉逆行灌注左心室腔。摘取心脏,冲洗染料,制备左心室切片(厚度2mm),用含10g/L四氮唑的磷酸盐缓冲液染色20min,以10%的甲醛溶液固定1d,根据颜色不同区分各区域。蓝色为正常心肌,红色为缺血心肌,灰白色为梗死心肌。扫描仪扫描染色的心脏切片。使用Image-Pro Plus图像软件测量相关区域面积,计算心肌组织梗死率,心肌组织梗死率=灰白色梗死区面积/(红色缺血区+灰白色梗死区)×100%。
1.2.6 心肌8-OHdG水平的测定 利用DNA ExtractorRTIS Kit提取小鼠心肌DNA,经核酸酶和碱性磷酸酶在37℃条件下反应1h进行DNA酶解处理,随后采用8-OHdG ELISA试剂盒测定8-OHdG水平,操作方法均按照上述产品的标准操作规范进行。
1.3 统计学处理 应用SPSS17.0统计软件,计量资料以表示,组间比较采用单因素方差分析,两两比较选择Bonferroni法;计数资料组间比较采用χ2检验。
2 结果
2.1 各组小鼠一般情况及病死率的比较 AMI造模术后4周,KO组、KO+E组、WT组、WT+E组小鼠存活数量分别为7、8、7、7只,4组病死率分别为18.2%、33.3%、22.2%、30.0%,各组小鼠病死率比较差异无统计学意义(P>0.05)。存活小鼠均出现不同程度的食量减少、体重减轻、活动缓慢等情况。
2.2 各组小鼠心功能指标的比较 心脏超声检测发现,与KO组及KO+E组相比,WT组、WT+E组FS、LVEF值均增高,差异均有统计学意义(均P<0.05),而LVEDD差异无统计学意义(P>0.05)。KO与KO+E组、WT与WT+E组相比,上述指标均无统计学差异(均P>0.05),详见表1、图1。

表1 各组小鼠心脏超声检查指标的比较
图1 AMI造模后4周小鼠心脏超声心动图
2.3 各组小鼠心肌梗死面积及8-OHdG水平的比较 心肌梗死面积测定发现,小鼠心肌梗死面积由大至小依次为:KO+E组>KO组>WT+E组>WT组,4组间差异均有统计学意义(均P<0.05)。ELISA检测8-OHdG水平由高至低依次为:KO+E组>KO组>WT+E组>WT组,4组间差异均有统计学意义(均P<0.05),详见表2。
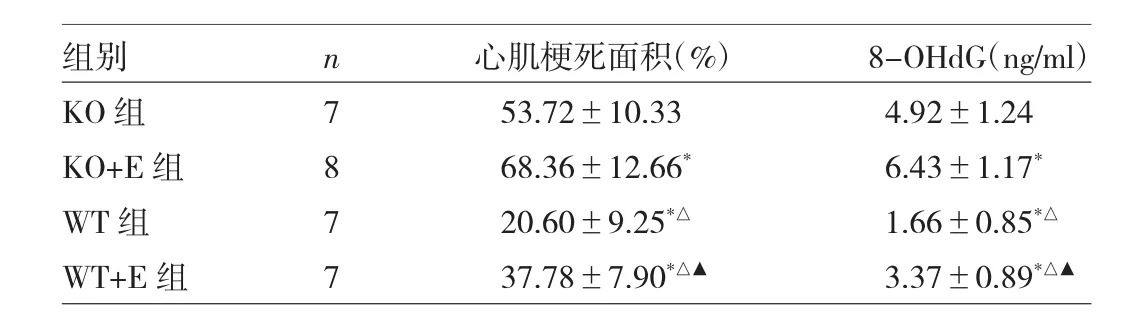
表2 小鼠心肌梗死面积及8-OHdG水平的比较
3 讨论
现有研究表明大量饮酒会加速动脉硬化的进展,长期酗酒甚至会引起栓子脱落及AMI[6]。近期大规模荟萃分析证实,乙醇摄入量与冠心病的发病率、病死率呈“U”或“J”形曲线关系,适当饮酒或不饮酒能够降低包括AMI在内的心血管疾病的发生率及病死率,发挥保护心血管的作用[7-8]。乙醇通过自由扩散进入细胞内进行代谢,主要在ALDH作用下转化成乙醛,后者积聚导致氧化应激对组织细胞造成损害[9],参与多种疾病的发生、发展。主要存在于线粒体内的ALDH2能催化乙醛代谢生成乙酸,并最终被氧化为二氧化碳和水排出体外。ALDH2活性降低使乙醛向乙酸分解的过程受到阻遏,导致乙醛浓度增高,刺激肥大细胞释放血管活性物质引起一系列反应[10]。Chen等[11]报道在部分对心肌缺血诱发的损伤具有很强抵抗力的大鼠心脏中ALDH2活性一直处于较高水平,推测很可能是在ALDH2的作用下,大鼠心肌缺血时体内醛类物质减少所造成的。人类ALDH2基因的Glu504Lys位点具有单核苷酸多态性,包括具有催化活性的野生型与无催化活性的突变型基因型。突变型ALDH2基因编码的酶活性降低,催化乙醛的作用显著减弱,携带该基因型的个体更易罹患AMI等心血管疾病[12-13]。本研究通过建立ALDH2不同基因型小鼠AMI模型,给予大剂量乙醇干预造成亚急性乙醇中毒,观察乙醇、不同的ALDH2基因型与AMI的交互作用。结果显示,亚急性乙醇中毒及ALDH2基因敲除均会增加小鼠心肌梗死面积,且两者具有协同作用,而增强ALDH2表达能够有效减少心肌梗死面积。同时,ALDH2基因敲除小鼠的心功能损害较野生型小鼠为严重。
目前普遍认为,大剂量乙醇摄入使血液及心脏组织内乙醛蓄积,导致心肌肥厚、减弱心脏收缩功能、破坏心肌细胞内Ca2+稳态,而ALDH2能够显著降低乙醛的水平,从而拮抗乙醇的上述不良生物学效应,同时改善心肌纤维化及心肌细胞凋亡[14]。外源性给予ALDH2激动剂Alda-1能够清除心肌缺血/再灌注损伤积聚的细胞毒性醛类物质,减少60%心肌缺血损伤导致的心肌梗死面积[11]。ALDH2还能够分解乙醛代谢产物4-羟壬烯醛,减轻乙醛及其代谢产物对细胞的氧化损伤,从而发挥心血管保护作用。进一步研究发现,ALDH2拮抗乙醇心脏毒性是通过抑制蛋白激酶2A和2C,调节Akt和AMPK这两个关键酶活化,改变其下游产物mTOR、STAT3、Notch1等的平衡,抑制转录因子Foxo3的磷酸化,减轻心肌细胞凋亡、自噬及线粒体功能障碍等实现的[15-16]。在乙醇代谢过程中,伴随着大量ROS的生成[17],ROS堆积可以引起DNA、蛋白质和脂质等大分子物质损伤。DNA的损伤可直接导致突变,造成细胞功能蛋白的缺失甚至可能导致癌变。ROS攻击DNA形成加合物8-OHdG,后者被认为是DNA氧化损伤的重要标志物[18]。乙醇摄入可以诱发脑和肺组织中DNA氧化损伤,且在ALDH2基因敲除型小鼠中表现更为突出[19]。本研究也发现,亚急性乙醇中毒及ALDH2基因敲除均可使AMI小鼠心肌内8-OHdG水平增加,而增强ALDH2表达可以降低8-OHdG水平、减少心肌细胞的DNA氧化损伤,这可能是ALDH2在AMI中发挥心脏保护作用的机制之一。
Oyama等[5]以相同剂量乙醇造成ALDH2基因敲除小鼠亚急性乙醇中毒的研究中发现,敲除型小鼠的病死率高于野生型小鼠。在大规模人群流行病学研究中ALDH2基因多态性与心血管疾病的病死率密切相关,尤其是ALDH2基因突变型[13]。而本研究中观察到ALDH2不同基因型及亚急性乙醇中毒对AMI小鼠的病死率并无明显影响,且亚急性乙醇中毒对小鼠的心功能影响不大。笔者推测这可能与实验样本量较少、乙醇干预及心肌梗死建模后观察的时间相对较短有关。
综上所述,ALDH2具有极其重要的心血管保护作用,增强ALDH2表达可有效地拮抗亚急性乙醇中毒对AMI的损害作用,作用机制可能与其减轻心肌细胞DNA氧化损伤有关。将来,保护和增强ALDH2的活性有望成为有效治疗冠心病的新方向。
[1] 张丽,谢建洪,劳迪波,等.应用蛋白质组学技术筛选急性心肌梗死早期标志蛋白的研究[J].浙江医学,2014,36(24):1985-1989.
[2] 骆立新,钟诚,孙仞,等.老年急性下壁心肌梗死溶栓后冠状动脉介入治疗安全性研究[J].浙江医学,2015,37(14):1205-1208.
[3] Razvodovsky Y E.Alcohol-attributable fraction of ischemic heart disease mortality in Russia[J].ISRN Cardiol,2013,2013:287869.
[4] Sun A,Zou Y,Wang P,et al.Mitochondrial aldehyde dehydrogenase 2 plays protective roles in heart failure after myocardial infarction via suppression of the cytosolic JNK/p53 pathway in mice [J].J Am Heart Assoc,2014,3(5):e000779.
[5] Oyama T,Kim YD,Isse T,et al.A pirot study on subacute ethanol treatment ofALDH2 KO mice[J].J ToxicolSci,2007,32(4):421-428.
[6] Biyik I,Ergene O.Alcoholand acute myocardialinfarction[J].J Int Med Res,2007,35(1):46-51.
[7] Ronksley P E,Brien S E,Turner B J,et al.Association of alcohol consumption with selected cardiovascular disease outcomes:a systematic review and meta-analysis[J].BMJ,2011,342:d671.
[8] Holmes M V,Dale C E,Zuccolo L,et al.Association between alcohol and cardiovascular disease:Mendelian randomisation analysis based on individual participant data[J].BMJ,2014,349: g4164.
[9] HillB G,Bhatnagar A.Beyond Reactive Oxygen Species:Aldehydes as Arbitrators ofAlarm and Adaptation[J].Circ Res,2009,105 (11):1044-1046.
[10] Fernandez-Sola J,Estruch R,Grau J M,et al.The relation of alcoholic myopathy to cardiomyopathy[J].Ann Intern Med,1994, 120(7):529-536.
[11] Chen C H,Budas G R,ChurchillE N,et al.Activation of aldehyde dehydrogenase-2 reduces ischemic damage to the heart[J]. Science,2008,321(5895):1493-1495.
[12] Takagi S,Iwai N,Yamauchi R,et al.Aldehyde dehydrogenase 2 gene is a risk factor for myocardial infarction in Japanese men [J].Hypertens Res,2002,25(5):677-681.
[13] Chen C H,Ferreira J C,Gross E R,et al.Targeting aldehyde dehydrogenase 2:new therapeutic opportunities[J].Physiol Rev, 2014,94(1):1-34.
[14] Doser TA,TurdiS,Thomas D P,et al.Transgenic overexpression of aldehyde dehydrogenase-2 rescues chronic alcohol intake-induced myocardialhypertrophy and contractile dysfunction[J].Circulation,2009,119(14):1941-1949.
[15] Ma H,Li J,Gao F,et al.Aldehyde dehydrogenase 2 ameliorates acute cardiac toxicity of ethanol:role of protein phosphatase and forkhead transcription factor[J].J Am Coll Cardiol,2009,54 (23):2187-2196.
[16] Ge W,Guo R,Ren J.AMP-dependent kinase and autophagic flux are involved in aldehyde dehydrogenase-2-induced protection against cardiac toxicity of ethanol[J].Free Radic Biol Med,2011,51(9):1736-1748.
[17] Wang X,Ke Z,Chen G,et al.Cdc42-Dependent Activation of NADPH Oxidase Is Involved in Ethanol-Induced Neuronal Oxidative Stress[J].PLoS One,2012,7(5):e38075.
[18] 计柳玉,李航,黎乐群,等.兔肝脏局部注射无水乙醇后8-OHdG的表达及意义[J].临床与实验病理学杂志,2012,28(2):207-209.
[19] 韩京军,高新跃,吴志华,等.ALDH2基因多态性对乙醇相关性DNA氧化损伤中影响的研究[J].中华肿瘤防治杂志,2010,17(9):648-650.
Effects of aldehyde dehydrogenase-2 on acute myocardial infarction and DNA oxidative damage induced by ethanol intake in mice
ZHAO Qiang,ZHOU Liying,LAI Hongmei,et al.Department of Cardiology,First Affiliated Hospital of Xinjiang Medical University, Urumqi 830001,China
【 Abstract】 Objective To investigate the effects of aldehyde dehydrogenase-2 (ALDH2)on myocardial infarction and DNA oxidative damage induced by ethanol intake in mice. Methods The mice with ALDH2(+/+)(WT group)and ALDH2(-/-)genotypes (KO group)were raised and then divided into two subgroups with or without ethanol treatment:KO group (n=11),WT group(n=9),KO+ethanol group(n=12)and WT+ethanol group(n=10).The KO+ethanol group and WT+ethanol group were fed with high dose of ethanol,while the KO group and WT group were treated with equal volume of saline.Acute myocardial infarction was induced in all mice;4 weeks later then the cardiac function were detected by ultrasonography,the myocardial infarct size was measured by Evan's blue pigment,and myocardial 8-hydroxy-2'-deoxyguanosine (8-OHdG)level was determined by ELISA. Results The mortality rates of KO group,WT group,KO+ethanol group and WT+ethanol group were 18.2%,33.3%,22.2%and 30.0%,respectively(P>0.05).The fraction shortening of left ventricular and ejection fraction were higher in WT group compared to KO group(P<0.05).The area of myocardial infarction was the largest in KO+ethanol group, followed by KO group,WT+ethanol group,and WT group(all P<0.05).The levels of 8-OHdG was highest in KO+ethanol group,followed by KO group,WT+ethanol group,and WT group(all P<0.05). Conclusion Enhanced ALDH2 gene expression may effectively protect myocardium from infarction caused by high dose ethanol intake,which may be related to its attenuation of myocardial oxidative damage.
Aldehyde dehydrogenases-2 Acute myocardialinfarction Cardiac function DNAoxidative damage
2015-10-23)
(本文编辑:严玮雯)
新疆维吾尔自治区自然科学基金项目(2012211A083)
830001 乌鲁木齐,新疆医科大学第一附属医院心脏中心(赵强);新疆维吾尔自治区人民医院心血管内科(周立英、赖红梅、马丽、彭辉)
彭辉,E-mail:lucy-ph@163.com

