糖基化终末产物损伤冠状动脉平滑肌细胞Kv通道
苏 文 李虹伟 陈 晖刘慧荣 黄海霞 李卫萍*
(1. 首都医科大学附属北京友谊医院心血管中心,北京 100050;2. 首都医科大学基础医学院生理学与病理生理学系,北京 100069)
· 心血管疾病的病理生理机制 ·
糖基化终末产物损伤冠状动脉平滑肌细胞Kv通道
苏 文1李虹伟1陈 晖1刘慧荣2黄海霞2李卫萍1*
(1. 首都医科大学附属北京友谊医院心血管中心,北京 100050;2. 首都医科大学基础医学院生理学与病理生理学系,北京 100069)
目的 研究糖基化终末产物(advanced glycation end products, AGEs)对大鼠冠状动脉平滑肌细胞电压门控性钾离子(voltage-gated K+, Kv)通道电流的影响。方法 分离大鼠冠状动脉平滑肌细胞,分为空白对照组、糖基化牛血清白蛋白(AGE-bull serum albumin,AGE-BSA)组、AGE-BSA+抗AGE受体抗体(anti-receptor of AGEs immunoglobulin G,anti-RAGE IgG)组进行干预。采用膜片钳技术检测各组细胞Kv通道电流,采用Western blotting、实时荧光定量PCR方法检测各组细胞Kv1.2和Kv1.5通道蛋白及mRNA的表达。结果 AGE-BSA直接干预冠状动脉平滑肌细胞明显抑制了平滑肌细胞的Kv电流达32.7%,并使Kv1.2和Kv1.5通道蛋白及mRNA的表达明显下调。而给予anti-RAGE IgG预处理30 min后再加入AGE-BSA刺激,平滑肌细胞的Kv电流密度及Kv1.2和Kv1.5通道蛋白及mRNA的表达与空白对照组相比,差异无统计学意义。结论 AGEs通过结合RAGE损伤冠状动脉平滑肌细胞Kv通道。
糖基化终末产物;电压门控性钾离子通道;冠状动脉平滑肌细胞;糖基化终末产物受体
血管平滑肌细胞电压门控性钾离子(voltage-gated K+, Kv)通道,特别是Kv1.2和Kv1.5通道在冠状动脉微循环及冠状动脉舒张中起着关键作用[1-2]。本课题组的前期研究[3]表明高糖刺激可抑制大鼠冠状动脉平滑肌细胞的Kv电流,从而减弱Kv通道介导的冠状动脉舒张功能。而高糖引起的冠状动脉舒张功能减退,是糖尿病继发冠状动脉粥样硬化发生发展中的重要环节,探讨其机制可能为临床上防治糖尿病心血管合并症提供新的治疗靶点。
糖基化终末产物(advanced glycations end products,AGEs)由还原糖如葡萄糖等的羰基(醛基或酮基)与蛋白质、脂质的游离氨基端,通过非酶糖基化作用形成。正常情况下,人体内AGEs量很低,但当机体处于高血糖状态会促使糖化进程加快,导致AGEs生成明显增加。AGEs与其受体(receptor of AGEs,RAGE)结合后可以激活多种细胞内信号通路[4-6],继而损伤细胞、组织的功能。目前,有研究[7-8]认为糖尿病心血管合并症最重要的影响因素是AGEs,本研究旨在探讨AGEs对大鼠冠状动脉平滑肌细胞Kv通道的影响。
1 材料和方法
1.1 实验动物
清洁级雄性Sprague-Dawley大鼠18只(6~8周龄),体质量(200±20) g,由北京维通利华实验动物技术有限公司提供,实验动物许可证号:SYXK(京)2012-0024。
1.2 主要试剂
木瓜蛋白酶及牛血清白蛋白(bovine serum albumin,BSA;美国Genview公司),二硫赤藓糖醇及Ⅱ型胶原酶(美国Sigma公司),大豆胰酶抑制剂(美国Amresco公司),糖基化牛血清白蛋白(AGE-bull serum albumin,AGE-BSA,德国Merck公司),Anti-RAGE IgG(美国R&D公司),DMEM(美国Hyclone公司),胎牛血清及0.25%(质量分数)胰蛋白酶(美国Gibco公司),4-氨基吡啶(4-aminopyridine, 4-AP;美国Sigma公司),Kv1.2抗体、Kv1.5抗体及β-actin抗体(美国Abcam公司)。
电极内液成分:KCl 140.0 mmol/L、MgCl21.0 mmol/L、Na2ATP 1.0 mmol/L、EGTA 0.1 mmol/L、HEPES 10.0 mmol/L(用KOH调pH值为7.2)。电极外液成分:NaCl 135.0 mmol/L、KCl 4.7 mmol/L、MgCl21.0 mmol/L、CaCl22.0 mmol/L、HEPES 5.0 mmol/L、D-Glucose 5.5 mmol/L(用NaOH调pH值为7.4)。
1.3 主要仪器
膜片钳放大器(EPC-10,德国HEKA公司),三维操纵仪(MP-285,美国 Sutter 公司),电极拉制仪(PB-7,日本Narishige公司),数据采集软件(Pulse8. 8,德国HEKA公司),Western blotting电泳仪及附件(美国Bio-Rad公司),荧光定量PCR仪(中国杭州博日科技有限公司)。
1.4 实验方法
1)分离大鼠直径150~200 μm的冠状动脉: 采用酶消化法分离冠状动脉平滑肌细胞,置于5%(体积分数) CO2的37 ℃培养箱中培养及干预,膜片钳实验所用细胞为原代细胞,Western blotting及实时荧光定量PCR实验所用细胞为2代细胞,冠状动脉平滑肌细胞的分离、培养及鉴定方法同既往参考文献[9]。
2)实验分组:①空白对照组:培养液中含100 μg/mL BSA;②AGEs组:培养液中含100 μg/mL AGE-BSA;③AGEs+anti-RAGE组:培养液中含100 μg/mL AGE-BSA、100 μg/mL anti-RAGE IgG。各组冠状动脉平滑肌细胞用相应培养液孵育48 h。AGEs+anti-RAGE组在加入AGE-BSA前用anti-RAGE IgG预孵育30 min。药物浓度参考既往文献[10-11]报道。
3)膜片钳技术测定全细胞Kv电流密度:选用胞膜完整、有立体感,折光性好,胞体呈梭形的细胞进行记录。实验在22 ℃~24 ℃下进行。采用全细胞膜片钳记录模式,高阻封接成功后封接电阻为1 GΩ以上,采用负压吸引方式破膜,破膜后电阻500~600 MΩ,稳定5 min,记录电流,为了排除BKCa和KATP电流的影响,电极外液中加入100 nmol/L的iberiotoxin和1 μmol/L的glibenclamide。
4)Kv1.2、Kv1.5通道蛋白和mRNA的检测:采用Western blotting法检测各组细胞Kv1.2、Kv1.5通道蛋白的表达,采用实时荧光定量PCR法检测各组细胞Kv1.2、Kv1.5通道mRNA的表达,引物序列如下:Kv1.2 F:5′-CATTTTGTACTACTACCAGTC-3′,Kv1.2 R:5′-GGAGTGTCTGGACAACTTGA-3′, Kv1.5 F:5′-TGAGCAGGAGGGGAATCAGA-3′,Kv1.5 R:5′-ACACCCTTACCAAGCGG ATG-3′。
1.5 统计学方法
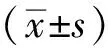
2 结果
2.1 AGEs引起冠状动脉平滑肌细胞Kv通道电流受损
AGE-BSA干预冠状动脉平滑肌细胞48 h后,采用膜片钳技术检测全细胞钾电流,图1A所示为各组细胞在加入4-AP干预前及干预后,将细胞膜电位钳制在-60 mV,之后给予-60~+60 mV、时长400 ms 的系列去极化刺激,阶跃为10 mV,所激发的钾电流,而4-AP敏感的钾电流部分为Kv电流,比例尺纵轴代表电流幅度200 pA,横轴代表时长100 ms。为排除细胞大小对实验的影响,对6个细胞的Kv电流统计后做电压-电流曲线,发现当测试电压高于10 mV后,AGE-BSA使单位面积上电流幅度下降差异有统计学意义。如图1B所示,AGEs组最大Kv电流密度为(13.5 ± 0.4)pA/pF,较空白对照组(20.0 ± 0.5)pA/pF降低32.7%。
Fig.1 Effect of advanced glycation products (AGEs) and anti-receptor of advanced glycation products (anti-RAGE) on Kvcurrents in coronary vascular smooth muscle cells(VSMCs)
A: sample traces of whole cell K+currents recorded before and after incubation with 4-AP;B: I-V relationships of Kv current density in VSMCs; 4-AP:4-aminopyridine; Kv: voltage-gated K+;n=6;*P<0.05vscontrol.
2.2 AGEs下调冠状动脉平滑肌细胞Kv通道的表达
3组细胞间比较,Kv1.2和Kv1.5通道蛋白及mRNA的表达总体上差异有统计学意义。进行两两比较,如图2所示,在蛋白水平上,AGE-BSA显著下调了平滑肌细胞上Kv1.2和Kv1.5通道的表达,以Kv1.5的变化更为明显。Kv1.2通道蛋白相对吸光度值为(0.22±0.01)vs(0.27 ± 0.01)(AGEs组vs对照组,P<0.05),Kv1.5通道蛋白相对吸光度值为(0.22 ± 0.01)vs(0.33 ± 0.01)(AGEs组vs对照组,P<0.05)。在mRNA水平上,AGE-BSA干预影响Kv1.2和Kv1.5通道表达的变化趋势与蛋白水平一致,Kv1.2通道mRNA相对吸光度值为(0.75 ± 0.04)vs(1.00 ± 0.05)(AGEs组vs对照组,P<0.05),Kv1.5通道mRNA相对吸光度值为(0.52 ± 0.03)vs(1.00 ± 0.05)(AGEs组vs对照组,P<0.05),如图3。
2.3 AGEs通过结合RAGE损伤冠状动脉平滑肌细胞Kv通道
在加入AGE-BSA干预前,先给予细胞anti-RAGE IgG预处理30 min以阻断AGEs/RAGE途径,发现anti-RAGE IgG预处理使AGE-BSA对Kv通道功能及结构的损伤作用均被抑制,AGEs+anti-RAGE组细胞的最大Kv电流密度、Kv1.2和Kv1.5通道蛋白及mRNA表达与空白对照组相比,差异均无统计学意义(图1、2、3)。

图2 糖基化终末产物及抗糖基化终末产物受体抗体对冠状动脉平滑肌细胞Kv1.2和Kv1.5通道蛋白表达的影响
Fig.2 Effect of advanced glycation products (AGEs) and anti-receptor of advanced glycation products (anti-RAGE) on protein expression of Kv1.2 and Kv1.5 in coronary vascular smooth muscle cells
A:immubobands of Kv1.2 and Kv1.5 channels; B: protein expression of Kv1.2 and Kv1.5 was evaluated by Western blotting analysis; Kv: voltage-gated K+; *P<0.05vscontrol.

图3 糖基化终末产物及抗糖基化终末产物受体抗体对冠状动脉平滑肌细胞Kv1.2和Kv1.5通道mRNA表达的影响
Fig.3 Effect of advanced glycation products (AGEs) and anti-receptor of advanced glycation products (anti-RAGE)on mRNA expression of Kv1.2 and Kv1.5 in coronary vascular smooth muscle cells Kv: voltage-gated K+;*P<0.05vscontrol.
3 讨论
近年来研究[1-2, 12]显示,Kv通道对于维持血管平滑肌细胞静息电位、调节血管张力具有重要作用,而在糖尿病等病理状态下,Kv通道将受到损伤[1, 13],进而损伤血管张力,影响到血管舒张功能。糖尿病患者体内增加的AGEs是冠状动脉病变的重要危险因素,AGEs对血管舒张功能的损伤作用既往多有报道[14-15],本研究显示AGEs损伤血管平滑肌细胞Kv通道,可以从一定程度上解释AGEs对血管舒张功能的损伤作用,同时亦可解释高糖抑制冠状动脉平滑肌细胞Kv电流进而减弱冠状动脉舒张功能的机制[3]。
在本研究中,AGEs下调了冠状动脉平滑肌细胞Kv1.2和Kv1.5通道蛋白及mRNA的表达,而前期研究[3]结果显示高糖增加Kv1.2通道的硝基化,但未减少Kv1.2和Kv1.5的蛋白表达,两者有一定差别,原因可能在于研究方法的不同,本研究将分离出的冠状动脉平滑肌细胞在AGEs中孵育48 h,前期研究是将分离出的小冠状动脉在高糖中孵育24 h再分离出冠状动脉平滑肌细胞观察高糖对Kv通道的影响,不同培养条件下高糖及其产物对平滑肌细胞的作用强度和时间有一定差别,因此可能产生不同结果。但是高糖对冠状动脉平滑肌细胞Kv通道的损伤作用是确定的,AGEs在其中起到了重要的媒介作用。
本研究中,AGEs干预冠状动脉平滑肌细胞48 h,观察到Kv通道电流以及通道蛋白表达的变化,但并不意味着AGEs的增加在短期内可使糖尿病患者冠状动脉功能明显受损或冠状动脉粥样硬化斑块形成。Kv通道的损伤主要影响冠状动脉的舒张功能[1],而冠状动脉舒张功能受损仅是糖尿病继发冠状动脉粥样硬化发生发展中的一个环节。而且,体外研究无法将机体本身复杂的病理生理机制和代偿功能完全体现。因此,从AGEs引起Kv通道损伤到临床上2型糖尿病患者发生心血管事件仍需要数年的时间,这段时间的长短亦将受到患者的个体差异及血压、血脂等很多因素的影响。
AGEs对血管的作用机制包括直接作用和与受体RAGE结合产生的间接作用。AGEs可直接损伤血管内皮细胞,如细胞内蛋白的修饰、细胞外基质的交联等。AGE的特异性受体包括RAGE、巨噬细胞表面清道夫Ⅰ型和Ⅱ型受体、半乳糖凝集素-3等,其中RAGE最重要。RAGE是一种属于免疫球蛋白超家族的多配基受体,主要存在于平滑肌细胞、单核巨噬细胞和内皮细胞表面,其启动子含两个核转录因子-κB (nuclear factor-kappa B,NF-κB)功能位点。既往研究[14]结果表明糖尿病患者的内皮依赖性血管舒张功能受损与AGEs/RAGE增高相关。在本研究中,笔者用anti-RAGE IgG干预阻断AGEs/RAGE途径,结果显示AGEs对冠状动脉平滑肌细胞Kv通道的损伤被很大程度地阻断,因此可以推测AGEs损伤冠状动脉平滑肌细胞Kv通道的过程主要通过结合受体RAGE途径来进行。AGEs/RAGE途径在糖尿病血管病变过程中扮演了重要角色[16-17],众多研究[4-6]显示,AGEs与RAGE结合后,可以激活一系列的细胞内信号通路,包括p21ras、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)及NF-κB等,进而激活氧化应激。而氧化应激在多种组织中被证明能够下调钾通道的蛋白和mRNA表达[18-21]。在本课题组前期研究[3]中亦显示,一氧化氮发生过氧化反应所形成的过氧化亚硝酸阴离子能通过使Kv通道蛋白发生硝基化进而引起Kv通道功能明显受损。这些研究结果表明AGEs/RAGE通路诱导的氧化负荷增加可能是高糖损伤冠状动脉平滑肌细胞Kv通道的重要环节。
综上所述,AGEs通过结合RAGE导致冠状动脉平滑肌细胞Kv通道功能受损。由于Kv通道在冠状动脉舒张功能的调节中至关重要,干预AGEs的生成或阻断其作用途径可能会成为保护糖尿病患者Kv通道介导的冠状动脉舒张功能的新靶点。
[1] Li H, Chai Q, Gutterman D D, et al. Elevated glucose impairs cAMP-mediated dilation by reducing Kv channel activity in rat small coronary smooth muscle cells[J]. Am J Physiol Heart Circ Physiol, 2003, 285(3): H1213-H1219.
[2] Ohanyan V, Yin L, Bardakjian R, et al. Requisite Role of Kv1.5 channels in coronary metabolic dilation[J].Circ Res, 2015, 117(7): 612-621.
[3] Li H, Gutterman D D, Rusch N J, et al. Nitration and functional loss of voltage-gated K+ channels in rat coronary microvessels exposed to high glucose[J]. Diabetes, 2004, 53(9): 2436-2442.
[4] Matsui T, Oda E, Higashimoto Y, et al. Glyceraldehyde-derived pyridinium (GLAP) evokes oxidative stress and inflammatory and thrombogenic reactions in endothelial cells via the interaction with RAGE [J]. Cardiovasc Diabetol, 2015, 14: 1.
[5] Wei Q, Ren X, Jiang Y, et al. Advanced glycation end products accelerate rat vascular calcification through RAGE/oxidative stress[J]. BMC Cardiovasc Disord, 2013, 13: 13.
[6] Lander H M, Tauras J M, Ogiste J S, et al. Activation of the receptor for advanced glycation end products triggers a p21(ras)-dependent mitogen-activated protein kinase pathway regulated by oxidant stress[J]. J Biol Chem, 1997, 272(28): 17810-17814.
[7] van Eupen M G, Schram M T, Colhoun H M, et al. Plasma levels of advanced glycation endproducts are associated with type 1 diabetes and coronary artery calcification [J]. Cardiovasc Diabetol, 2013,12: 149.
[8] Sveen K A, Nerdrum T, Hanssen K F, et al. Impaired left ventricular function and myocardial blood flow reserve in patients with long-term type 1 diabetes and no significant coronary artery disease: associations with protein glycation[J]. Diab Vasc Dis Res, 2014, 11(2): 84-91.
[9] 李卫萍, 李虹伟, 沈絮华, 等. 大鼠冠状动脉平滑肌细胞的原代培养及鉴定[J]. 中国心血管杂志, 2011, 16(4): 309-311.
[10]Zhao L M, Wang Y, Ma X Z, et al. Advanced glycation end products impair K(Ca)3.1- and K(Ca)2.3-mediated vasodilatation via oxidative stress in rat mesenteric arteries[J]. Pflugers Arch, 2014, 466(2): 307-317.
[11]de Oliveira Silva C, Delbosc S, Arais C, et al. Modulation of CD36 protein expression by AGEs and insulin in aortic VSMCs from diabetic and non-diabetic rats[J]. Nutr Metab Cardiovasc Dis, 2008, 18(1): 23-30.
[12]Jackson W F. Ion channels and vascular tone[J]. Hypertension, 2000, 35(1Pt2): 173-178.
[13]Bubolz A H, Li H, Wu Q, et al. Enhanced oxidative stress impairs cAMP-mediated dilation by reducing Kv channel function in small coronary arteries of diabetic rats [J]. Am J Physiol Heart Circ Physiol, 2005, 289(5): H1873-H1880.
[14]Gao X, Zhang H, Schmidt A M, et al. AGE/RAGE produces endothelial dysfunction in coronary arterioles in type 2 diabetic mice [J]. Am J Physiol Heart Circ Physiol, 2008, 295(2): H491-H498.
[15]Lee I S, Yu S Y, Jung S H, et al. Proanthocyanidins from Spenceria ramalana and their effects on AGE formation in vitro and hyaloid-retinal vessel dilation in larval zebrafish in vivo [J]. J Nat Prod, 2013, 76(10): 1881-1888.
[16]Kajikawa M, Nakashima A, Fujimura N, et al. Ratio of serum levels of AGEs to soluble form of RAGE is a predictor of endothelial function[J]. Diabetes Care, 2015, 38(1): 119-125.
[17]McVicar C M, Ward M, Colhoun L M, et al. Role of the receptor for advanced glycation endproducts (RAGE) in retinal vasodegenerative pathology during diabetes in mice[J]. Diabetologia, 2015, 58(5): 1129-1137.
[18]Elvira B, Warsi J, Munoz C, et al. SPAK and OSR1 sensitivity of voltage-gated K+ channel Kv1.5[J]. J Membr Biol, 2015, 248(1): 59-66.
[19]Chapalamadugu K C, Panguluri S K, Bennett E S, et al. High level of oxygen treatment causes cardiotoxicity with arrhythmias and redox modulation[J]. Toxicol Appl Pharmacol, 2015, 282(1): 100-107.
[20]Kurokawa S, Niwano S, Niwano H, et al. Cardiomyocyte-derived mitochondrial superoxide causes myocardial electrical remodeling by downregulating potassium channels and related molecules[J]. Circ J, 2014, 78(8): 1950-1959.
[21]王莉, 俞春江,刘伟. 急性脑梗死患者的可溶性糖基化终产物受体表达及其影响因素分析[J]. 中国脑血管病杂志,2014,11(9):461-465,504.
编辑 孙超渊
Advanced glycation end products impair voltage-gated K+channels in coronary vascular smooth muscle cells
Su Wen1,Li Hongwei1,Chen Hui1,Liu Huirong2,Huang Haixia2,Li Weiping1*
(1.DepartmentofCardiology,BeijingFriendshipHospital,CapitalMedicalUniversity,Beijing100050,China; 2.DepartmentofPhysiologyandPathophysiology,SchoolofBasicMedicalSciences,CapitalMedicalUniversity,Beijing100069,China)
Objective To investigate the role of advanced glycation end products (AGEs) in impairment of voltage-gated K+(Kv) channels in rat coronary vascular smooth muscle cells (VSMCs). Methods We isolated rat coronary VSMCs. The cells were incubated either in control medium, or medium with 100 μg/mL AGE-bovine serum albumin (AGE-BSA), or medium with 100 μg/mL AGE-BSA plus 100 μg/mL anti-receptor of AGEs immunoglobulin G (anti-RAGE IgG). Patch-clamp recording was used to assess the Kvcurrents. Western blotting and quantitative real-time PCR techniques were used to assess protein and mRNA expression of Kv1.2 and Kv1.5. Results Incubation of VSMCs with AGE-BSA reduced Kvcurrent density by 32.7% and decreased both protein and mRNA expression of Kv1.2 and Kv1.5 channels, whereas blocking AGE-BSA interacting with their receptors by preincubation with anti-RAGE IgG for 30 minutes prevented AGE-BSA-induced impairment of Kvchannels.Conclusion AGEs impair Kvchannels in coronary VSMCs by interacting with RAGE.
advanced glycation end products; voltage-gated K+channels; coronary vascular smooth muscle cells; receptor of advanced glycation end products
国家自然科学基金(30971240),北京市自然科学基金(7122053),北京市卫生系统高层次卫生技术人才资助项目(2013-3-060)。This study was supported by National Natural Science Foundation of China(30971240), Natural Science Foundation of Beijing (7122053),High-level Technical Talents Foundation in Beijing Health System (2013-3-060).
时间:2016-12-14 20∶19
http://www.cnki.net/kcms/detail/11.3662.r.20161214.2019.030.html
10.3969/j.issn.1006-7795.2016.06.002]
R 36
2016-10-03)
*Corresponding author, E-mail:xueer09@163.com

