马铃薯晚疫病菌交配型检测方法比较
缪云琴,孟然然,唐 唯,杨 仙,李灿辉
(云南师范大学薯类作物研究所, 云南 昆明 650500)
马铃薯晚疫病菌交配型检测方法比较
缪云琴,孟然然,唐 唯,杨 仙,李灿辉*
(云南师范大学薯类作物研究所, 云南 昆明 650500)
晚疫病是云南省马铃薯第一大病害,近年在云南省种植区有逐年加重的趋势,从1998年发现晚疫病菌的2种交配型以来,有性生殖的风险也随之增加。文章以2010年来自云南省马铃薯主产区的86个晚疫病菌菌株为材料,以对峙培养检测法检测结果为准,比较分析了CAPs标记和A2特异性DNA片段扩增方法的准确性。研究证实了2种分子标记检测方法均可以准确检测出晚疫病菌A1和A2交配型,但不能区分A2和A1A2交配型。A2交配型占总菌株的82.56 %,在云南省所有马铃薯主产区都存在,已成为云南省晚疫病菌群体中的优势交配类型。
晚疫病菌;交配型;对峙培养;分子标记检测
马铃薯晚疫病菌(Phytophthorainfestans)属异宗配合卵菌,存在A1和A2两种交配型。A2交配型最早在墨西哥发现,20世纪80年代后,迅速传播至全球几乎所有马铃薯生产国家[1-3]。1996年,中国首次报道发现马铃薯晚疫病菌A2交配型[4]。不同交配型菌株并存,意味着晚疫病菌群体有可能进行有性生殖。有性生殖不仅可产生致病性和适应性更强的后代群体;产生的卵孢子还可成为新的侵染源,导致晚疫病发生和流行规律出现新的变化,进一步严重威胁全球马铃薯的生产[5]。为此,有关A2交配型菌株的传播及其对马铃薯晚疫病菌群体结构的影响等研究,引起了国内外的极大关注。
由于独特的自然地理环境和气候条件,云南省一年四季均有马铃薯大面积种植,晚疫病周年发生。1998年,云南省发现马铃薯晚疫病菌A2交配型[6]。此后报道表明,A2交配型菌株仅局限于个别地方发现,且出现的频率极低;但同期云南省马铃薯晚疫病菌群体的多样性却较高[7]。近年来,随着种薯的大规模调运,病原菌传播速度加快,马铃薯晚疫病流行所造成的危害明显增加。所以,及时监测马铃薯晚疫病菌群体的结构变化,尤其A2交配型的出现和传播,对该流行性病害综合治理具有重要的价值。
迄今,国内外通常采用对峙培养方法检测马铃薯晚疫病菌的交配型[1-7]。但该方法耗时费力,不便于对快速演化的晚疫病菌群体进行及时的监测。1995年,Judelson等报道了一些与晚疫病菌交配型决定位点紧密连锁的分子标记[8-9]。2002年,Kim和Lee利用AFLP方法,开发出可特异性检测A2交配型的DNA分子标记[10]。国外已有报道表明,Judelson报道的CAPs标记可准确检测A1和A2交配型[11-12]。为此,本实验利用多样性较丰富的云南省马铃薯晚疫病菌群体样本,对交配型分子标记检测和传统的对峙培养检测方法进行了比较,意在寻找快速有效的晚疫病菌交配型监测方法。
1 材料与方法
1.1 晚疫病菌的采集与分离纯化
1.1.1 晚疫病菌的采集 2010年2-10月,从云南省不同生产季节的马铃薯主产区采集主栽品种(合作88,会-2)的晚疫病样本,分别用保鲜袋带回实验室。
1.1.2 晚疫病菌的分离纯化 参照Cornell大学方法[13],在培养皿底部铺双层吸水纸,用适量蒸馏水浸湿,将带单个病斑的叶片正面向上放在吸水纸上,用保鲜膜覆盖培养皿以保持皿内的相对湿度,室内散射光条件下(15~23 ℃)诱发培养1~3 d。待病斑周围有菌丝生长时,在超净工作台上挑取少量菌丝体接种到选择培养基中,于17~18 ℃黑暗条件下培养4~5 d。待有纯净菌丝长出后,沿着菌落边缘小心挑取少量菌丝,接种在新配制的选择培养基或黑麦琼脂培养基A上分离培养;根据分离培养菌落的形态特征,进一步进行单孢或单菌丝分离纯化培养。将纯化后的菌株转接至黑麦琼脂培养基B上保存;2010年共分离纯化获得86个马铃薯晚疫病菌(表2)。
1.2 晚疫病菌交配型检测
1.2.1 对峙培养检测方法 将待测菌株和已知交配型的标准菌株分别接种至黑麦-V8蔬菜汁(10 %)琼脂培养基上,在17~18 ℃黑暗条件下培养10~15 d。然后,分别取待测菌株和A1交配型标准菌株(80029)或A2交配型标准菌株(88133)的菌块,以3 cm的间距转接到直径为9 cm的对峙培养皿中,在17~18 ℃黑暗条件下培养约15 d。观察对峙培养菌株的生长情况,并在2个菌落交融处的培养基表面取样,制作简易封片,在光学显微镜下观察是否有卵孢子形成(图1)。
在对峙培养中,若待测菌株仅与A2交配型标准菌株对峙产生卵孢子,则待测菌株为A1交配型;反之,若其仅与A1交配型标准菌株对峙产生卵孢子,则为A2交配型;若待测菌株分别与A1和A2交配型标准菌株对峙培养都有卵孢子产生,但继代繁殖和保存培养期间未发现自发卵孢子形成,则将其定义为A1A2型;若待测菌株本身就能产生卵孢子,则定义为自育(Self-fertile)型。
1.2.2 分子标记检测方法 按照Mazakova等报道的方法提取马铃薯晚疫病菌基因组DNA[12]。分别采用Judelson等[8]开发的CAPs标记方法和Kim和Lee[10]报道的A2交配型特异性DNA片段扩增方法检测待测菌株的交配类型。所用引物序列和扩增目的片段等见表1。
CAPs标记检测:①PCR反应体系:4 ng的模板DNA,5 μl MgCl2(25 mM),5 μl的10×Buffer,2 μl dNTPs (2.5 mM each),各2 μl的正向和反向引物(10 μM),0.4 μl的Taq酶(5 U/μl),加ddH2O至终体积50 μl。扩增条件为95 ℃ 3 min,(95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,35 cycles),72 ℃ 5min。②PCR产物酶切:取5 μl PCR产物用1 %琼脂糖凝胶电泳检测扩增结果后,取10 μl PCR产物中加入1UBsuRⅠ酶,10×Buffer 2 μl ,100×BSA 0.2μl,补ddH2O至终体积20μl,37 ℃酶切4 h后,95 ℃灭活处理10 min。用2 %琼脂糖凝胶电泳检测酶切结果,存在457 bp+100 bp条带的为A2交配型;既有457 bp+100 bp条带,又有557 bp条带的为A1交配型(图2)。
A2交配型特异性DNA标记检测:①PCR反应体系:4 ng的模板DNA,4 μl MgCl2(25 mM),5 μl的10×Buffer,1 μl dNTPs (2.5 mM each),各1 μl的正向和反向引物(10 μM),0.4 μl的Taq酶(5U/μl),加ddH2O至终体积50 μl。35个循环,退火温度为60 ℃,其余扩增条件同CAPs。②琼脂糖凝胶电泳检测:模板DNA经引物PHYB-1和PHYB-2扩增后,取5 μl PCR产物用2 %琼脂糖凝胶电泳检测。
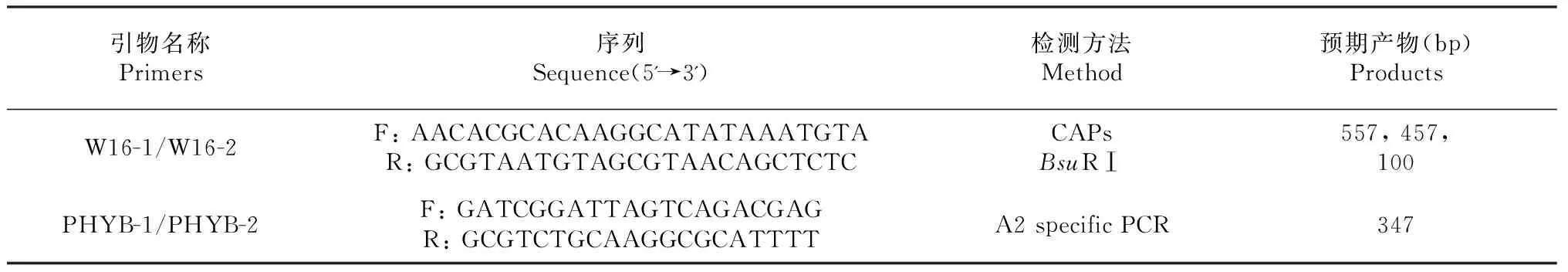
表1 分子标记检测方法信息
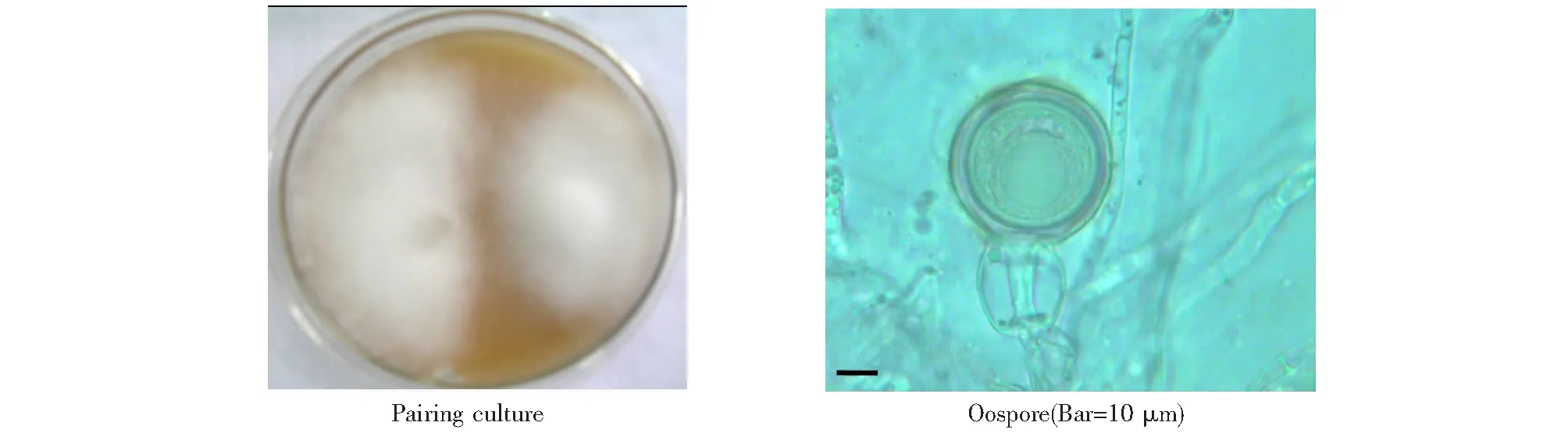
图1 待测菌株交配型对峙培养检测Fig.1 Pairing culture method for mating type detection
2 结果与分析
2.1 对峙培养检测
利用传统的对峙培养方法发现,云南省不同季节马铃薯主产区的晚疫病菌群体中存在A1、A2和A1A2 计3种交配型(图1,表2)。其中,A2交配型菌株比率达所测菌株总数的82.56 %,所有采样地点均已发现;同时,在曲靖、昆明、大理和丽江市的春作马铃薯主产区还检测到一定比率的A1A2交配型菌株,而之前,在全省范围内占绝对优势的A1交配型则仅在个别地点检测到[7,14]。此结果表明,云南省马铃薯晚疫病菌群体的交配类型已经从A1交配型为主体,突然转变为以A2交配型菌株占优势的特殊状态。尽管马铃薯晚疫病菌交配类型的这种突然转变,在英国、荷兰、比利时、法国和北爱尔兰等国家也曾出现过[15];但是,迄今尚不清楚导致这种现象的原因,以及A1A2交配型菌株在其中所起的作用。
2.2 分子标记检测
为了验证上述检测结果,本研究进一步利用Judelson等开发的与晚疫病菌交配型决定位点紧密连锁的CAPs标记[8],及Kim和Lee报道的A2交配型特异性DNA标记[10],对所有待测菌株和标准菌株的交配类型进行了分子标记检测。
根据CAPs标记检测方法,可以清楚地将所有供试菌株区分为A1或A2交配型。仅出现457 bp+100 bp条带的菌株为A2交配型,而同时存在457 bp+100 bp和557 bp条带的菌株则为A1交配型[8, 11](图2)。该标记检测结果与对峙培养中A1和A2交配型的检测结果相吻合;但是,对峙培养检测为A1A2交配型的菌株,CAPs标记检测结果却均为A2交配型(表2)。Judelson基于与晚疫病菌交配型决定位点紧密连锁的其它位点标记检测,也曾报道无法准确区分A2和A1A2交配型(和/或)自育型的结果[9];由此推测,A1交配型决定位点可能属于杂合位点 (Aa),A2交配型可能为纯合 (aa),而A1A2或自育型菌株则可能与三体 (Trisomy, Aaa)的出现或染色体重排有关[9, 16]。
根据A2交配型特异性DNA标记检测方法,也可清楚地将所有供试菌株区分为A1或A2交配型。对峙培养检测为A2和A1A2交配型的菌株中,均可以扩增到分子量为347 bp条带;而A1交配型菌株中,则不存在此扩增产物[10](图3)。所以,此标记检测结果与CAPs标记结果相同,即不能区分对峙培养检测为A2和A1A2交配型的菌株(表2)。但是,如果认为交配型由同一位点的1对等位基因决定,且A1、A2和A1A2或自育型的推测基因型分别为Aa、aa和Aaa[9, 16],则表明A2交配型特异性DNA标记和CAPs标记法所检测的位点不同,或交配型决定位点或紧密连锁区域存在较大片段DNA的缺失。
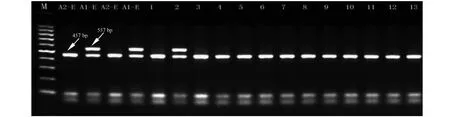
M= MW 100bp ladder;A2-E= reference isolate 88133;A1-E= reference isolate 80029; Line 1 and 2 are isolates collected from Kunming; 3 and 4 from Dali; 5 and 6 from Lijiang; 7 and 8 from Chuxiong; 9 and 10 from Qujing; 11 from Yuxi; 12-13 from Dehong图2 基于CAPs标记(W16-1/16-2)的交配型检测Fig.2 Results of mating type detection based on CAPs marker (W16-1/16-2) method
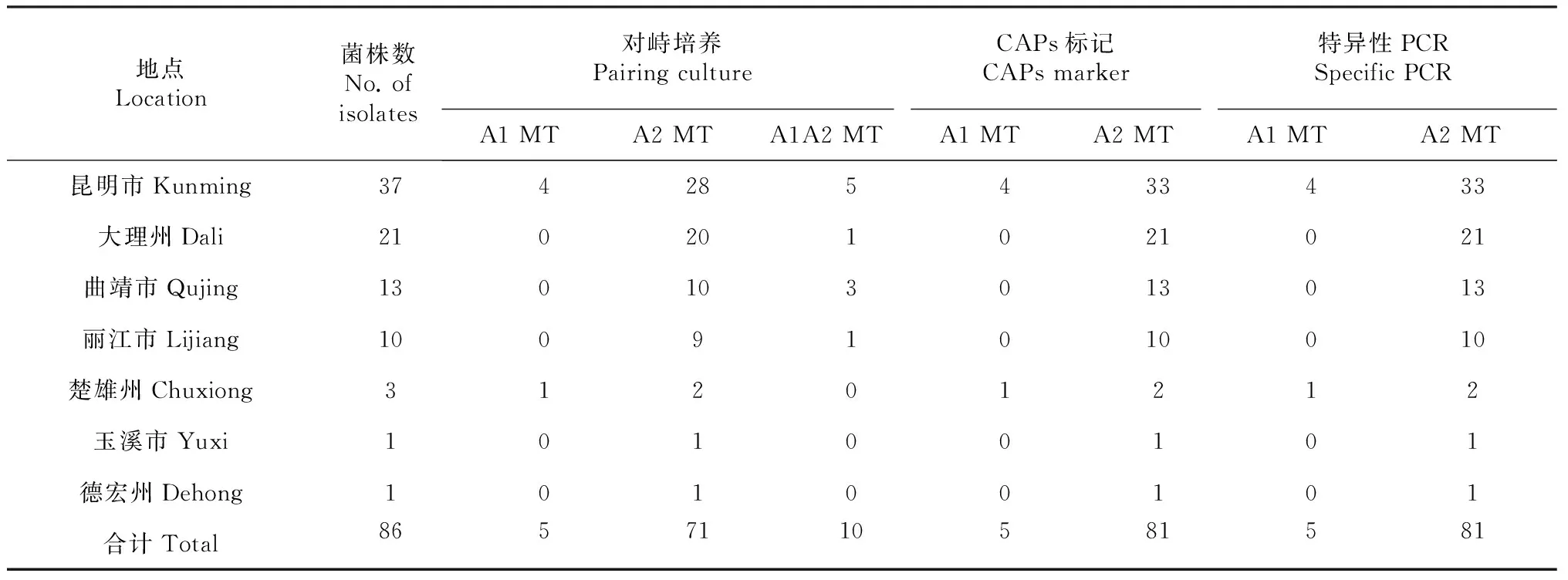
表2 马铃薯晚疫病菌交配型检测结果比较
上述实验结果表明,传统的对峙培养方法可在待测菌株中检测到A1、A2和A1A2 计3种交配型;结合待测菌株的自育型观察,则可鉴别出已报道的4种交配型。而CAPs标记和A2交配型特异性DNA标记方法只能区分A1和A2交配型,无法区分A2和A1A2交配型。
3 讨 论
对峙培养是检测异宗配合晚疫病菌交配型的传统方法,结果直观可靠;但需要拥有已知交配类型的标准菌株和纯化的待测菌株,而且,从待测菌株的分离纯化到对峙培养检测耗时较长,不便于对快速演化的晚疫病菌群体的交配类型进行及时的监测。为此,本研究利用2010年在云南分离纯化的86个马铃薯晚疫病菌菌株,比较了2种国外报道认为可信的交配型分子标记检测方法[ 8-12]。
实验结果表明,与采用传统的对峙培养方法比较,本文章采用的CAPs标记和A2交配型特异性DNA标记方法,可准确检测出A1和A2交配型,但无法区分A2和A1A2交配型。然而,鉴于2种分子标记检测的DNA位点不同,而结果却一致;并与传统的对峙培养方法的检测结果相一致。所以,CAPs标记和A2交配型特异性DNA标记方法可以应用于马铃薯晚疫病菌群体的交配型监测。对于2种分子检测方法得到结果一致,作者认为云南省晚疫病菌群体,可用A2 特异性引物PHYB检测代替CAPs,因为只需1次PCR,省去酶切过程,减少实验可能带来的误差。本实验室下一步将对自育型、A2和A1A2型的菌株进行交配型检测方法的比较及序列分析,期望寻找到一种和对峙培养完全吻合的分子检测方法, 运用于大规模的晚疫病菌群体研究。
一般认为,马铃薯晚疫病菌的交配型受1对等位基因决定: A1交配型可能属于杂合基因型(Aa),A2交配型可能为纯合(aa),而A1A2或自育型菌株则可能与三体(trisomy, Aaa)的出现或染色体重排有关[9, 16]。但是,综合分析CAPs标记和A2交配型特异性DNA标记检测结果,得到的推论却不完全相同。除了2种标记检测的位点不同,以及目前明确的晚疫病菌基因组中存在大量重复片段和重排现象之外[17-18];值得关注的是,马铃薯晚疫病菌为单细胞、多核的二倍体卵菌;异宗配合产生的后代群体,理论上都应该属于杂合体,但却表现出不同的交配类型[17-18], 由此推测,对峙培养中自育型和A1A2交配型的出现可能与培养条件和所用标准菌株有关。
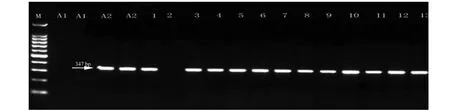
图3 基于A2交配型特异性DNA片段的PCR扩增检测Fig.3 Results of mating type detection based on A2 specific DNA method with same line order
本研究未检测到自育型菌株的出现, 说明2010年田间有性生殖风险较低。本实验结果证实云南省马铃薯晚疫病菌群体的交配型变化与欧洲一些国家类似,出现由A1交配型占绝对优势转变为以A2交配型菌株为主的特殊现象[15], 尽管原因尚不清楚,却暗示晚疫病菌群体的遗传结构可能出现更加复杂的变化。A2交配型的出现和增多,增加了田间有性生殖的可能性,这将直接导致菌株的遗传结构改变、无毒基因变异、抗药性增强及侵染周期的提前,使得云南省马铃薯主栽品种面临抗性丢失及病害大面积发生的危险,因此,下一步急需加强云南省马铃薯晚疫病菌群体的遗传结构的动态监测及流行规律的深入研究工作。
[1]Hohl H R, Iselin K. Strains ofPhytophthorainfestanswith A2 mating type behaviour[J]. Transactions of the British Mycological Society, 1984, 83(3): 529-530.
[2]Tantius P H, Fyfe A M, Shaw D S, et al. Occurrence of the A2 mating type and self-fertile isolates ofPhytophthorainfestansin England and Wales[J]. Plant Pathology, 1986, 35: 578-581.
[3]Shrestha S K, Shrestha K. First report of A1 and A2 mating type ofPhytophthorainfestanson potato and tomato in Nepal[J]. Plant Disease, 1998, 82(9): 1064.
[4]张志铭, 王 军. 中国发生马铃薯晚疫病菌 (Phytopthorainfestans) A2 交配型[J]. 河北农业大学学报, 1996,19(4):62-65.
[5]Fry W E, Goodwin S B. Resurgence of the Irish potato famine fungus[J]. Bioscience, 1997, 47:363-371.
[6]赵志坚, 张志铭. 云南省发现马铃薯晚疫病菌 (Phytophthorainfestans) A2 交配型[J]. 西南农业学报, 1999,12(3):1-3.
[7]Ryu K Y, 罗文富, 杨艳丽, 等. 云南省马铃薯晚疫病菌的交配型, 抗药性及生理小种分布的研究[J]. 植物病理学报, 2003,33(2):126-131.
[8]Judelson H S, Spielman L J, Shattock R C. Genetic mapping and Non-Mendelian segregation of mating type loci in the oomycete,Phytophthorainfestans[J]. Genetic, 1995, 141(2): 503-512.
[9]Judelson H S. Genetic and physical variability at the mating type locus of the oomycete,Phytophthorainfestans[J]. Genetic, 1996, 144(9): 1005-1013.
[10]Kim K J, Lee Y S. Genetic DNA marker for A2 mating type inPhytophthorainfestans[J]. The Journal of Microbiology, 2002, 40(4): 254-259.
[11]Jmour W, Hamada W. First report of A2 mating type ofPhytophthorainfestansin Tunisia using molecular markers and some observations on its metalaxyl resistance[J]. Tunisian Journal of Plant Protection, 2006, 1(2): 85-91.
[12]Mazakova J, Taborsky V, Zouhar M, et al. Occurrence and distribution of mating types A1 and A2 ofPhytophthorainfestans(Mont.) de Bary in the Czech Republic[J]. Plant Protection Science, 2006, 42: 41-48.
[13]Caten C E, Jinks J L. Spontaneous variability of single isolates ofPhytophthorainfestans. I. Cultural variation[J]. Canadian Journal of Botany, 1968, 46(4): 329-348.
[14]赵志坚, 王淑芬, 李成云,等. 云南省马铃薯晚疫病菌交配型分布及发生频率[J]. 西南农业学报, 2001,14(4):55-57.
[15]Yuen J E, Andersson B. What is the evidence for sexual reproduction ofPhytophthorainfestansin Europe?[J]. Plant Pathology, 2013, 62(3): 485-491.
[16]Van der Lee T, Testa A, Robold A, et al. High-density genetic linkage maps ofPhytophthorainfestansreveal trisomic progeny and chromosomal rearrangements[J]. Genetics, 2004, 167(8): 1643-1661.
[17]Martens C, Van de Peer Y. The hidden duplication past of the plant pathogenPhytophthoraand its consequences for infection[J]. BMC Genomics, 2010, 11: 353-369.
[18]Haas B J, Kamoun S, Zody M C, et al. Genomes sequence and analysis of the Irish potato famine pathogenPhytophthorainfestans[J]. Nature, 2009, 461:393-398.
(责任编辑 王家银)
Comparison of Methods for Detecting Mating Type inPhytophthorainfestans
MIAO Yun-qin, MENG Ran-ran, TANG Wei, YANG Xian, LI Can-hui*
(Root and Tuber Crops Research Institute, Yunnan Normal University, Yunnan Kunming 650500,China)
Potato late blight (PLB) was the most serious potato disease in Yunnan, during the decades and PLB became a dominant and persistent problem of potato production, furthermore.The risk of sexual reproduction was going to higher since both two mating type was found in 1998. This research collected 86 isolates ofPhytophthorainfestansfrom the mainly potato planted areas in Yunnan, aimed to compare two PCR methods (CAPs and A2 specific marker) with the paring culture method. The results confirmed that both of the molecular detection methods could distinguish A1 and A2 mating type, but failed to differentiate between A2 and A1A2 mating type. Meanwhile, this research also found that isolates with A2 mating type contributed up to 82.56 % among tested isolates, which was becoming the dominant lineage in Yunnan province.
Phytophthorainfestans; Mating type; Pairing culture; Molecular marker based detection
1001-4829(2016)07-1525-05
10.16213/j.cnki.scjas.2016.07.006
2014-05-30
农业部公益性(农业)行业科研专项(3-20);云南省科技厅(2008CA027、2008PY053和2009BB01)
缪云琴(1987-),女,硕士研究生,生物化学与分子生物学,E-mail: mmiaoyunqin@163.com,*为通讯作者,E-mail: ch2010201@163.com。
S532
A

