牦牛和犏牛睾丸SAMD12基因的克隆测序及其mRNA水平比较
杨 乐,黄 林,金素钰,雷杰雯,郑玉才
(西南民族大学生命科学与技术学院,四川 成都 610041)
牦牛和犏牛睾丸SAMD12基因的克隆测序及其mRNA水平比较
杨 乐,黄 林,金素钰,雷杰雯,郑玉才
(西南民族大学生命科学与技术学院,四川 成都 610041)
SAMD12是新近发现的SAM结构域家族成员.为进一步探究犏牛雄性不育的分子机制,实验从健康成年牦牛(n=10)和雄性不育犏牛(n=7)睾丸组织中提取总RNA,利用常规基因克隆技术,对牦牛SAMD12基因进行克隆测序,并采用实时荧光定量PCR技术,比较牦牛和犏牛睾丸中SAMD12基因mRNA水平.结果本实验克隆获得了牦牛SAMD12基因的3种变异体,分别命名为v715、v779和v852.v715与普通牛5号变异体完全对应;v779含SAM结构域但与普通牛序列存在一些差异,可能是SAMD12基因的新变异体类型;v852无结构域部分可能不表现活性.定量PCR结果显示:SAMD12基因在牦牛和犏牛睾丸中均有表达,但表达量差异不显著,推测其表达水平与犏牛雄性不育无直接关系.
牦牛;犏牛;睾丸;SAMD12基因;杂交雄性不育
犏牛是母牦牛(Bos grunniens)与普通牛(Bos taurus)的杂交后代,其体型、产肉和产乳等生产性能均显著高于牦牛,但F1~F3代为雄性不育,无法产生正常的精子[1],影响了杂种优势的利用.犏牛雄性不育的分子机制尚不清楚,已有研究推测可能涉及多种基因的异常表达[2-4].本实验室前期研究也发现,多种功能各异的基因或蛋白质,在牦牛和犏牛睾丸中表达存在显著差异,包括杂交不育基因PRDM9[5]、多种蛋白质[6]、Msh4基因和FABP5基因等[7-8].
SAM是一类新发现的结构域,为包含70个氨基酸残基的结构模体,存在于很多蛋白质中,在物种进化中具有高度保守性[9-11].该结构域包含磷酸化位点和磷酸激酶位点,能与蛋白质、RNA以及膜脂质相互作用,并作用于蛋白质同源化、异二聚化和寡聚化等信号转导的调控[12-15].根据目前已报导的相关研究发现,该结构域家族中的基因在表达调控、细胞分化、胚胎的发育、分化及成熟等方面发挥着相当重要的作用[16-18].SAMD12是SAM基因家族成员,普通牛中位于14号染色体上[19],包含9个外显子,目前其具体特性及功能方面的研究还未见报道.
本实验室前期对牦牛和雄性不育犏牛睾丸差异表达的miRNA分析发现,SAMD12是差异表达最大的一种miRNA的预测靶基因(李彩霞等,2016,待发表资料)[20].因此,本研究的假设是SAMD12基因在牦牛精子发生过程中发挥重要作用.实验通过常规基因克隆技术对牦牛SAMD12基因进行克隆测序,并用荧光定量PCR方法,对牦牛和雄性不育犏牛睾丸中SAMD12基因的相对表达量进行比较,以探索其与犏牛雄性不育的关联.
1 材料与方法
1.1 样品的采集
在成都市青白江区某屠宰场采集麦洼牦牛(Bos grunniens)和犏牛(母麦洼牦牛与公黄牛的杂交后代)的睾丸组织.10头健康的成年公牦牛和7头公犏牛屠宰后立即取其睾丸,纵切面剖开后迅速置于干冰中运回实验室,置于-80℃冰箱保存备用.
1.2 主要试剂和仪器
Trizol Reagent,由美国Ambion公司生产;RevertAid First Strand cDNA Synthesis Kit,由美国Thermo Scientific公司生产;QuantiFast SYBR Green PCR Kit,由德国QIAGEN公司生产;Long Taq DNA Polymerase,由美国GeneCopoeia公司生产;DL2000 Marker、DH5α感受态细胞由天根生化科技(北京)有限公司生产.
CFX 96荧光定量PCR仪和Versa Doc 1000凝胶成像系统,由美国Bio-Rad公司生产;Biowave DNA紫外可见分光光度计,由英国Biochrom公司生产;CR21G高速冷冻离心机,由日本日立公司生产.
1.3 睾丸总RNA的提取及反转录
按照Trizol试剂说明提取牦牛和犏牛睾丸总RNA,并用紫外分光光度计测定其浓度和纯度.用RevertAid First Strand cDNA Synthesis Kit以4 μg总RNA为模板,进行反转录,得到cDNA第一链,具体操作方法参照试剂盒说明书.
1.4 牦牛睾丸SAMD12基因的克隆测序
参照GenBank中的普通牛SAMD12基因预测序列(登录号:XM_015474468),用Premier 5.0软件设计PCR引物.上游引物:5'-TGGAGAGCTGGGTGATGCTGAG-3',下游引物:5'-GGACAGCAGCTTGGAAGGCTAAC-3',预期产物长度715 bp.
以反转录得到的牦牛睾丸cDNA为模板,用PCR对SAMD12基因进行扩增,PCR反应体系:2×Long Taq DNA Polymerase 12.5 μL、上下游引物各1 μL、模板cDNA 1.5 μL,加灭菌纯水至总体积25 μL.扩增条件:95℃预变性4 min,95℃变性30 s,59℃退火30 s,72℃延伸1min,共35个循环;72℃5 min,4℃保存.扩增产物用1.5%琼脂糖凝胶电泳检测.用Cycle-Pure Kit(100)试剂盒进行纯化回收,然后将纯化回收的产物连接到pMD-19载体上,再转入DH5α感受态细胞中,通过蓝、白斑筛选和菌液PCR方法鉴定阳性克隆.将筛选的对应不同扩增长度的阳性克隆各取3管菌液,送上海生工生物工程有限公司进行双向测序.用DNAMAN 4.0、SMART、ProtParam等软件,分别对其碱基序列和氨基酸序列进行分析.
1.5 睾丸中SAMD12基因的定量PCR分析
参考本研究获得的牦牛睾丸SAMD12基因序列以及GenBank中普通牛SAMD12基因的mRNA序列(登录号:NM_001191180)设计定量PCR引物,上游引:5'-ACCCTGCCCATGGTGAAGGTA-3',下游引物:5'-AGCAGGGCTCGCCCAGTTATA-3',预期产物长度286 bp.两个内参基因为18sRNA和GAPDH,相关信息见本实验室前期发表的文章[11].将反转录获得的牦牛睾丸cDNA进行常规PCR扩增,并优化退火温度,产物用1.5%琼脂糖凝胶电泳检测,将最亮条带对应的PCR产物进行10倍梯度稀释,然后以稀释后梯度浓度为104~109拷贝数/mL的产物为模板,进行荧光定量PCR扩增,制作标准曲线.
以反转录得到的牦牛(n=10)和犏牛(n=7)睾丸cDNA为模板,采用实时荧光定量PCR方法检测SAMD12基因在其中的相对表达量.25 μL反应体系:RNase-free water 9.5 μL,模板cDNA 1 μL,2×Quanti-Fast SYBR Green PCR Master Mix 12.5 μL,基因的上、下游引物各1 μL.扩增条件:95℃预变性5 min,95℃变性15 s,退火(SAMD12:62℃20s;18sRNA:60℃15 s;GAPDH:60℃20 s),72℃延伸15 s,共40个循环,65℃ˉ95℃制作融解曲线.每个样品做两个重复.
1.6 数据统计
通过2-△△Ct法计算SAMD12基因在牦牛和犏牛睾丸组织中的相对表达量[21],以其在牦牛睾丸中的表达量为对照,用内参基因18sRNA和GAPDH的几何平均数进行校准.实验数据用平均值±标准误表示,用SPSS19.0进行定量结果的统计分析.
2 结果
2.1 牦牛SAMD12基因的克隆测序
根据GenBank中普通牛SAMD12基因的预测序列设计的PCR引物,从牦牛睾丸总RNA中扩增出了特异条带(图1,泳道1),经常规克隆后得到3种长度不同的条带或称变异体(图1,泳道2~4).3种变异体分别进行测序并与GenBank数据库比对,结果与普通牛SAMD12基因的匹配度均达到99%以上,证实其均为牦牛SAMD12基因.3种变异体与普通牛SAMD12基因最长的预测变异体(GenBank登录号: XM_015474468)CDS编码区匹配的序列相比,均存在3个碱基差异(以普通牛为参照,普通牛CDS编码区的第402位为A,3头牦牛均为G;第450位,普通牛为C,3头牦牛均为T;第516位,普通牛为T,3头牦牛均为C).3条剪接体序列现已提交至GenBank(登录号:KX821660;KX821661;KX821662).
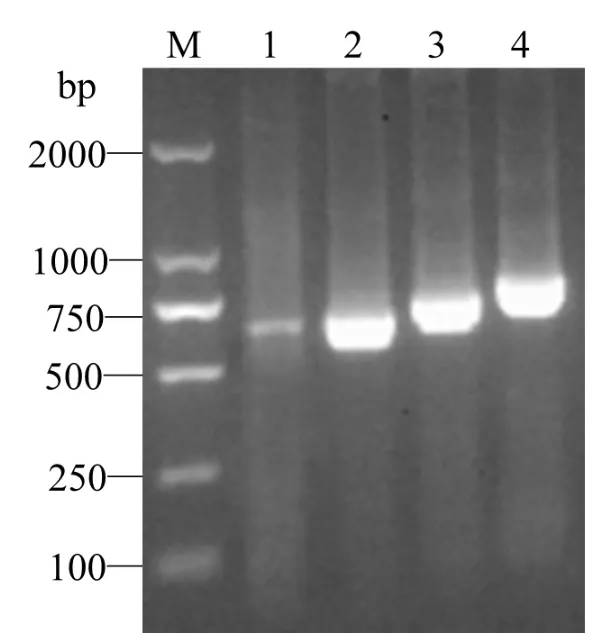
图1 牦牛SAMD12基因RT-PCR产物及克隆产物的琼脂糖凝胶电泳M:DL2000 Marker,1:RT-PCR产物;2~4:克隆出的牦牛SAMD12基因的3种变异体Fig.1 Agarose gel electrophoresis of RT-PCR and cloning products SAMD12 gene of yak M:DL2000 marker,1:RT-PCR products,2~4;Cloning 3 variants of yak SAMD12 gene
测出的牦牛SAMD12基因1号变异体(v715)序列全长715 bp,编码228个氨基酸,理论分子量为25.47 ku,预测等电点为6.25,与普通牛的5号变异体(登录号:XM_015474469)完全对应;牦牛2号变异体(v779)长779 bp,编码259个氨基酸,理论分子量为29.13 ku,预测等电点为6.60,除前半部分与普通牛共有氨基酸序列完全相同之外,后面还有38个氨基酸与普通牛的各预测序列均不匹配;牦牛3号变异体(v852)长852 bp,仅编码132个氨基酸,理论分子量为14.42 ku,预测等电点为5.04.
NCBI中普通牛SAMD12基因的变异体预测序列共有7种,用SMART软件对各变异体进行分析后得知,其编码的前221个氨基酸序列均相同,且均包含SAM结构域序列.测出的牦牛v715、v779变异体与普通牛的各变异体相同部分的氨基酸序列均完全对应,也都包含SAM结构域,牦牛v852变异体无SAM结构域序列.牦牛SAMD12基因的3种变异体与普通牛最长的变异体2号以及普通牛5号变异体氨基酸序列比对情况如图2所示,普通牛氨基酸序列的第141位~第210位为SAM结构域序列,图2中已标出.
2.2 牦牛睾丸SAMD12基因的RT-PCR扩增结果
根据本研究获得的牦牛睾丸SAMD12基因序列以及GenBank中普通牛SAMD12基因的mRNA序列设计的定量PCR引物,从牦牛睾丸cDNA中扩增出特异性高的产物,条带较亮、无杂带,且与预期片段长度相符(图3).SAMD12基因在退火温度为62℃时的PCR产物条带最亮,可作为定量PCR的退火温度.
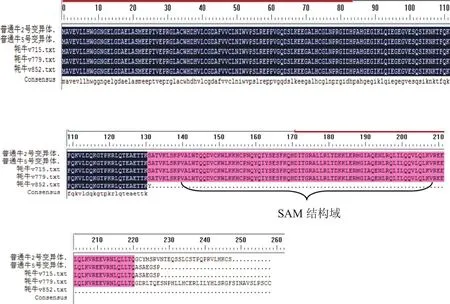
图2 牦牛SAMD12基因的3种变异体与普通牛2号、5号变异体氨基酸序列比对图Fig.2 Alignment of partialdeduced amino acid sequences of 3 variants of SAMD12 gene of yak with those of variant 2 and variant 3 of cattle
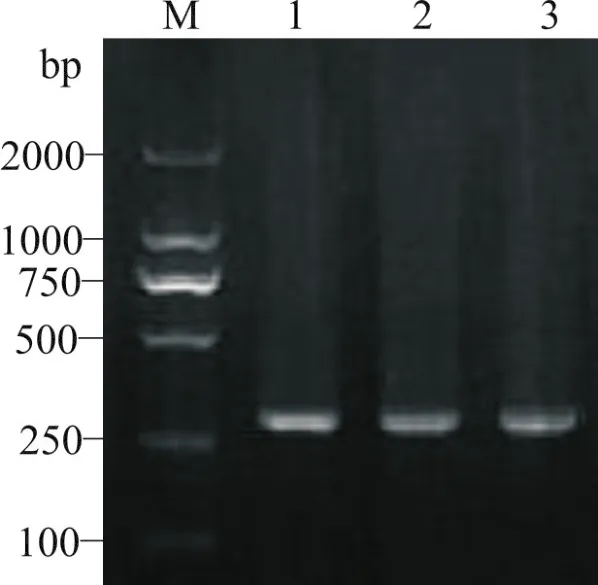
图3 牦牛SAMD12基因RT-PCR产物的琼脂糖凝胶电泳M:DL2000 Marker,1~3的退火温度分别为62℃、64℃和66℃Fig.3 Agarose gel electrophoresis of RT-PCR products SAMD12 gene of yak M:DL2000 Marker,The annealing temperature of 1~3 is 62℃,64℃and 66℃
以18sRNA和GAPDH为内参基因,对牦牛和犏牛睾丸中的SAMD12基因mRNA水平进行荧光定量PCR检测,其扩增效率为93.7%,符合Bio-Rad荧光定量PCR仪有效扩增效率为92%~105%的要求.标准曲线线性关系良好(R2>0.99),融解曲线峰单一,表明对SAMD12基因进行了特异性扩增.两个内参基因的融解曲线及SAMD12基因的标准曲线和融解曲线见图4.
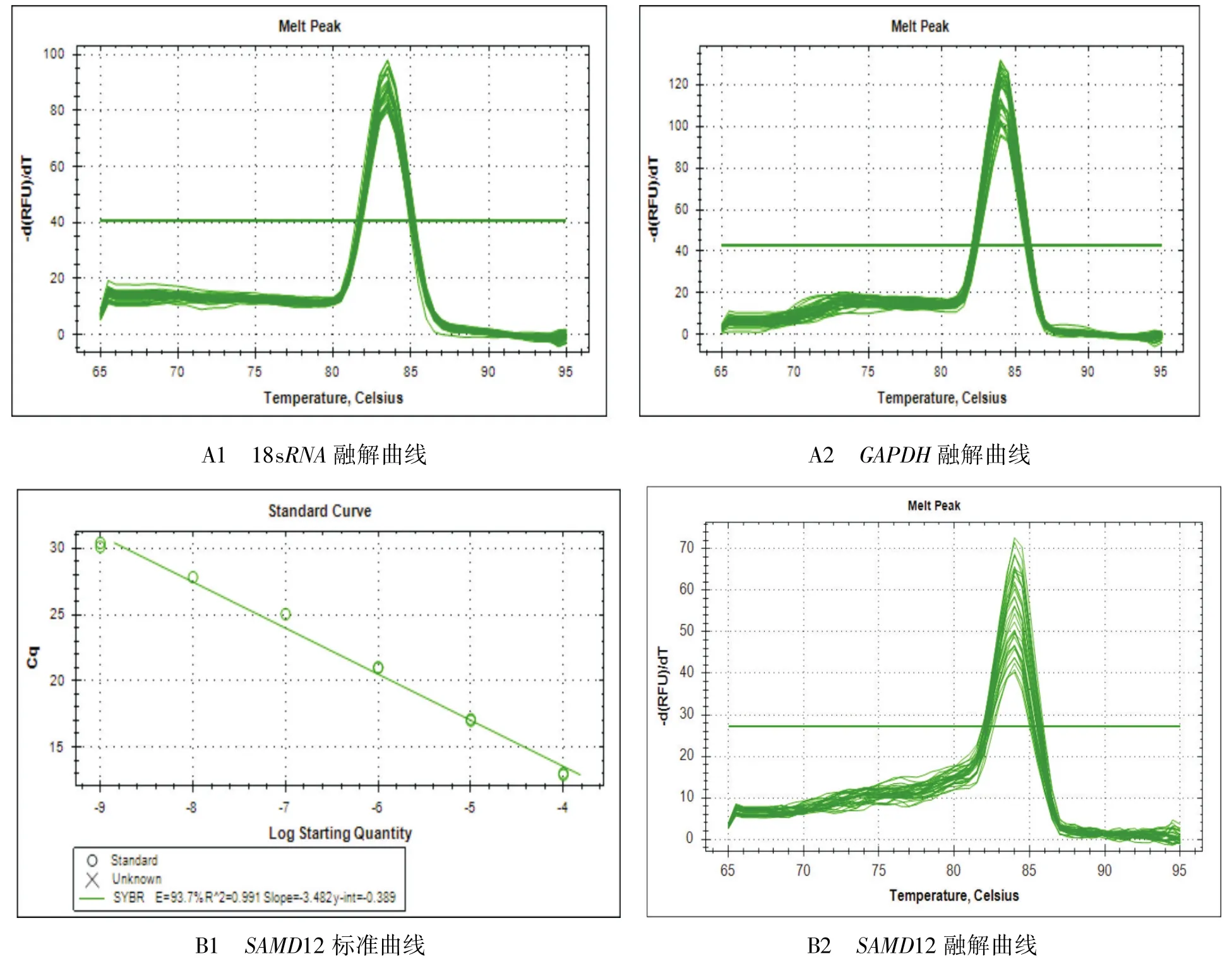
图4 SAMD12基因及内参基因定量PCR的标准曲线/融解曲线A1、A2:内参基因定量的融解曲线;B1、B2:SAMD12基因的标准曲线和融解曲线Fig.4 Standard curve/melting curve of quantitative PCR of SAMD12 gene and reference genes A1、A2:The melting curve of reference genes for quantitative;B1、B2:The standard curve and melting curve of SAMD12 gene
2.3 SAMD12基因在牦牛和犏牛睾丸组织中的表达
定量PCR结果显示,SAMD12基因在成年牦牛(n=10)和成年不育犏牛(n=7)睾丸中均有表达,但mRNA水平差异不显著(图5).
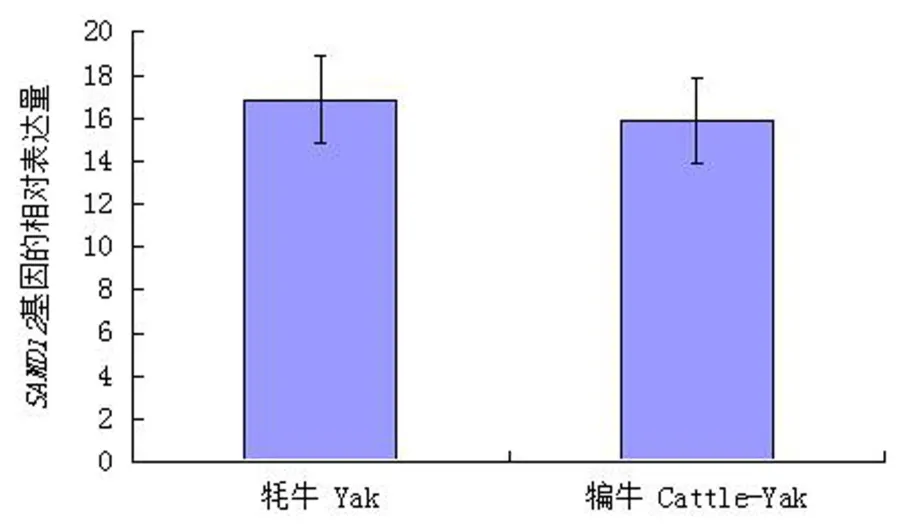
图5 牦牛和犏牛睾丸中SAMD12基因mRNA水平Fig.5 mRNA levels of SAMD12 gene in the testes of yaks and cattle-yaks
3 讨论
SAM结构域存在于很多蛋白质中,并且在物种进化中具有高度保守性,已发现的该结构域家族中的基因在表达调控、细胞分化、胚胎的发育、分化及成熟等方面发挥着重要的作用.本研究根据普通牛SAMD12基因的序列设计引物,通过常规基因克隆技术,成功地从牦牛睾丸中克隆出了SAMD12基因的3种变异体,其中变异体v715对应普通牛2号预测变异体,且对应部分氨基酸序列完全相同,体现了SAMD12基因在普通牛和牦牛上的高度保守性.对SAMD12结构域的分析表明,SAMD12可能主要通过该结构域发挥其基本的功能和作用[12-18],对已公布的普通牛SAMD12基因的7种预测变异体以及测出的牦牛3种变异体进行分析后,结果发现普通牛的7种变异体以及牦牛变异体v715和变异体v779均保留了SAM模体部分,而且结构域起始位置及氨基酸序列完全一致,显示了SAM结构域在物种进化中高度的保守性;变异体v779经过比对显示,其可能是在牛上未发现的SAMD12基因的一种新的变异体形式;牦牛变异体v852由于编码蛋白序列较短而且未保留SAM结构域部分,推测其可能无活性.目前对SAMD12基因的研究甚少,对其复杂的剪接变异机制也尚未可知,新变异体的发现以及各变异体在牦牛中的表达情况还有待后续研究.
已有报道[2,7]及本实验室前期在对犏牛雄性不育机制的研究中发现,多种功能各异的基因或蛋白质,其中大部分在牦牛和雄性不育犏牛睾丸中的表达都存在显著甚至极显著差异.本次实验的荧光定量PCR结果显示,SAMD12基因在牦牛和雄性不育犏牛睾丸中表达量差异并不显著,推测其可能不是导致犏牛雄性不育的关键调控因素.
[1]张旭静.牦牛和普通牛种间杂种公牛睾丸的组织学观测与研究[J].畜牧兽医学报,2001,32(4):314-318.
[2]金帅,郭宪,包鹏甲,等.牦牛和犏牛Dmrt7基因序列分析及其在睾丸组织中的表达水平[J].中国农业科学,2013,5:1036-1043.
[3]屈旭光.联会复合体相关基因与犏牛雄性不育关系的研究[D].南京:南京农业大学,2008.
[4]曾贤彬,柴志欣,王永,等.犏牛精子发生阻滞的比较转录组研究[J].中国科学(生命科学),2014,6:584-601.
[5]LOU YN,LIU WJ,WANG CL,et al.Histological evaluation and Prdm9 expression level in the testis of sterile male cattle-yaks[J].Livest Science,2014,160:208-213.
[6]付伟,李彩霞,刘文静,等.牦牛和雄性不育杂交后代睾丸组织差异表达核蛋白的双向电泳分析[J].西北农业学报,2015,1:1-6.
[7]曾琴,黄林,金素钰,等.牦牛和犏牛睾丸组织Msh4基因mRNA表达差异的研究[J].黑龙江畜牧兽医,2013,11:62-64.
[8]付伟,黄林,刘文静,等.牦牛和雄性不育犏牛睾丸FABP5和FABP9基因mRNA水平及能量代谢相关酶活力的比较[J].畜牧兽医学报,2015,4:561-567.
[9]PONTING CP.SAM:a novel motif in yeast sterile and Drosophila polyhomeotic proteins[J].Protein Science,1995,4(9):1928-1930.
[10]BARRERA FN,POVEDA JA,GONZALEZ-ROS JM,et al.Binding of the C-terminal sterile alpha motif(SAM)domain of human p73 to lipid membranes[J].Journal of Biological Chemistry,2003,278(47): 46878-46885.
[11]CHULTZ J,PONTING CP,HOFMANN K,et al.SAM as a protein interaction domain involved in developSmental regulation[J].Protein Science,1997,6(1):249-253.
[12]THANOS CD,GOODWILL KE,BOWIE JU.Oligomeric structure of the human EphB2 receptor SAM domain[J].Science,1999,283 (5403):833-836.
[13]ZHE C,WILLIAM H,JOHN M S.Mutation of mouse Samd4 causes leanness,myopathy,uncoupled mitochondrial respiration,and dysregulated mTORC1 signaling[J].Proceedings of the National Academy of Sciences of the United States of America,2014,111(20):7367–7372.
[14]DAVID RN,SARAH EJ,ALEXANDER BT.Multiple polymer architectures of human Polyhomeotic homolog 3(PHC3)SAM[J].Proteins,2014,82(10):2823–2830.
[15]CATHERINE NL,MARY JK,DUILIO C.Characterization of the SAM domain of the PKD-related protein ANKS6 and its interaction with ANKS3[J].BMC Structural Biology,2014,14:17.
[16]LUO N,LI G,LI Y,et al.SAMD4B,a novel SAM-containing protein,inhibits AP-1-,p53-and p21-mediated transcriptional activity[J].BMB Reports,2010,43(5):355-361.
[17]黎冠.人类心脏发育候选基因SAMD4B的研究[D].长沙:湖南师范大学,2007.
[18]RICE GI,BOND J,ASIPU A,et al.Mutations involved in Aicardi-Goutieres syndrome implicate SAMHD1 as regulator of the innate immune response[J].Nature Genetics,2009,41:829-832.
[19]ZIMIN AV,DELCHER AL,FLOREA L,et al.A whole-genome assembly of the domestic cow,Bos taurus[J].Genome Biology,2009,10(4): R42.
[20]付伟,李彩霞,刘文静,等.利用双向电泳-质谱技术鉴定牦牛和犏牛睾丸中的差异表达蛋白质[J].西南民族大学学报(自然科学版),2014,40(1):11-15.
[21]LIVAK KJ,SCHMITTGEN TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) [J].Methods,2001,25(4):402-408.
(责任编辑:李建忠,付强,张阳,罗敏;英文编辑:周序林,郑玉才)
Cloning and comparison of mRNA level of SAMD12 gene in the testes of yaks and cattle-yaks
YANG Le,HUANG Lin,JIN Su-yu,LEI Jie-wen,ZHENG Yu-cai
(School of Life Science and Technology,Southwest University for Nationalities,Chengdu 610041,P.R.C.)
SAMD12 is a member of the newly discovered SAM motif family.To explore the molecular mechanism of male sterility of cattle-yaks,total RNAs were extracted from the testes of healthy adult yaks(n=10)and sterile cattle-yaks(n=7),and SAMD12 gene was cloned and sequenced using routine gene cloning technique.The mRNA level of SAMD12 gene in the testes of yaks and cattle-yaks was assayed based on real-time quantative PCR.This study obtained 3 variants of yak SAMD12 gene,and named as v715,v779 and v852 respectively.v715 has the same sequence as bovine SAMD12 variant 5;v779 contains the SAM motif but shows some differences when compared with variants of bovine SAMD12 gene,thus it is probably a new variant not reported in cattle;v852 does not have SAM motif and mostly shows no activity.Quantative PCR assay showed that SAMD12 gene was expressed in both yak and cattle-yak testes,however,the expression level was similar,suggesting that its abundance has no direct relationship with the male sterility of cattle-yaks.
yak;cattle-yak;testis;SAMD12;hybrid male sterility
S813;S823
A
2095-4271(2016)05-0525-06
10.11920/xnmdzk.2016.05.010
2016-07-19
郑玉才(1965—),男,汉族,教授,博士,研究方向:高原动物生化与分子遗传.E-mail:yucaizheng65@hotmail.com
国家自然科学基金资助课题(31240053)

