甲状腺乳头状癌组织中Smad4基因表达水平及其意义研究
黄盈瑞,陈 洁,周玲玲,梁 勇
·论著·
甲状腺乳头状癌组织中Smad4基因表达水平及其意义研究
黄盈瑞,陈 洁,周玲玲,梁 勇
目的 探讨Smad4基因在甲状腺乳头状癌组织中的表达水平及其意义。方法 选取2013年1—8月台州学院附属医院肿瘤外科收治的甲状腺乳头状癌患者20例作为甲状腺乳头状癌组,另选取同期本院收治的行结节性甲状腺肿手术患者20例作为对照组。收集甲状腺乳头状癌组甲状腺乳头状癌手术切除组织,对照组结节性甲状腺肿手术中腺肿旁正常组织。采用免疫组织化学检测两组Smad4阳性表达率;Western blotting法检测两组Smad4表达水平;实时荧光定量PCR法检测两组Smad4 mRNA表达水平。结果 甲状腺乳头状癌组Smad4阳性表达率为35.0%(7/20),低于对照组的90.0%(18/20)(χ2=10.667,P=0.001)。不同性别、年龄、肿瘤直径、淋巴结转移、临床分期的甲状腺乳头状癌患者Smad4阳性表达率比较,差异均无统计学意义(P>0.05)。甲状腺乳头状癌组Smad4表达水平为(0.352±0.012),低于对照组的(0.722±0.007)(t=46.130,P<0.001)。Smad4在甲状腺乳头状癌组和对照组中均有表达,甲状腺乳头状癌组Smad4 mRNA表达水平为对照组的(0.348±0.006)倍。结论 Smad4基因在甲状腺乳头状癌组织中表达下调,Smad4基因的表达缺失和下调导致转化生长因子β(TGF-β)/Smads信号通路受抑制是甲状腺乳头状癌发生、发展的可能机制之一。
甲状腺肿瘤;癌,乳头状;Smad4基因;信号传导
黄盈瑞,陈洁,周玲玲,等.甲状腺乳头状癌组织中Smad4基因表达水平及其意义研究[J].中国全科医学,2016,19(32):3961-3965.[www.chinagp.net]
HUANG Y R,CHEN J,ZHOU L L,et al.Expression and significance of Smad4 gene in papillary thyroid cancer[J].Chinese General Practice,2016,19(32):3961-3965.
转化生长因子β(TGF-β)/Smads信号通路参与胚胎细胞和组织细胞的多项活动,包括细胞生长、增殖、分化、凋亡、侵袭、转移等[1],Smad4基因作为该信号通路的核心调控蛋白,被广泛证实在肿瘤细胞中呈低表达或不表达,其突变失活可导致组织细胞过度增长而发生癌变[2]。但Smad4基因在甲状腺乳头状癌中的表达与调控国内外鲜有文献报道,本研究主要探查Smad4基因在甲状腺乳头状癌中的表达水平及其意义。
1 资料与方法
1.1 一般资料 选取2013年1—8月台州学院附属医院肿瘤外科收治的甲状腺乳头状癌患者20例作为甲状腺乳头状癌组,其中男3例,女17例;年龄21~59岁,平均年龄(44.6±7.2)岁,<45岁6例,≥45岁14例;肿瘤直径0.6~3.7 cm,平均肿瘤直径(1.6±0.1)cm,≤1.0 cm者3例,>1.0 cm者17例;伴淋巴结转移6例,无淋巴结转移14例;临床分期Ⅰ~Ⅱ期13例,Ⅲ~Ⅳ期7例;患者术前均未行放疗或化疗,术后经病理科切片明确诊断为甲状腺乳头状癌。另选取同期本院收治的行结节性甲状腺肿手术患者20例作为对照组,其中男5例,女15例;年龄23~65岁,平均年龄(42.3±11.4)岁。
1.2 方法 收集两组患者的组织标本,其中甲状腺乳头状癌组标本来源于甲状腺乳头状癌手术切除组织,对照组标本来源于结节性甲状腺肿手术中腺肿旁正常组织;每份标本取其中一半置于4%甲醛溶液中固定,常规脱水石蜡包埋,用于免疫组织化学检测;标本其余部分提取蛋白质用于Western blotting检测,提取RNA用于实时荧光定量PCR检测。
1.2.1 免疫组织化学法检测Smad4阳性表达率 切片常规脱水脱蜡处理,磷酸盐缓冲液(PBS)清洗后用3%去离子水孵育,枸橼酸钠3 g+枸橼酸0.4 g配水1 000 ml高压抗原修复,清洗擦干后10%山羊血清封闭,滴加一抗Smad4(Santa Cruz公司,1∶100),4 ℃冰箱孵育过夜,37 ℃复温45 min,滴加二抗稀释液37 ℃孵育1 h,PBS清洗后滴加二氨基联苯胺(DAB)显色,镜下观察,判读结果。根据HAHN等[3]半定量评分标准,以阳性细胞着色强度与阳性细胞数计分,着色强度无色为0分、淡棕色为1分、棕黄色为2分、棕褐色为3分;后在高倍镜(40×)下每张切片随机取5个视野,计数500个细胞/视野,共计2 500个,阳性细胞数按照<5%、5%~35%、36%~70%、>70%分别计为0、1、2、3分;将上述两个分值相乘得出该组织标本的细胞染色积分,按积分结果可判为阴性(-):≤1分,弱阳性(+):2~3分,中度阳性(++):4~5分,强阳性(+++):≥6分。
1.2.2 Western blotting法检测Smad4表达水平 每份标本取约50 mg,加入裂解液,冰上充分研磨裂解,12 000×g,离心5 min,取上清液,BCA法测蛋白浓度,取30 μg总蛋白进行电泳。十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)分离胶浓度为10%,浓缩胶浓度为5%,浓缩胶80 V,分离胶120 V进行凝胶电泳。湿转法将胶上蛋白转至聚氯乙烯(PVC)膜上,5%脱脂奶粉摇床封闭1.5 h,PBS清洗加入一抗,Smad4(1∶400),GAPDH(1∶2 000),4 ℃孵育过夜,TBST缓冲液洗膜,二抗室温摇床孵育2 h,化学显色,加入配好的ECL发光液显影,在成像系统中观察结果。实验重复3次。
1.2.3 实时荧光定量PCR法检测Smad4 mRNA表达水平 取约50 mg组织在液氮中研磨成粉末,常规Trizol方法提取总RNA,分析纯度,反转录合成cDNA,使用TIANGEN Quant cDNA第一链合成试剂盒KR103,20 μl体系,PCR检测使用TIANGEN Real Master Mix PF202试剂盒,反应条件为95 ℃预变性2 min,95 ℃变性15 s、60 ℃退火15 s、68 ℃延伸60 s,共40个循环,最终95 ℃延伸15 s;降温至60 ℃ 60 s;然后按每15 s上升0.3 ℃至95 ℃后,保持15 s。分别收集荧光信号,进行熔解曲线分析。基因引物由上海捷瑞生物工程有限公司合成,引物序列Smad4上游引物5′-CCTTGCAACGTTAGCTGTTG-3′,下游引物5′-CTTCAGTGGACAACGATG-3′;GAPDH上游引物5′-ACCACAGTCCATGCCATCAC-3′,下游引物5′-TCCACCACCCTGTTGCTGTA-3′。Smad4 mRNA在甲状腺乳头状癌组和对照组的表达结果采用相对定量2-ΔΔCt方法计算。

2 结果
2.1 免疫组织化学结果 Smad4在胞核和胞质中均有阳性表达(见图1,本文彩图详见本刊官网www.chinagp.net电子期刊相应文章附件),甲状腺乳头状癌组Smad4阳性表达率为35.0%(7/20),对照组Smad4阳性表达率为90.0%(18/20),甲状腺乳头状癌组Smad4阳性表达率低于对照组,差异有统计学意义(χ2=10.667,P=0.001)。

注:A为Smad4在正常甲状腺组织中的阴性表达,B为Smad4在正常甲状腺组织中的阳性表达,C为Smad4在甲状腺乳头状癌组织中的阴性表达,D为Smad4在甲状腺乳头状癌组中的阳性表达
2.2 不同临床病理特征的甲状腺乳头状癌患者Smad4阳性表达率比较 不同性别、年龄、肿瘤直径、淋巴结转移、临床分期的甲状腺乳头状癌患者Smad4阳性表达率比较,差异均无统计学意义(P>0.05,见表1)。
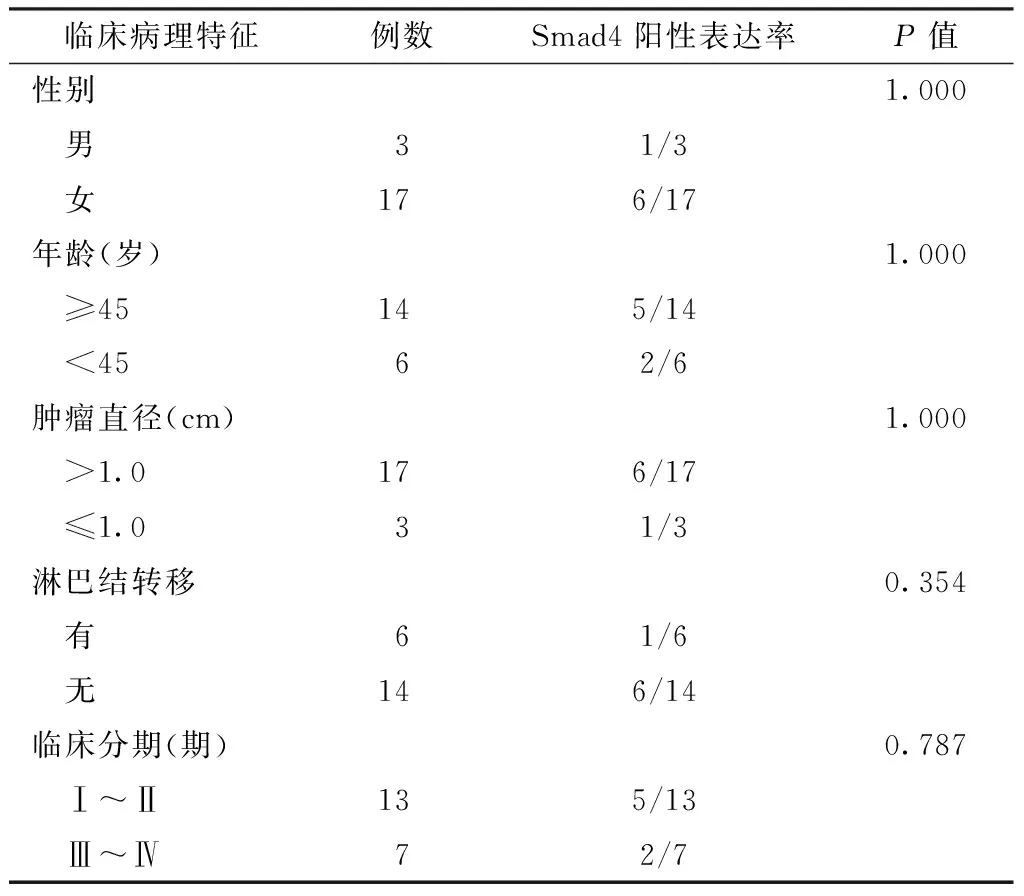
表1 不同临床病理特征的甲状腺乳头状癌组患者Smad4阳性表达率比较(n/N)
2.3 Western blotting结果 以Smad4目的条带与GAPDH内参条带的灰度值比作为Smad4的相对表达水平,甲状腺乳头状癌组Smad4表达水平为(0.352±0.012),低于对照组的(0.722±0.007),差异有统计学意义(t=46.130,P<0.001,见图2)。
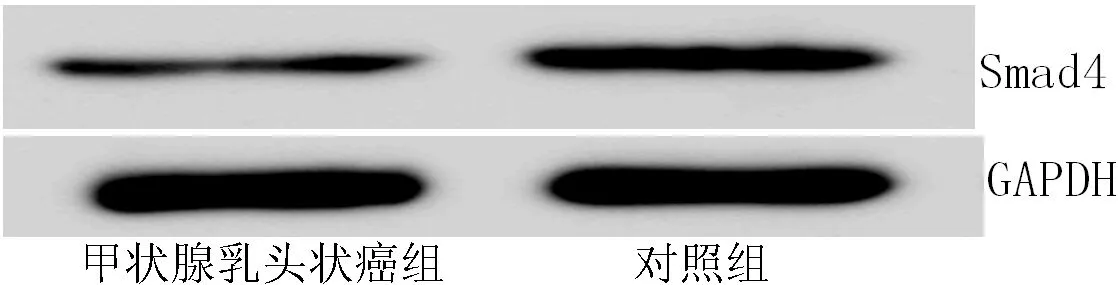
图2 甲状腺乳头状癌组和对照组Smad4表达水平Western blotting检测结果
2.4 实时荧光定量PCR结果 经紫外分光测定标本组织OD值为1.87,RNA提取物纯度较好,琼脂糖凝胶电泳可见18、28 s两条条带(见图3),说明提取RNA完整性较好,无降解。Smad4在甲状腺乳头状癌组和对照组中均有表达,甲状腺乳头状癌组Smad4 mRNA表达水平为对照组的(0.348±0.006)倍。
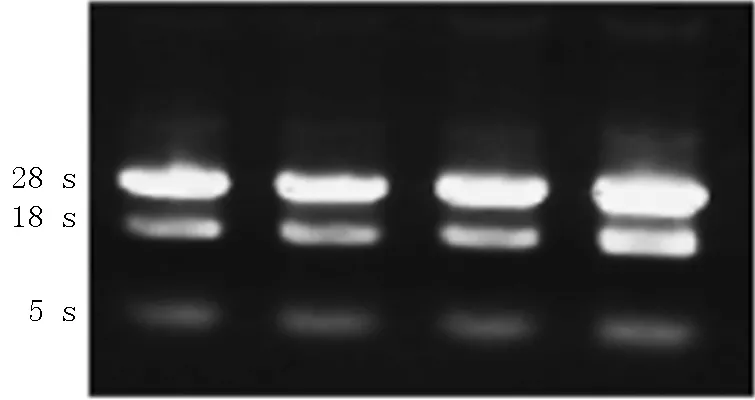
图3 RNA提取物琼脂糖凝胶电泳图
3 讨论
Smad4基因位于人染色体18q21.1位点,具有2 680 bp转录单位,编码552个氨基酸。1996年,在胰腺癌患者的肿瘤细胞中首次发现了Smad4基因的缺失[4],研究者们又陆续在结直肠癌、胃癌、肝癌、乳腺癌、非小细胞肺癌、胆管癌等其他众多肿瘤中发现Smad4基因普遍呈低表达[2,5]。Smad4是TGF-β/Smads信号通路中的核心调控蛋白,同时也参与MAPK、PI3K等信号通路的调控,在肿瘤的增殖、分化、侵袭、转移等过程中起重要作用[6]。在正常组织细胞,TGF-β信号与Ⅱ型受体结合形成复合物激活Ⅰ型受体使其磷酸化,再与R-Smad结合,活化的复合物结合转运蛋白Smad4至细胞核参与转录调控[7]。当Smad4基因发生突变,TGF-β/Smads信号通路对肿瘤的抑制作用也随之发生变化,容易诱导癌变的发生。
Smad4基因与肿瘤发生、发展的关系已被探讨,但目前关于其在甲状腺乳头状癌中的表达与调控的研究并不多,甲状腺癌是最常见的内分泌肿瘤[8],在全球的发病率有逐年上升趋势,我国沿海地区也是甲状腺癌的高发地区之一[9]。D′INZEO等[10]对人甲状腺乳头状癌细胞株TPC-1与BCPAP进行体外培养实验,结果表明Smad4基因在TPC-1与BCPAP细胞中均表现为明显下调,其通过介导TGF-β信号通路参与细胞增殖与侵袭等行为。本研究选取20例甲状腺乳头状癌组织和20例甲状腺结节腺肿旁正常组织,通过免疫组织化学、Western blotting、实时荧光定量PCR法在蛋白水平和mRNA水平探查Smad4基因在甲状腺乳头状癌中的表达。结果显示,甲状腺乳头状癌组Smad4阳性表达率低于对照组;且甲状腺乳头状癌组Smad4低表达与性别、年龄、肿瘤直径、淋巴结转移、临床分期无关;Western blotting和实时荧光定量PCR结果显示,甲状腺乳头状癌组Smad4及其mRNA表达水平均低于对照组,证实Smad4基因在甲状腺乳头状癌中呈低表达,Smad4基因的失活在甲状腺乳头状癌与其他肿瘤中普遍存在。
抑癌基因Smad4作为TGF-β/Smads信号通路的核心调控蛋白在众多肿瘤中的低表达被广泛证实[11],其失活常被认为是18q21染色体突变引起,但是否有更多原因导致Smad4基因的低表达还在进一步研究中。AITCHISON等[12]在对前列腺癌标本和细胞株的实验中并未发现18q21染色体上的基因突变,但发现Smad4基因的低表达与其启动子区甲基化密切相关。SAMEER等[13]也在肠癌中发现Smad4基因启动子存在甲基化。甲状腺乳头状癌组织中Smad4基因的低表达是否也与其启动子区域的甲基化有关,有待进一步的实验探查。同时,microRNA的调控也是Smad4基因低表达的可能机制之一。ZHANG等[14]在胃癌细胞中发现Smad4基因表达受microRNA-199a的调控,其主要靶点位于Smad4基因的UTR区;HIRATA等[15]对膀胱癌细胞的microRNA-182-5p进行沉默干扰,结果发现Smad4基因表达上调,肿瘤细胞增殖变缓,可见microRNA-182-5p对膀胱癌中的Smad4基因起调控作用。LIU等[16]则发现microRNA-146a在成纤维肌细胞中对Smad4基因起负向调节作用。随着microRNA对靶基因的调控越来越多的被研究和证实,可确认microRNA对肿瘤Smad4基因起调控作用,但是一种microRNA还是多种microRNA一起参与调控目前还在广泛研究中,甲状腺癌中是否也存在microRNA调控Smad4基因的表达是本课题组下一步实验研究范畴之一。
Smad4是一种抑癌基因,其编码的蛋白主要参与TGF-β信号通路的转导,同时也参与MAPK等信号通路的调控[17]。Smad4基因的异常常导致上述信号通路的改变,从而促使细胞癌变。目前对Smad4的研究尚待进一步的深入,对于Smad4调节的靶基因及调节机制是否是其他信号通路与TGF-β/Smads信号通路的整合点之一,并发挥何种作用,Smad4基因失活的机制等均需要进一步的研究与证实。对Smad4基因的深入研究不仅对了解细胞调控机制及肿瘤的形成发展有重要意义,并对肿瘤的分子诊断和治疗有着更迫切的现实意义。
作者贡献:黄盈瑞进行实验设计与实施、资料收集整理、撰写论文、成文并对文章负责;陈洁、周玲玲进行实验实施、评估、资料收集;梁勇进行质量控制及审校。
本文无利益冲突。
[1]ZHANG Q,YU N,LEE C.Vicious cycle of TGF-β signaling in tumor progression and metastasis[J].Am J Clin Exp Urol,2014,2(2):149-155.
[2]WAIN K E,ELLINGSON M S,MCDONALD J,et al.Appreciating the broad clinical features of SMAD4 mutation carriers:a multicenter chart review[J].Genet Med,2014,16(8):588-593.
[3]HAHN S A,SCHUTTE M,HOQUE A T,et al.DPC4,a candidate tumor suppressor gene at human chromosome 18q21.1[J].Science,1996,271(5247):350-353.
[4]CARCANGIU M L,CHAMBERS J T,VOYNICK I M,et al.Immunohistochemical evaluation of estrogen and progesterone receptor content in 183 patients with endometrial carcinoma.Part Ⅰ:clinical and histologic correlations[J].Am J Clin Pathol,1990,94(3):247-254.
[5]MIYAKI M,KUROKI T.Role of Smad4(DPC4)inactivation in human cancer[J].Biochem Biophys Res Commun,2003,306(4):799-804.
[6]HELDIN C H,MOUSTAKAS A.Role of smads in TGF-β signaling[J].Cell Tissue Res,2012,347(1):21-36.
[7]LENG A,LIU T,HE Y,et al.Smad4/Smad7 balance:a role of tumorigenesis in gastric cancer[J].Exp Mol Pathol,2009,87(1):48-53.
[8]SIPOS J A,MAZZAFERRI E L.Thyroid cancer epidemiology and prognostic variables[J].Clin Oncol(R Coll Radiol),2010,22(6):395-404.
[9]黄盈瑞,周玲玲,戈月平,等.浙江省台州市椒江区2008~2012年甲状腺癌发病情况分析[J].临床荟萃,2013,28(11):1210-1212. HUANG Y R,ZHOU L L,GE Y P,et al.Incidence of thyroid cancer from 2008 to 2012 in Jiaojiang district,Taizhou of Zhejiang province[J].Clinical Focus,2013,28(11):1210-1212.
[10]D′INZEO S,NICOLUSSI A,RICCI A,et al.Role of reduced expression of Smad4 in papillary thyroid carcinoma[J].J Mol Endocrinol,2010,45(4):229-244.
[11]DATTA P K,MANN J R.Transforming growth factor-β(TGF-β) signaling inhibitors in cancer therapy[M].Clifton:Human Press,2008:573-587.
[12]AITCHISON A A,VEERAKUMARASIVAM A,VIAS M,et al.Promoter methylation correlates with reduced Smad4 expression in advanced prostate cancer[J].Prostate,2008,68(6):661-674.
[13]SAMEER A S,SIDDIQI M A.SMAD4 promoter hypermethylation in Kashmiri colorectal cancer cases[J].Saudi J Gastroenterol,2011,17(4):297.
[14]ZHANG Y,FAN K J,SUN Q,et al.Functional screening for miRNAs targeting Smad4 identified miR-199a as a negative regulator of TGF-β signalling pathway[J].Nucleic Acids Res,2012,40(18):9286-9297.
[15]HIRATA H,UNEO K,SHAHRYARI V,et al.Oncogenic miRNA-182-5p targets Smad4 and RECK in human bladder cancer[J].PLoS One,2012,7(11):e51056.
[16]LIU Z,LU C L,CUI L P,et al.MicroRNA-146a modulates TGF-β 1-induced phenotypic differentiation in human dermal fibroblasts by targeting SMAD4[J].Arch Dermatol Res,2012,304(3):195-202.
[17]XU X,HAN J,ITO Y,et al.Ectodermal Smad4 and p38 MAPK are functionally redundant in mediating TGF-beta/BMP signaling during tooth and palate development[J].Dev Cell,2008,15(2):322-329.
(本文编辑:贾萌萌)
Expression and Significance of Smad4 Gene in Papillary Thyroid Cancer
HUANGYing-rui,CHENJie,ZHOULing-ling,LIANGYong.TaizhouUniversityMedicalSchool,Taizhou318000,China
LIANGYong,TaizhouUniversityMedicalSchool,Taizhou318000,China;E-mail:hhhyr@163.com
Objective To explore the expression and significance of Smad4 gene in papillary thyroid cancer(PTC).Methods From January to August in 2013,20 cases of PTC admitted to Department of Tumor Surgery of Affiliated Hospital of Taizhou University were enrolled as the PTC group,and 20 patients with nodular goiter accepted surgery in the same period were enrolled as the control group.Surgically resected tissue of PTC in the PTC group and normal thyroid tissue adjacent to nodular goiter in the control group were collected.The positive expression of Smad4 protein in two groups was observed using immunohistochemistry,the expression level of Smad4 protein in two groups was detected using Western blotting and the expression level of Smad4 mRNA using real time-PCR.Results The positive expression rate of Smad4 protein in PTC group was 35.0%(7/20),which was lower than 90.0%(18/20)in the control group(χ2=10.667,P=0.001).There was no statistically significant difference in the positive expression rate of Smad4 protein in the PTC patients among gender,age,tumor diameter,lymph node metastases and clinical stage of PTC(P>0.05).The expression of Smad4 protein in PTC group was(0.352±0.012),which was lower than that in control group(0.722±0.007)(t=46.130,P<0.001).Smad4 gene expressed in both PTC and control group,the expression level of Smad4 mRNA in PTC tissue was(0.348±0.006) time as much as control group.Conclusion The expression of Smad4 gene was down-regulated in PTC.The inhibition of TGF-β/Smads signal pathway caused by the loss and down-regulation of Smad4 gene expression might be the possible mechanisms of the occurrence and development of PTC.
Thyroid neoplasms;Carcinoma,papillary;Smad4 gene;Signal transduction
2014年浙江省自然科学基金资助项目(LY14H160036);2014年台州学院青年基金资助项目(2014QN028)
318000浙江省台州市,台州学院医学院
梁勇,318000浙江省台州市,台州学院医学院;E-mail:hhhyr@163.com
R 736.1
A
10.3969/j.issn.1007-9572.2016.32.013
2016-02-02;
2016-08-20)

