顺铂诱导斑马鱼侧线毛细胞损伤及再生模型的建立
芈肖肖严健李圆施军平
1杭州师范大学附属医院转化医学平台(杭州310015)
2杭州师范大学附属医院耳鼻咽喉头颈外科(杭州310015)
·基础研究·
顺铂诱导斑马鱼侧线毛细胞损伤及再生模型的建立
芈肖肖1严健1李圆2施军平1
1杭州师范大学附属医院转化医学平台(杭州310015)
2杭州师范大学附属医院耳鼻咽喉头颈外科(杭州310015)
目的 建立顺铂诱导斑马鱼侧线毛细胞损伤及再生模型。方法 采用顺铂溶液直接孵育斑马鱼方法,通过免疫组化、荧光特异性标记侧线细胞的转基因鱼活体成像、原位杂交等方法统计分析顺铂处理前后斑马鱼侧线毛细胞剩余情况以及药物撤除后毛细胞再生情况。结果顺铂引起斑马鱼侧线毛细胞丢失具有剂量依赖效应,相同的孵育时间较高浓度的顺铂孵育后几乎可杀死全部侧线毛细胞;毛细胞再生与顺铂的毒性积累程度有关,较低浓度孵育较短时间毛细胞再生速度较快。毛细胞再生数目随着时间的延长不断增加,72小时后可再生原有数目的90%以上。结论 斑马鱼侧线毛细胞经不同浓度顺铂孵育不同时间后,其毛细胞丢失与再生具有剂量和时间依赖效应。
顺铂,毛细胞损伤,毛细胞再生,剂量依赖效应
感音神经性聋是全球性问题,目前约有6亿人单侧或双侧听力出现受损现象[1],其中由药物诱发的听力受损问题正越发严重。顺铂是广谱的实体癌症治疗药物,特别是对头颈癌、肺癌、膀胱癌、子宫颈癌、卵巢癌、睾丸癌等实体癌症疗效显著[2]。耳毒性是顺铂治疗癌症患者过程中呈现的一个不容忽视的副作用,顺铂的耳毒性主要表现为耳蜗毒性,研究发现,耳蜗的外毛细胞是顺铂首要的攻击对象[3-5]。模式生物斑马鱼拥有研究毛细胞丢失和再生科学问题的独有优势,如其体积小、产卵量高、身体透明以及侧线毛细胞位于其身体表面等优势。斑马鱼侧线毛细胞在形态和功能上与哺乳动物内耳毛细胞高度相似,已有研究发现,一些哺乳动物内耳毛细胞敏感的耳毒性刺激同样可引起斑马鱼侧线毛细胞的损伤[6-8]。因此,我们的研究利用斑马鱼侧线毛细胞探讨耳毒性药物顺铂杀死毛细胞后,后续毛细胞的再生情况。
1 材料与方法
1.1 实验材料:实验所用野生型鱼系均为Tübingen(简称TU),标记侧线细胞的转基因鱼系来自北大张博教授馈赠,所有斑马鱼均饲养在恒温28.5℃的水循环环境中,本研究所进行的斑马鱼侧线毛细胞损伤与再生的研究均以5天大斑马鱼幼鱼为实验起点[9]。顺铂(美国,Sigma,479306);抗体rabbit anti-Myosin VI(美国,Proteus BioSciences,256791);麻醉剂Tric⁃aine(美国,Sigma,E10521);碱性磷酸酶抗地高辛抗体(瑞士,Roche,11093274910)。
1.2 顺铂溶液的配制:称取粉末用养鱼水配制成1mM储液,避光室温保存。使用时,按一定比例用养鱼水稀释到所用浓度,直接浸泡5天大斑马鱼幼鱼,28.5℃避光放置。
1.3 斑马鱼侧线毛细胞免疫组化标记:参照Harris等报道的方法[6],10-15条斑马鱼用4%多聚甲醛室温固定2小时或4℃过夜固定。取出后,经PBS和ddH2O先后润洗2次,加入丙酮-20℃处理10分钟,后加入封闭液室温封闭1小时左右。加入抗体rab⁃bit anti-Myosin VI(1:500)4℃过夜。第二天取出后用封闭液润洗样本,加入二抗Alexa Fluor®488 goat anti-rabbit IgG(H+L)(Invitrogen,1:200)室温孵育6小时,再用封闭液润洗,保存于PBS溶液中,Zeiss Axio A1倒置荧光显微镜成像。
1.4 斑马鱼侧线特异性标记转基因鱼活体成像:用0.016%质量体积比的Tricaine麻醉,在Zeiss Axio A1倒置荧光显微镜成像,先用20倍物镜观察体表侧线神经丘的分布,后用40倍物镜放大观察单个神经丘情况。
1.5 斑马鱼侧线毛细胞特异性基因原位杂交方法:参照Jiang等报道的方法[10],10-15条斑马鱼样本用PFA固定过夜,体外合成slc17a8反义探针,将该探针加入杂交液中,70℃孵育样本过夜。第二天样本经润洗后,加入碱性磷酸酶抗地高辛抗体孵育4至5小时,加入底物显色即可。
1.6 统计分析:实验中斑马鱼侧线神经丘毛细胞的统计方法为计数后侧线前三个神经丘毛细胞数目取平均值,统计数据均表示为±s,采用student t检验进行显著性分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 顺铂杀死斑马鱼侧线毛细胞及后续毛细胞再生的剂量依赖效应
0.5 mM~0.8 mM顺铂处理6小时后,侧线神经丘毛细胞数目平均仅剩余1-2个。当顺铂的浓度提高到1mM,侧线神经丘毛细胞剩余数目几乎减少至零。其次用0.5 mM顺铂分别浸泡斑马鱼6小时和8小时后,发现两者都可杀死大约80%左右的毛细胞,但是后续的毛细胞再生的情况却不一样:6小时处理后,后续再生的毛细胞数目在去除药物24小时后有显著升高;而8小时处理后,毛细胞数目在24小时后仍没有显著的升高(图1B和1C)。最后用1 mM顺铂浸泡斑马鱼6小时后,发现48小时再生的毛细胞数目与24小时再生毛细胞数目没有显著差异,且显著低于0.5 mM顺铂浸泡斑马鱼同等时间的实验组24小时毛细胞再生数目(图1B和1D)。
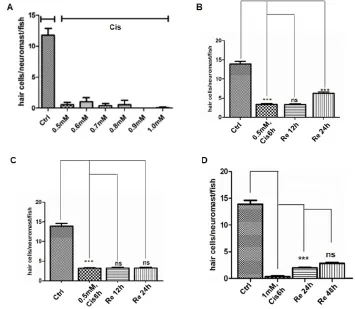
图1 毛细胞丢失及再生与顺铂处理浓度与时间的关系Fig.1 Cisplatin induced hair cell loss and regeneration in a dose-dependent manner.
2.2 顺铂处理后斑马鱼侧线毛细胞再生的时间依赖效应
0.5 mM顺铂处理野生型鱼6小时后,利用毛细胞特异性抗体anti-myosin VI来观察侧线毛细胞的再生情况。结果显示,顺铂处理后,斑马鱼侧线毛细胞平均剩余3个左右,去除顺铂24小时后,斑马鱼侧线毛细胞增加到平均6个左右,到回复的60小时,斑马鱼侧线毛细胞数目增加到10个左右(图2A、2A’、2A’’)。利用斑马鱼侧线细胞特异性标记GFP的转基因鱼mp189b,也观察到顺铂撤除60小时后,侧线神经丘呈实心状态,暗示着侧线毛细胞重新长回(图2B,B’为放大的单个侧线神经丘)。利用毛细胞特异性基因slc17a8的反义探针原位杂交技术,也可观察到顺铂处理后侧线神经丘slc17a8信号显著减少(图2C),去除顺铂60小时后,slc17a8信号回复(图2C’)。统计数据显示了顺铂处理后斑马鱼侧线毛细胞减少80%左右;去除药物24小时后,斑马鱼侧线毛细胞数目开始显著升高;随着时间的推移到回复的72小时,斑马鱼侧线毛细胞数目可达到未处理前90%左右(图2D)。
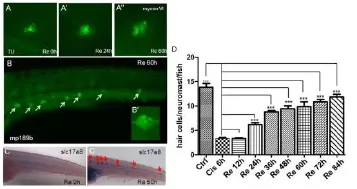
图2 斑马鱼侧线毛细胞再生情况Fig.2 Characterization of hair cell regeneration
3 讨论
成年的哺乳动物在自身器官受到损害后丧失了再生能力,如大脑、肌肉和听觉器官等在受到创伤后都不可完全恢复。目前主要采取通过外源细胞整合到已有组织或诱导内源细胞启动再生程序两种研究策略达到哺乳动物相应器官在损伤后恢复其功能的目的。
斑马鱼是高度可再生模式生物,其身体的鱼鳍、心脏、中枢神经系统、胰腺和肾脏等器官都可再生[11-14]。在斑马鱼全基因组测序工程结果显示,斑马鱼共享了人类70%的蛋白编码基因,而且人类疾病相关基因中有84%可以在斑马鱼中找到对应基因[15-16]这说明用斑马鱼作为模式生物进行相关研究与哺乳动物具有更高的保守性。本研究利用模式动物斑马鱼探讨了顺铂诱导斑马鱼侧线毛细胞丢失及其后续毛细胞再生情况,说明了本研究利用斑马鱼进行毛细胞丢失及再生的研究具有一定先进性及应用价值。
本研究发现顺铂杀死斑马鱼侧线毛细胞的时间和剂量依赖效应,当顺铂浓度在0.5 mM至1 mM之间时,随着浓度的增加,孵育相同时间后斑马鱼侧线毛细胞几乎可被全部杀死,这暗示着顺铂在杀死斑马鱼侧线毛细胞过程中具有毒性累积的现象。其次本研究发现当用同一浓度的顺铂孵育斑马鱼不同的时间后,较长时间的孵育会延迟后续毛细胞再生;而不同浓度的顺铂孵育斑马鱼相同时间后,高浓度的顺铂相比较于低浓度的顺铂孵育后其后续毛细胞的再生能力较弱,这暗示着由于药物毒性积累不同所导致的毛细胞死亡程度会影响后续毛细胞的再生。研究发现再生的毛细胞主要是通过神经丘外周区域助细胞的增殖分化而来[17];而不同的耳毒性刺激处理毛细胞后,助细胞的增殖分化程度有所不同[18]。目前研究认为氨基糖苷类抗生素在杀死斑马鱼侧线毛细胞过程中主要引起线粒体肿胀和胞内Ca2+浓度的瞬时增加[19-20]重金属离子铜以细胞凋亡和坏死结合的方式杀死侧线毛细胞[21];顺铂类药物在杀死侧线毛细胞过程中可使毛细胞的细胞核固缩,断裂成核小片段[22];而在这几种不同的耳毒性刺激后出现了助细胞增殖再生毛细胞数目的差异[18],暗示着毛细胞死亡形式对后续毛细胞再生方式的影响,而对于这一假设,目前仍需要更详实的实验论证。Wil⁃liams等研究发现,增加神经丘中心毛细胞的死亡数目可增加周围助细胞发生增殖的数目;反之如果用特定的抑制剂减少神经丘中心毛细胞的死亡,则周围助细胞的增殖也随之减少[23]。由此推测毛细胞再生不仅与耳毒性刺激所导致的毛细胞死亡形式相关,还与耳毒性刺激所导致的毛细胞死亡数目密切相关,当然对于这一科学问题,目前还需进行进一步的实验论证。Namdaran研究组利用新霉素损伤/再生侧线毛细胞系统筛选了1680种FDA批准的化合物,结果得到了两种有临床应用价值的可增强毛细胞再生的小分子化合物,糖皮质激素-地塞米松(glucocorticoids dexamethasone)和脱氢皮质醇(pred⁃nisolone)[24]。本研究利用毛细胞特异性抗体的免疫组化、转基因斑马鱼活体观察、原位杂交等方法系统性建立的顺铂诱导的斑马鱼侧线毛细胞损伤与再生模型,将为探究这些有医学应用价值的小分子化合物在顺铂致聋的群体患者中如何诱导毛细胞再生提供了在体动物模型,为发现药物性耳聋的治疗靶点提供了有力的研究平台,同时对于探讨毛细胞再生来源方式在本模型研究基础之上也可作更深层次的探讨。
1 Mukherjea D,S Ghosh,P Bhatta,et al.Early investigational drugs for hearing loss.Expert Opin Investig Drugs,2015,24(2):201-217.
2 Boulikas T and M Vougiouka.Recent clinical trials using cisplatin, carboplatin and their combination chemotherapy drugs(review).On⁃col Rep,2004,11(3):559-595.
3 Schacht J,AE Talaska and LP Rybak.Cisplatin and aminoglycoside antibiotics:hearing loss and its prevention.Anat Rec(Hoboken), 2012,295(11):1837-1850.
4 杨琨,丁大连,付勇,等.应用FLIVO探测顺铂引起的多器官细胞凋亡.中华耳科学杂志,2015,14(1):104-110. YANG Kun,DING Dalian,FU Yong,et al.Systemic detection of cis⁃platin-induced apoptosis by fluorescently-labeled poly-caspase in⁃hibitor(FLIVO).Chinese Journal of Otology,2015,14(1):104-110.
5 刘宏伟,冷辉,孙海波.川芎嗪对顺铂耳聋大鼠耳蜗Fas/FasL及Caspase8的调控研究.中华耳科学杂志,2015,13(2):335-335. LIU Hongwei,LENG Hui,SUN Haibo.Effects of Ligustrazine on Ex⁃pression of Fas/Fas L and Caspase8 in Cochlea of Rat with Cisplat⁃in-induced Hearing Loss.2015,13(2):335-335.
6 Harris JA,AG Cheng,LL Cunningham,et al.Neomycin-induced hair cell death and rapid regeneration in the lateral line of zebrafish (Danio rerio).J Assoc Res Otolaryngol,2003,4(2):219-234.
7 Ton C and C Parng.The use of zebrafish for assessing ototoxic and otoprotective agents.Hear Res,2005,208(1-2):79-88.
8 Whitfield TT.Zebrafish as a model for hearing and deafness.J Neuro⁃biol,2002,53(2):157-171.
9 Santos F,G MacDonald,EW Rubel,et al.Lateral line hair cell matu⁃ration is a determinant of aminoglycoside susceptibility in zebrafish (Danio rerio).Hear Res,2006,213(1-2):25-33.
10 Jiang L,Romero-Carvajal A,Haug J S,et al.Gene-expression anal⁃ysis of hair cell regeneration in the zebrafish lateral line.Proc Natl Acad Sci,2014,111(14):E1383-92.11 Kizil C,J Kaslin,V Kroeh⁃ne,et al.Adult neurogenesis and brain regeneration in zebrafish. Dev Neurobiol,2012,72(3):429-461.
11 Kizil C,J Kaslin,V Kroehne,et al.Adult neurogenesis and brain re⁃generation in zebrafish.Dev Neurobiol,2012,72(3):429-461.
12 Li Y and RA Wingert.Regenerative medicine for the kidney:stem cell prospects&challenges.Clin Transl Med,2013,2(1):11.
13 Moss JB,P Koustubhan,M Greenman,et al.Regeneration of the pan⁃creas in adult zebrafish.Diabetes,2009,58(8):1844-1851.
14 Poss KD,LG Wilson and MT Keating.Heart regeneration in zebraf⁃ish.Science,2002,298(5601):2188-2190.
15 Howe K,MD Clark,CF Torroja,et al.The zebrafish reference ge⁃nome sequence and its relationship to the human genome.Nature, 2013,496(7446):498-503.
16 Kettleborough RN,EM Busch-Nentwich,SA Harvey,et al.A system⁃atic genome-wide analysis of zebrafish protein-coding gene func⁃tion.Nature,2013,496(7446):494-497.
17 Ma EY,EW Rubel and DW Raible.Notch signaling regulates the ex⁃tent of hair cell regeneration in the zebrafish lateral line.J Neurosci, 2008,28(9):2261-73.
18 Mackenzie SM and DW Raible.Proliferative regeneration of zebraf⁃ish lateral line hair cells after different ototoxic insults.PLoS One, 2012,7(10):e47257.
19 Esterberg R,DW Hailey,AB Coffin,et al.Disruption of intracellular calcium regulation is integral to aminoglycoside-induced hair cell death.J Neurosci,2013,33(17):7513-7525.
20 Owens KN,DE Cunningham,G MacDonald,et al.Ultrastructural analysis of aminoglycoside-induced hair cell death in the zebrafish lateral line reveals an early mitochondrial response.J Comp Neurol, 2007,502(4):522-543.
21 Olivari FA,PP Hernandez and ML Allende.Acute copper exposure induces oxidative stress and cell death in lateral line hair cells of ze⁃brafish larvae.Brain Res,2008,1244:1-12.
22 Ou HC,DW Raible and EW Rubel.Cisplatin-induced hair cell loss in zebrafish(Danio rerio)lateral line.Hear Res,2007,233(1-2): 46-53.
23 Williams JA and N Holder.Cell turnover in neuromasts of zebrafish larvae.Hear Res,2000,143(1-2):171-181.
24 Namdaran P,KE Reinhart,KN Owens,et al.Identification of modu⁃lators of hair cell regeneration in the zebrafish lateral line.J Neuro⁃sci,2012,32(10):3516-3528.
Cisplatin-induced zebrafish lateral line hair cell loss and regeneration
MI Xiaoxiao1,YAN Jian1,LI Yuan2,SHI Junping1
1 Centre for Translational Medicine,Hangzhou Normal University Affiliated Hospital,Hangzhou,Zhejiang,310015,China
2 Department of Otolaryngology-Head and Neck Surgery,Hangzhou Normal University Affiliated Hospital, Hangzhou,Zhejiang,310015,China
Objective To establish a model of cisplatin-induced hair cell loss and regeneration in zebrafish.Methods Zebrafish larval were incubated in cisplatin solution.Using antibody staining,transgenic fish live imaging and in situ hybridization,hair cell numbers before and after cisplatin treatment were characterized.Results Higher concentration cisplatin incubation caused more hair cell loss than lower concentration cisplatin when incubated for the same duration.Hair cells regeneration after lower concentration cisplatin incubation was also faster(P<0.001).Conclusion Cisplatin induced zebrafish lateral line hair cell loss and regeneration show dose and time-dependent patterns.
Cisplatin;Hair cell injury;Hair cell regeneration;Dose-dependent manner.
R764.1
A
1672-2922(2016)05-670-4
2016-06-01审核人:翟所强)
10.3969/j.issn.1672-2922.2016.05.023
芈肖肖,博士,检验技师,研究方向:听力损伤和修复
施军平,Email:13957121199@126.com

