萱草新品种‘大眼睛’的组织培养技术研究
李 丹,李存华,胡胜科,徐洪富*
(1.山东英才学院艺术学院,山东 济南250001;2.山东农业大学林学院)
萱草新品种‘大眼睛’的组织培养技术研究
李 丹1,李存华2,胡胜科1,徐洪富1*
(1.山东英才学院艺术学院,山东 济南250001;2.山东农业大学林学院)
本研究以萱草新品种‘大眼睛’的茎尖为外植体,采用植物组织培养技术,建立一套完善的萱草快繁技术体系。以MS为基本培养基,添加了不同浓度的6-BA和NAA等植物植物生长调节剂,探讨了不同培养条件对‘大眼睛’启动培养、继代增殖培养和生根培养的影响。结果表明:适合‘大眼睛’的最佳启动培养基是MS+6-BA2.0mg/L+NAA0.5mg/L,不定芽分化率达76.7%,40d不定芽平均生长量为2.90cm。最佳增殖培养基为MS+6-BA4.0mg/L+NAA1.0mg/L,平均增殖芽数为4.97个。培养基1/2MS+IBA0.25mg/L有利于试管苗根系的生长,移栽成活率达100%。
组织培养;茎尖;萱草
萱草(Hemerocallis fulvaL.)属百合科萱草属,是一种多年生草本花卉,在我国有较长的栽培历史,被誉为“母亲花”。因其品种繁多,花色丰富,适应性强,栽培管理粗放等优点,常作为地被植物应用于园林绿化。萱草良种‘大眼睛’是山东英才学院于2012年3月份从荷兰引进的大花系列品种之一。其株高35cm~40cm;叶片较宽,丛生;花葶高度为50cm~60cm,挺出叶面,粗壮;花瓣橙红色反卷,边缘和中间部分有紫晕。花期6月中旬至9月上旬,无病虫害,耐寒性极强,在山东地区绿期可持续到11月中旬,能露地越冬。该品种目前鲜见应用于园林环境中。
萱草传统的分株繁殖最佳时间一般在春季3月中旬左右,叶片露出土面部分明显可见时为宜【1】,但繁殖系数低,再加上母株数量资源有限,在短时间内不能获得大量种苗,所以,本课题组采用组织培养技术建立‘大眼睛’的快速繁殖体系。经查阅文献资料发现,关于萱草组织培养技术的研究较多,但主要集中在‘金娃娃’、‘红运’、‘红宝石’、‘双玫瑰’、‘奶油卷’等少数品种上,外植体多选用萱草的花茎、叶片、原生质体等。虽然萱草的组织培养技术趋于成熟,但不同品种和外植体在启动培养效果、诱导分化培养基等方面存在较大差异。张洁茹等人(2014)选用4个萱草优良单株的花茎做外植体,在启动培养和增殖培养中呈现出差异性。宋雪莲(2011)对5个新品种多倍体萱草离体快繁技术的研究发现,不同萱草品种的增殖芽量、增值系数、生根状况在同种植物生长调节剂处理组合上存在较大的差异。因此,萱草品种对其基因型的依赖性较强,这就决定了每一个新品种的萱草属植物对组织培养各环节的要求是不一样的。课题组以萱草新品种‘大眼睛’幼嫩的茎尖为外植体,探讨不同激素浓度组合对启动培养、继代增殖、生根等环节的影响,旨在建立一套完善的工厂化快繁技术体系,为萱草分子育种等研究提供有力的技术支撑。同时,又能满足城市绿化对萱草新品种和数量的需求,推动萱草等宿根花卉在山东省的应用。
1 材料与方法
1.1 试验材料
供试材料来源于山东英才学院园林工程学院实训基地,选择生长健壮,无病虫害的一年生“大眼睛”植株。
1.2 试验方法
1.2.1 无菌材料的获得 将从田间挖取的植株冲洗干净泥土后带回实验室,去掉根系,用镊子将外层叶片剥去,放在烧杯中,加入2~3滴洗洁精,浸泡8~10min,将水倒掉,放在流水下冲洗1~2h。置于超净工作台上用75%酒精消毒20min,无菌水冲洗3次;转入0.1%升汞溶液浸泡8min,无菌水冲洗3次,消除升汞残留。用已经消毒的镊子和解剖刀再逐层剥去外层叶片,将幼嫩的茎尖取出,长度约1cm,放在无菌滤纸上备用。
1.2.2 启动培养阶段
将消毒完全的茎尖接种于不同芽诱导培养基上(表1)。以MS为基本培养基,添加不同浓度的6-BA、NAA两种植物生长调节物质。每个处理接种10块外植体,重复3次。4周后统计芽诱导率,筛选出启动培养最佳配方。

表1 启动培养实验设计
1.2.3 继代增殖培养 采取两因素完全随机实验设计,将初代培养获得的生长健壮的不定芽分别转接至继代增殖培养基上,观察比较6-BA(2.0、3.0、4.0mg/L)和NAA(0.5、1.0mg/L)不同浓度组合对芽增殖的影响。每个处理接种10个丛生芽,每个丛生芽有2~3个不定芽,重复3次。培养45d后,统计不定芽数,观察其生长状况,确定增殖培养最佳配方。
1.2.4 生根培养 选取高度3~4cm左右的生长健壮的不定芽分别接种至两种生根培养基上:①1/2MS+0.25mg/LNAA+30g/L蔗糖+7.5g/L琼脂;②1/2MS+0.25mg/LIBA+30g/L蔗糖+7.5g/L琼脂。每个处理接种10棵试管苗,3次重复。2周后统计生根数,计算生根率。
1.2.5 驯化与炼苗移栽 在培养室内打开瓶盖,炼苗3~5d后,移置温室取出已生根的健壮幼苗,洗净根部的培养基,移栽至已消毒的基质(泥炭土:蛭石:珍珠岩=3:1:1)中,搭拱棚罩上塑料布和遮阴网,保持湿度,避免幼苗水分流失。
1.2.6 培养条件
培养温度为25±1℃,光照强度为2000~3000lx,连续光照时间为12h/d;所有培养基均添加30g/L的蔗糖,7.5g/L琼脂,PH5.8~6.0,并在121℃、1.1kg/㎡压力下高温高压灭菌20min。
2 结果分析
2.1 6-BA和NAA对启动培养的影响

图1 ‘大眼睛’茎尖诱导的愈伤组织Fig.1 Callus induced from shoots of H.hybrida‘Big Eye’
将已消毒的外植体接种到培养基上,10d后茎尖基部开始萌动,逐渐膨大,产生淡黄色质地密度均匀的愈伤组织(图1)。25d后,愈伤组织上萌发出黄绿色的不定芽。40d后部分不定芽展开鲜绿色的嫩叶,每个外植体平均诱导出2~3个不定芽。
从表2可以看出,6-BA和NAA对萱草的芽分化率和生长量均有显著影响。对萱草组培芽分化率的多重比较表明,6-BA浓度为2.0mg/L时不定芽分化率达到最高,其次是0.5mg/L和1.0mg/L。当6-BA浓度为0.5mg/L时,随着NAA浓度的增加,芽分化率呈下降趋势,而芽平均生长量则成正比。在B9处理中发现,40d后不定芽平均生长量为3.05cm,但后期生长过程中叶片出现水渍现象,这说明可能植物生长调节浓度过高。所以,综合分析植物生长调节剂对不定芽诱导率和生长状况的影响,最佳启动培养基是 MS+6-BA2.0mg/L+NAA0.5mg/L,芽分化率达到76.7%,40d不定芽平均生长量为2.90cm。

表2 6-BA、NAA对启动培养的影响
2.2 丛生芽的诱导与增殖培养
继代增殖培养是获得萱草新品种大量种苗的关键环节,而增殖系数的多少是重要的衡量指标。当丛生芽生长高度为2~3cm时,将其分离转接到添加不同植物生长调节剂浓度组合的继代培养基中。10d左右丛生芽基部膨大产生芽点,最多可增殖5~6个不定芽(图2、图3)。不定芽发生较为密集,但单株不定芽增殖系数较低,甚至不能增殖,这与宋雪莲的研究结果一致。若增殖培养时间超过50d,会出现叶片卷曲、枯黄脱落的现象,应及时转到壮苗培养基或生根培养基上培养。

图2 不定芽增殖Fig.2 Adventitious shoots germination of H.hybrida‘Big Eye’

图3 愈伤诱导的不定芽Fig.3 Adventitious shoots induced from Callus of H.hybrida‘Big Eye’
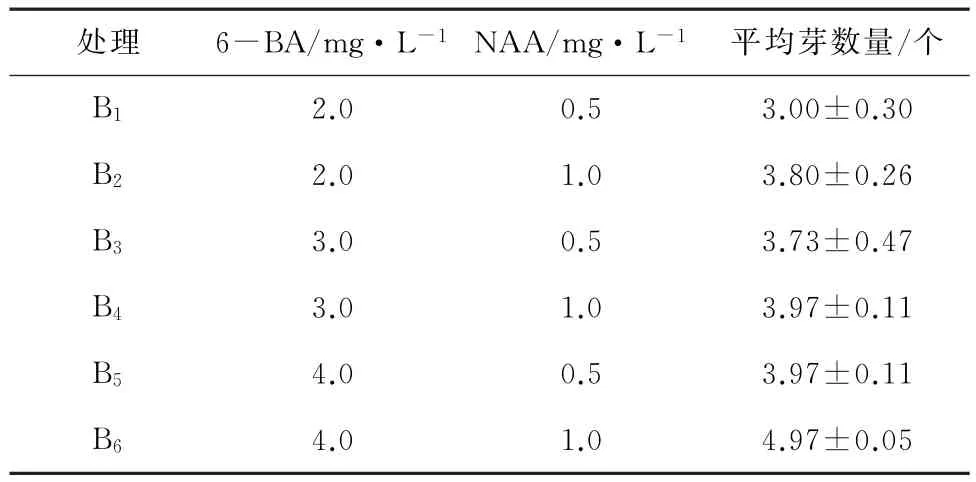
表3 6-BA、NAA对组培苗增殖培养的影响
表3结果显示:当BA为4.0mg/L时,增殖效果比较好,和BA为2.0mg/L处理有极显著差异。在实验中发现随着BA浓度的加大,茎段底部愈伤组织增多,有利于茎芽的生长。在含有0.5mg/L BA和1.0mg/LNAA培养基上的平均芽数达到3~4个,且生长状态较好。因此,‘大眼睛’最佳增殖培养基为 MS+6-BA4.0mg/L+NAA1.0mg/L+30g/L蔗糖+7.5g/L琼脂。
2.3 生根与移栽

图4 ‘大眼睛’的生根苗Fig.4 Rooted plantlets of H.hybrida‘Big Eye
从丛生芽上切取生长健壮的单芽,接种于 1/2MS+0.25mg/LNAA、 1/2MS+0.25mg/LIBA两种生根培养基上。培养10d左右,小芽基部膨大长出3~4条2.0~3.0cm长的不定根(图4),根系健壮,部分长出侧根,生根率均为92%以上。通过观察发现,两种培养基也呈现出不同的特点:在1号培养基中不定根萌发较早,生长快,但须根较少,根系不发达;2号培养基生长较缓慢,但须根较多,较发达,叶片较大而伸展。所以,2号培养基是‘大眼睛’最佳的生根培养基。另外,随着苗高的增加,叶片会出现弯曲、逐渐变黄导致生长势减弱,影响后期的移栽成活率。选择根系发达、须根较多的瓶苗经驯化后移栽入草炭土:蛭石、珍珠岩=3:1:1混合的基质中,适当遮荫,成活率可达100%,说明萱草生根、移栽较粗放,成活率高,但移栽时避免根系过长,勿产生窝根、断根的情况。
3 讨论与结论
该研究是在校园土壤贫瘠、盐碱化程度较严重的情况下,引进‘大眼睛’等多个萱草新品种,建立了资源圃。为了能满足市场对萱草种类和数量的需求,降低引种成本,促进萱草属植物在山东省的应用和发展,课题组已建立萱草 ‘大眼睛’、‘紫桔’、‘沙克’等5~6个新品种的快繁技术体系,为规模化和产业化生产提供技术支撑。
以高度为1cm左右的茎尖为外植体进行启动培养,研究发现,将茎尖基部靠近根部的组织切成薄片接种到启动培养基上也可以诱导产生愈伤组织,但分化率较茎尖部分低很多,这可能由于靠近根部的组织较为成熟。另外,启动培养阶段部分植物材料会发生褐化现象。褐化是培养材料在培养过程中不断产生酚类或酶类化合物所造成的,严重会导致材料死亡,多发生在木本植物中。萱草在不断的培养过程中也会发生褐化现象,①灭菌时间过长造成组织受损;②在同一培养基中培养时间过长,如不定芽在同一培养基中培养时间超过40d左右就会发生褐化现象,基部吸收营养不足,导致叶片枯黄,采取勤转瓶,缩短培养时间等方法可以有效减少褐化的产生。
植物生长调节剂是组织培养技术中的关键因素,对诱导不定芽、继代增殖等效果明显。很多研究表明,在配合使用6-BA和NAA的情况下,不定芽诱导率要高于单独使用6-BA。本次研究的大多数环节都应用的6-BA和NAA两种激素,而且效果明显,萱草‘大眼睛’其最佳启动培养基是 MS+6-BA2.0mg/L+NAA0.5mg/L,在 MS+6-BA4.0mg/L+NAA1.0mg/L培养基上增殖效果最好。因此没有选用其他植物生长调节剂进行试验,后续试验可以尝试更多的激素种类和浓度组合。但激素浓度过大,会引起组织的玻璃化或褐化。研究发现,萱草新品种‘大眼睛’在6-BA、NAA两种激素浓度分别为2.0mg/L和1.0mg/L时,不定芽的叶片、茎段呈水渍状态,产生玻璃化现象。而将玻璃化苗转入不添加任何激素的MS培养基,叶片、茎段又能恢复正常。这说明,6-BA和NAA的浓度降低甚至是不添加任何激素的培养基,可有利于玻璃化苗转化为正常苗。
[1]朱华芳,胡永红,瞿蒙涛.萱草园艺品种繁殖技术研究[J].安徽农业科学,2007,35(16):4833-4834.
[2]杨丽莉,张晓,杨睿,等.大花萱草‘莎蔓’的组织培养技术研究[J].北方园艺,2012,(19):134-137.
[3]张洁茹,刘晓嘉,陈丽飞,等.萱草优良单株花茎离体快繁[J].东北林业大学学报,2014,42(2):73-77.
[4]宋雪莲.5种新品种多倍体萱草离体快繁技术的研究[D].吉林农业大学,2011.
[5]张伟丽,金欣庆.大花萱草新品种‘奶油卷’的组织培养和生产应用[J].植物生理学通讯,2007,43(1):129-130.
[6]安凤霞,陈菲,卢宝伟.红花萱草离体繁殖技术研究[J].国土与自然资源研究,2008,(4):82-83.
[7]解有利,陈兰芬,石进朝.大花萱草组织培养研究[J].北京农业职业学院学报,2002,21(5):25-27.
[8]赵芯玫,朱玉菲,等.黄色系花的文化意蕴及其在北京园林中的应用[J].中国农学通报,2010,426(5):179-183.
[9]刘静芳.萱草在北方地区的绿化应用[J].农家之友,2010,(7):102-104.
[10]黎海利,董丽.萱草种质资源研究概况[J].北方园艺,2007,(8):58-60.
[11]陈丽飞,董然.萱草属植物研究进展[J].北方园艺,2007,(6):66-69.
[12]刘静芳.萱草在北方地区的绿化应用[J].农家之友,2010,7:102-104.
[13]吴铁明,于晓英,冯爽英,等.生重瓣大花萱草的选育研究[J].湖南农业大学学报(自然科学版),2002,,28(2):122-124.
[14]杨永花.金娃娃萱草组织培养技术研究[J].甘肃农业科技,2003(12):33-35.
[15]吴铁明,于晓英,冯爽英,等.生重瓣大花萱草的选育研究[J].湖南农业大学学报(自然科学版),2002,28(2):122-124.
[16]文伟,杨骥.萱草在生体系技术建立的研究[J].中国园艺文摘,2010,(3):8-10.
[17]刘长利,崔俊茹.萱草组织培养及再生植株的研究[J].中华中医药学刊,2007,25(12):51-53.
[18]王淼媛,张欣欣,刘玫等.东北萱草属(Hemerocallis)植物学研究的回顾与展望[J].哈尔滨师范大学自然科学学报,2008,(24):84-87.
[19]李国泰.大苞萱草染色体的核型分析[J].生物学通报,2006,,41(2):50-51.
[20]王春婷,石大兴,王米力.紫萼玉簪的组织培养和快速繁殖[J].植物生理通讯,2006,4(42):685.
Research on Tissue culture technique ofHemerocallis hybrida‘Big Eye’
LI Dan1,LI Cunhua2,HU Shengke1,XU Hongfu1*
(1.Artisic Collage,Shandong Yingcai University,Jinan250001;2.Forestry Collage,Shandong Agriculture University)
The young shoots ofHemerocallis hybrida‘Big Eye’were used as explants in the study.Through the plant tissue culture techniques,the experiment studied the establishment ofH.hybrida‘Big Eye’rapid propagation system.Using MS as the basic medium supplemented with different concentrations of 6-BA and NAA plant growth regulating substances,in order to study the effect of different culture conditions onH.hybrida‘Big Eye’in vitro starting culture,proliferation and rooting culture.The results showed that the optimum initiation and multiplication medium was MS+6-BA2.0mg/L+NAA0.5mg/L,adventitious bud differentiation rate was 76.7%,and adventitious bud average growth was 2.90cm after 40d;the best multiplication culture medium was MS+6-BA4.0mg/L+NAA1.0mg/L,and proliferation bud number in 4.97 on average;the best rooting medium was 1/2 MS+IBA0.25mg/L,the rate of survival was 100%.
tissue culture;shoots;Hemerocallis hybrida
SQ813.1+2
A
1002-2724(2016)06-0032-04
2016-10-20
山东英才学院2013年度校级重点课题(13YCZDZR04)
李丹(1986-),女,山东济南人,讲师,研究生,硕士,现主要从事园林植物组织培养等研究工作。
*通讯作者:徐洪富(1962),男,山东临朐人,教授,博士生导师,本科,研究方向是园林植物资源收集、病虫害防治。

