Th17/Treg及其相关细胞因子在阿霉素肾病大鼠血清及肾组织中的表达水平及意义
吴玉辉 刘艳娟 渠巍 李宇红 徐海霞 应蓓 邱杰 林俊 邵晓珊*
(1.贵州医科大学研究生院,贵州 贵阳 550004;2.贵州省妇幼保健院检验科,贵州 贵阳550003; 3.贵州省妇幼保健院儿童肾脏免疫风湿科,贵州 贵阳 550003)
·论 著·
Th17/Treg及其相关细胞因子在阿霉素肾病大鼠血清及肾组织中的表达水平及意义
吴玉辉1刘艳娟1渠巍2△李宇红3徐海霞3应蓓3邱杰3林俊3邵晓珊3*
(1.贵州医科大学研究生院,贵州 贵阳 550004;2.贵州省妇幼保健院检验科,贵州 贵阳550003; 3.贵州省妇幼保健院儿童肾脏免疫风湿科,贵州 贵阳 550003)
目的 探讨阿霉素(ADM)肾病大鼠 Th17 相关的IL-17 和Treg相关的IL-10 表达水平及意义。方法 采用一次性尾静脉注射阿霉素的方法制备大鼠ADM模型,对照组注射等量的生理盐水,ADM组20只大鼠在造模后尿蛋白均达到50 mg/24 h 以上,表明造模成功,采用流式细胞术检测外周血中 Th17细胞和Treg 细胞数量及比例;ELISA法检测各组血清和肾组织中Th17 相关的IL-17 和 Treg相关IL-10 水平。结果 ADM模型组大鼠在第14天出现蛋白尿,随着时间的推移,蛋白尿的量持续升高,在第56天达到峰值,各时间点(14,28,42,56 d)ADM组大鼠的蛋白尿水平明显高于同时间的对照组(P<0.001);ADM组和对照组 Th17 细胞百分率分别为(3.13±0.09)%、(0.88±0.05)%,ADM组较对照组明显升高(P<0.001) ;ADM组和对照组 Treg细胞百分率分别为(1.94±0.15)%、(5.02±0.15)% ,ADM组明显低于对照组(P<0.001);ADM组Th17/Treg细胞比例较对照组高(P<0.001),ADM组大鼠(14,28,42,56 d)的血清及肾组织 IL-17表达水平明显高于对照组(P<0.001);IL-10表达水平明显低于对照组(P<0.001)。结论 Th17/Treg为主的免疫失衡在ADM发病中起重要作用,可通过抑制或中和内源性 IL-17 的表达和提升Treg的表达纠正失衡的 Th17/Treg,此方法可能成为儿童原发性肾病(PNS) 治疗的新途径之一。
Th17/Treg; IL-17; IL-10; 儿童原发性肾病
肾病综合征的发病机制与全身免疫功能包括细胞免疫及体液免疫功能紊乱有关[1]。按病因可分为原发性、继发性及先天性三种,原发性肾病综合征(Primary nephrotic syndrome,PNS)占90%以上,是儿童时期常见的慢性肾小球疾病,在儿科肾脏病中占首位,是引起我国儿童肾功能衰竭的原发疾病,部分患儿在应用糖皮质激素和免疫抑制剂后可获得缓解,但副作用大且复发率高。本研究采用一次性尾静脉注射盐酸阿霉素(ADM)的方法制备SD大鼠的肾病模型,流式细胞检测外周血Th17及Treg细胞数量,并测定血清和肾组织中Th17 细胞相关的白细胞介素( IL-17) 和 Treg细胞相关的白介素(IL-10)水平,旨在初步探讨ADM肾病大鼠相关的 Th17/Treg比例及其相关细胞因子IL-17 和IL-10 表达及意义,为临床预防PNS提供理论依据。
1 材料与方法
1.1 材料与试剂 SD大鼠,雄性,体质量180~200 g,购于贵州医科大学实验动物中心,随机分为对照组( 20只) 和模型组( 20只) 。主要试剂及仪器:Anti-Rat CD3 FITC,Anti-Rat CD8a PE ,Anti-Rat IL-17A APC,Anti-Rat CD4 ECD,Anti-Rat CD25PE,Anti-Rat Foxp3 Percp cy5,APC同型对照单抗IgG1,Percp cy5同型对照IgG2 (美国EBI公司),PMA、Monensin、ionomycin、固定液、破膜剂(联科生物公司),RPMI1640培养基( 美国 Gibco 公司),小牛血清(北京艾然生物科技有限公司公司),胰蛋白酶(美国 Gibco公司),大鼠IL-17和 IL-10 ELISA试剂盒(美国R&D生物公司),尿蛋白定量试剂盒(泰思腾生物),PT3502PC酶标仪(北京普天),FACSCalibur流式细胞仪(美国BD公司)。
1.2 方法
1.2.1 阿霉素肾病模型的建立 阿霉素用无菌生理盐水稀释成50%(W/V)的溶液,模型组大鼠一次性尾静脉注射阿霉素溶液6.5 mg/kg,对照组注射等量生理盐水,SPF级条件饲养,自由饮食和进水。
1.2.2 检测指标及方法 (1)24 h尿蛋白检测: 分别在注射阿霉素后第13,27,41,55天将两组大鼠单独喂养在代谢笼中,收集24 h尿液,尿标本离心后取上清,记录24 h尿量; 采用邻苯三酚红钼络合法检测尿蛋白定量。(2)流式细胞术检测Th17细胞的百分率:实验第56天将各组大鼠在乙醚麻醉下用肝素钠抗凝管自股静脉采血3 mL,取250 μL全血标本,用RPMI-1640培养基(不含胎牛血清-FBS)1∶1等体积稀释至500 μL,标记测样管和对照管,每管取250 μL稀释液分别加入1 μL PMA(0.1 mg/mL)、5 μL Ionomycin (1 mg/mL)、1 μL Monensin(50 mg/mL)混匀后于37 ℃、5% CO2培养箱中培养12 h,离心弃上清,加入1 mL红细胞裂解液,室温裂解5 min,离心弃上清,PBS重悬将细胞悬液转移至1.5 mL EP管中,2 500 r/min离心5 min,弃上清,PBS洗两次后加入1 μL Anti-Rat CD3 FITC(0.5 mg/mL), 1 μL Anti-Rat CD8a PE(0.2 mg/mL)室温避光孵育30 min,PBS洗1次后弃上清,加入0.5 mL 固定液,室温避光孵育 20 min,加入1 mL PBS清洗1次,1 000 r/min离心5 min弃上清,加入1 mL破膜剂室温避光孵育20 min,1 000 r/min离心5 min,弃上清,PBS洗1次后分别在测样管中加入1 μL Anti-Rat IL-17A APC(0.2 mg/mL)及同型对照管中加入1 μL单抗APC-IgG1,4 ℃避光孵育30 min,PBS各洗1次,1 000 r/min离心5min弃上清,0.5 mL PBS重悬细胞,上流式细胞仪检测CD3+CD8-IL-17+细胞数量。(3)流式细胞术检测Treg细胞的百分率:取200 μL全血 ,标记测样管和对照管,每管取100 μL全血,分别在每管中加入1 μL Anti-rat CD4 ECD、1 μL Anti-rat CD25 PE,室温避光孵育30 min,1 000 r/min离心5 min弃上清,1 mL PBS 悬浮细胞,1 000 r/min离心5 min弃上清,加入1 mL红细胞裂解液,室温裂解5 min,1 000 r/min离心5 min弃上清,每管分别加入0.5 mL的Foxp3固定液混匀,室温避光反应20 min,用1 mL PBS洗1次,1 000r/min 离心后弃上清,每管加入1 mL 破膜液重悬细胞,室温避光孵育20 min,1 000 r/min离心5 min,弃上清,PBS洗1次后分别加入1 μL Anti-rat Foxp3 Percp cy5(测样管),1 μL 同型对照单抗Percp cy-IgG2(对照管),室温避光孵育30 min,PBS各洗1次,1 000 r/min离心5 min弃上清,0.5 mL PBS重悬细胞,上流式细胞仪检测CD4+CD25+Foxp3+细胞数量。(4)细胞因子测定: 实验第14,28,42,56天将各组大鼠在乙醚麻醉下自股静脉采血5 mL,室温静置20 min,4 ℃ 2 000 r/min离心15 min,分离血清。剖腹取肾,将肾组织匀浆后离心,取上清液3 mL,均置于-20 ℃冰箱保存备用,采用 ELISA法测定血清和肾组织中 IL-17和 IL-10 的水平,具体方法参见 R&D公司产品说明书。

2 结 果
2.1 两组大鼠24h尿蛋白变化 ADM组20只大鼠在造模后尿蛋白均达到50 mg/24 h 以上,表明造模成功。模型组大鼠在第14天出现蛋白尿,随着时间的推移,蛋白尿的量持续升高,在第56天达到峰值,各时间点模型组大鼠的蛋白尿水平均明显高于同时间的对照组大鼠,差异均有统计学意义(P<0.001)。见表 1。

表1 两组大鼠24h尿蛋白变化
2.2 Th17/Treg细胞数量及比例 对照组Th17(0.88±0.05)%,Treg(5.02±0.15) %, Th17/Treg(0.18±0.01);实验组Th17(3.13±0.09) %,Treg(1.94±0.13) %, Th17/Treg(1.61±0.09)。和对照组相比,ADM组大鼠外周血Th17/Treg细胞数量均升高(P<0.001), Treg细胞数量明显降低(P<0.001),Th17/Treg细胞比例增高(P<0.001), 见图1~2。
2.3 两组大鼠血清 IL-17和IL-10 水平比较 ADM组大鼠第14,28,42,56天血清 IL-17水平明显高于对照组 (P<0.001) ; 而IL-10水平明显低于对照组 (P<0.001),见表2。
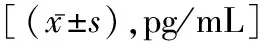
表2 两组大鼠血清IL-17和IL-10 水平
2.4 两组大鼠肾组织IL-17和IL-10 水平比较 ADM大鼠第14,28,42,56天肾组织 IL-17水平明显高于对照组(P<0.001);而IL-10明显低于对照组 (P<0.001),见表3。
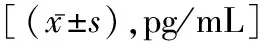
表3 两组大鼠肾组织IL-17和IL-10 水平比较
3 讨 论
阿霉素是一种治疗急性白血病和多种实体瘤的有效常用化疗药物, 目前已对其进行了较为广泛的基础和临床实验,突出性质是能够诱发大鼠典型肾病综合征表现, 而且该肾病模型具有慢性进展性肾损害的特点, 早期肾组织大致正常, 中期肾小球上皮空泡变性,晚期节段性或全小球硬化,这与人类进行性肾脏疾病的表现过程非常类似,ADM 肾病模型为研究肾病蛋白尿、滤过屏障损害肾小球硬化机理等提供了比较理想的实验条件, 现已成为研究肾脏病的重要工具。
研究[2]发现Th17细胞在自身免疫性疾病发病过程中起着重要作用,Th17细胞是新发现的一个不同于Th1和Th2细胞的T细胞亚群,Th17细胞参与调节和控制免疫应答,在自身免疫性疾病中发挥着重要作用,IL-17是Th17细胞分泌的主要效应细胞因子,其受体分布于体内多种组织,是一种强大的前炎症细胞因子,也是炎症反应的微调因子,通过促进中性粒细胞和单核细胞聚集诱导细胞释放前炎症因子引起炎症细胞浸润和组织损伤,参与肾脏炎症反应的发生和发展,在宿主抗细菌感染免疫中发挥重要作用[3-4]。它在慢性炎症疾病及自身免疫性疾病的发病机制中的作用也成为了研究热点[5]。
Treg是具有显著免疫抑制作用的CD4+T细胞亚群,由 CD4+T 细胞分化而来,Treg 表达Foxp3,通过接触抑制及释放抗炎因子 IL-10及 TGF-β,并通过多种途径抑制细胞增殖、炎性因子和抗体的产生、抑制记忆T细胞的功能,还能诱导效应细胞的凋亡[6],Th17细胞与Treg细胞在机体上处于动态平衡,相互拮抗和排斥,Th17促进炎症反应和免疫反应,Treg抑制免疫应答,维持免疫耐受[7]。Th17和Treg的相互调控,使机体效应和抑制处于一种精细而复杂的平衡状态,当机体发生异常时,Th17/Treg功能失衡引起一系列炎症免疫反应损伤机体,研究[8]发现 Th17/Treg的失衡预示炎症性疾病恶化,本研究表明阿霉素肾病模型大鼠中Th17细胞的表达水平较对照组明显升高(P<0.001),Treg细胞的表达水平降低(P<0.001), Th17/Treg比例增高(P<0.001),阿霉素肾病模型大鼠血清和肾组织的IL-17表达水平较对照组明显升高(P<0.001),IL-10表达水平较对照组降低(P<0.001)。综上所述,我们通过对Th17和Treg细胞及其相关细胞因子的检测,明确了Th17和Treg细胞表达情况,Th17/Treg 为主的免疫失衡在ADM 发病中起重要作用,但两种相关免疫细胞在阿霉素肾病大鼠的失衡变化的具体机制还有待进一步研究,或可通过抑制或中和内源性 Th17 和提升 Treg 的表达纠正失衡的 Th17/Treg,有望为深入研究PNS的病因和发病机制提供理论依据,进而找到有效的治疗方法,具有重要的基础和临床研究价值。
(本文图1~2见封三)
[1] Fiser RT,Arnold WC,Charlton RK,et al. T-lymphocyte subsets in nephrotic syndrome[J]. Kidney Int,1991,40:913-916.
[2] Shao XS,Yang XQ,Zhao XD,et al.The prevalence of Th17 cells and POXP3 reguLate T cells(Treg) in children with primary nephrotic syndrome[J].Pediatr Nephrol,2009,24(9):1683-1690.
[3] 林佳如,杨满,张晓燕,等.Th17 细胞与肾脏疾病关系的研究进展[J].国际泌尿系统杂志,2012,32(3):415-418.
[4] Steinmetz OM,Summers SA,Gan PY,et al. The Th17-defining transcription factor RORγt promotes glomeruLonephritis[J].J Am Soc Nephrol,2011,22(3):472-483.
[5] Gaffen SL.Recent advances in the IL-17 cytokine family [J] .Curr Opin Immunol,2011,23(5):613-619.
[6] BetteIIi E,Oukka M,Kuchroo VK,et al. Th17 cells in the circle of immunity and autoimmunity [J].Nat Immumol,2007,8(4):345-350.
[7] Estelle B,Yijun C,Wenda G,et al.Reciprocal developmental pathways for the generation of pathogenic effector Th17 and reguLatory T cells[J]. Nature,2006,44:1
[8] Favre D,Lederer S,kanwa B,et al.Critical loss of the balance between Th17 and T reguLatory cell popuLations in pathogenic SIV infection[J].ploS Pathog,2009,5(2):e1000295.
Significance and expression of variation of Peripheral Blood Th17/Treg cells and cytokines in Sprague Dawley rat induced by adriomycine
WuYuhui1,LiuYanjuan1,QuWei2,LiYuhong3,XuHaixia3,YingPei3,QiuJie3,LinJun3,ShaoXiaoshan3.
1.TheGraduatedSchoolofGuizhouMedicalUniversity,Guiyang550004,China. 2.DepartmentofClinicalLaboratory,GuiyangMaternal&ChildHealthCareHospital,Guiyang550003,China. 3.DepartmentofNephrologyofImmunization,GuiyangMaternal&ChildHealthCareHospital,Guiyang550003,China.
Objective To investigate the variation of Th17/Treg cells in Peripheral Blood and related cytokines (IL-17/IL-10) in Sprague Dawley (SD) rat induced by adriomycine (ADM). Methods SD rats were randomly grouped in vehicle control (n=20) and ADM model (n=20), Model group were injected with ADM via tail vein (6.5 mg/kg/body weight) , while control group were injected same amount of normal saline(NS). Peripheral blood (PBL) and Renal tissue were collected after injection at different time points (14, 28, 42, 56 d). Th17 and Treg cell numbers in PBL were analyzed by flow cytometry . Enzyme linked immunosorbant assay (ELISA) were performed for detection of IL-17 and IL-10 in both PBL and renal tissue. Results ADM model were successfully established for further investigation. Biochemical results indicate the level of proteinuria were increased in ADM model in comparison with vehicle control after 14 days of injection(P<0.001), which reached peak levels after 56 days . Flow cytometric staining reveals CD4+CD8-IL-17+were higher in ADM (3.13±0.09)% compared to control (0.88±0.05)%, whereas CD4+CD25+Foxp3+cells were lower in ADM (1.94±0.13)% compared to control (5.02±0.15)% (P<0.001). Further, ELISA show IL-17 in serum and renal tissues were significantly higher in ADM compared to control (P<0.001), while IL-10 were observed lower compared to control (P<0.001). Conclusion Th17/Treg immune cells play a significant role in the pathogenesis of ADM ,which suggests it may be rectified vianeither inhibit or neutralize the expression of IL-17 and enhance Treg cells of expression. Possibly, the research above all may provide one of novel methods for treatment of primary nephrotic syndrome (PNS).
Th17/Treg; IL-17; IL-10; PNS
国家自然科学基金项目(项目编号: NS2014-11)
R726.9
A
1000-744X(2016)09-0899-03
2016-06-10)
△*通信作者,△E-mail:doctor_quweichina@126.com;*E-mail:sxs22@sina.com

