马身猪和大白猪背最长肌Rac1基因发育性表达研究
王泽艺,石建中,刘郑煜,高鹏飞,浦忠得,杨青春,郭晓红,李步高,曹果清*
(1.山西农业大学 动物科技学院,山西 太谷 030801; 2.大同市种猪场,山西 大同 037000)
马身猪和大白猪背最长肌Rac1基因发育性表达研究
王泽艺1,石建中2,刘郑煜1,高鹏飞1,浦忠得1,杨青春1,郭晓红1,李步高1,曹果清1*
(1.山西农业大学 动物科技学院,山西 太谷 030801; 2.大同市种猪场,山西 大同 037000)
[目的]探究Rac1基因mRNA和蛋白质在马身猪和大白猪背最长肌组织中的发育性表达规律,揭示Rac1基因与猪肌肉发育之间的关系。[方法]采用qRT-PCR和Western blot技术检测马身猪和大白猪从1日龄到180日龄(1、30、60、90、120、150和180日龄)阶段背最长肌中Rac1基因的表达规律。[结果]Rac1基因mRNA在大白猪1日龄、120日龄和180日龄时表达量较高,与其他日龄相比差异极显著(P<0.01),其他日龄表达量均维持在较低水平;马身猪60日龄时Rac1 mRNA表达量最高,极显著地高于其他日龄(P<0.01),90日龄次之,其他日龄表达水平较低,且日龄间表达量无显著差异。在蛋白质水平上,从1日龄到180日龄,大白猪Rac1表达量整体呈先降低后升高的趋势,在1日龄时表达量最高,120日龄表达量最低;马身猪整体呈先升高后降低的趋势,60日龄时表达量最高,极显著高于其他日龄(P<0.01),随后几个月龄的表达量处于较低水平,显著低于1日龄和30日龄(P<0.05)。品种间比较,马身猪Rac1蛋白表达量始终高于大白猪,且在1日龄和60日龄,差异极显著(P<0.01),在120日龄和150日龄,差异显著(P<0.05)。[结论]猪背最长肌中Rac1基因mRNA和蛋白质的表达量与猪的年龄及遗传背景有关。
猪;Rac1基因; 发育性表达
Ras 相关的C3 肉毒素底物1(ras-related C3 botulinum toxin substrate 1,Rac1)是Rho家族Rac亚家族成员,该亚家族具有Rac1、Rac2、Rac3以及Rac1的剪切突变体Rac1b等4种同工酶形式。Ras超家族是一个能编码GTP酶的超家族,该超家族成员众多,能编码100多种酶类[1]。该家族成员编码的小G蛋白有共同的G结构域核心,提供GTP酶与GTP/GDP交换活性[2]。Rac1基因生物学功能的发挥依赖于GTP酶在有活性GTP结合形式和无活性的GDP结合形式之间循环[3,4]。Rac1作为细胞内重要的信号转换器,在细胞的增殖分化与凋亡、肌动蛋白动力学、胞内吞噬作用以及细胞物质交换等方面发挥重要作用[5,6]。
最近研究发现,Rac1基因在小鼠的四肢肌肉、膈肌、舌肌以及躯干肌中均有表达[7]。Nobuyuki等[8]研究表明,在小鼠腓肠肌中Rac1基因表达于肌细胞膜的外围。Rac1基因在调控成肌细胞融合中具有重要作用,能够调控成肌细胞细胞周期,抑制肌前体细胞的产生促进成肌细胞融合[9,10]。Sophie等[11]在体外有增殖能力的C2C12细胞中添加了Rac1的化学抑制剂NSC23766,2 d后使用Western blot技术检测,发现Rac1的活性显著下降,6 d后发现没有肌管形成。
马身猪是山西省地方优良品种,适应性强,繁殖力高,抗病力和抗逆性强,肉质细嫩,肌肉大理石纹适中,肉香味浓,但生长速度较慢,产肉率相对较低,脂肪沉积相对较多。大白猪是国外引进品种,相对于马身猪,生长速度快,产肉率相对较高。目前,有关家畜Rac1基因的研究相对较少。本文采用qRT-PCR和western blot技术检测马身猪和大白猪从1日龄到180日龄阶段背最长肌中Rac1基因的发育性表达规律,探讨该基因的表达特性及与肌肉生长发育的关系。
1 材料与方法
1.1 试验材料
1.1.1 试验动物与样品采集
大白猪和马身猪在相同的环境下饲养(大同市种猪场提供),分别在1日龄、30日龄、60日龄、90日龄、120日龄、150日龄和180日龄时称重并屠宰,每日龄各取4头(公母各半,公猪断奶时去势)。屠宰后,取其背最长肌组织,铝箔包裹后放于离心管中,置于液氮罐中速冻,-80 ℃保存备用。
1.1.2 主要仪器及试剂
Stratagene Mx3000P实时荧光定量PCR仪(美国Stratagene),ND-1000微量核酸蛋白测定仪(美国Nanodrop),Centrifuge 5415R高速冷冻离心机(德国 Eppendorf),紫外凝胶成象系统(BIO-RAD,美国), Mini-PROTEAN®Tetrasystem(BIO-RAD,美国),MiniTrans-Blot®CellModule(BIO-RAD,美国);Trizol®Reagent(Invitrogen,美国),SYBR PrimeScriptTMRT-PCR Kit(TaKaRa),PrimeScript®RT Master Mix Perfect Real Time(TaKaRa)。
1.2 试验方法
1.2.1 总RNA提取及cDNA的合成
Trizol法提取总RNA,电泳采用的是非变性琼脂糖凝胶电泳,用来检测所抽提的RNA的完整性,ND-1000微量核酸蛋白测定仪检测RNA的浓度和纯度。根据Prime Script?RT Master Mix Perfect Real Time反转录试剂盒说明书进行反转录。第一步: 5×gDNA Erase Buffer 2 μL,gDNA Eraser 1 μL,Total RNA 2 μL (500 mg·L-1), ddH2O补充至10 μL体系,42 ℃ 2 min的程序进行PCR;第二步:上一步变性、退火后反应液10 μL,5×PrimeScript Buffer2(for Real Time)4 μL,RNaseFree dH2O 4 μL,RT Primer Mix 1 μL,PrimeScript RT Enzyme 1 μL,再以37 ℃ 15 min,85 ℃ 5 s的程序进行PCR。反转录产物cDNA于-20 ℃保存。
1.2.2 引物的设计与合成
根据NCBI核酸数据库中猪Rac1基因mRNA序列(GenBank登录号:NM_001243585.1),运用NCBI网站Primerblast设计Rac1引物,由华大基因合成,内参18SrRNA引物为实验室保存,引物序列信息见表1。
1.2.3 qRT-PCR检测
第一步反转录合成的cDNA保持其原始浓度,不做任何处理,作为其初始浓度保留,随后取出10 μL 原始浓度cDNA,2倍梯度依次往下稀释8个浓度梯度,稀释过程中注意操作的规范性。最终建立Rac1基因和18SrRNA的标准曲线,以上全部完成后进行实时荧光定量PCR检测。根据SYBR®Premix Ex TaqTMII试剂盒说明书进行实时荧光定量PCR检测,设定PCR反应总体系为20 μL,即SYBR®Premix Ex TaqⅡ10 μL,上、下游引物(10 μmol·L-1) 各0.8 μL,ROX 0.4 μL,cDNA 2 μL,ddH2O 6 μL,反应溶液充分混合均匀。PCR扩增程序为95 ℃预变性30 s,1个循环;95 ℃变性20 s,63 ℃退火及延伸34 s,45个循环;95 ℃ 20 s,60 ℃ 1 min,95 ℃ 20 s,1个循环。实验数据得出后,采用2-△△CT法对基因mRNA的表达量进行数据统计,计算目的基因相对表达量。
表1Rac1和18SrRNA引物信息
Table 1 Primer sequences ofRac1 and 18SrRNAgenes

基因GenesGenBank登录号GenBankaccessionNo.引物序列(5'-3')Primersequence(5'-3')退火温度/℃Annealingtemperature产物大小/bpproductsizeRac1NM_N001243585.1F:CAGTTACACGACCAATGCCTR:CCAGCCGTATCCCATAAGCC6011718SrRNANR_046261.1F:CCCACGGAATCGAGAAAGAGR:TTGACGGAAGGGCACCA60122
1.2.4 蛋白印迹反应
取适量液氮研磨组织,组织充分研磨后取0.1 g置于2 mL的离心管中,按照博士德公司总蛋白抽提试剂盒使用说明书提取总蛋白。样品抽提好后使用核酸蛋白测定仪检测蛋白质的纯度,BCA蛋白浓度测定法测定蛋白质浓度。待样本检测没有问题后,取2 μL 6×的蛋白变性上样缓冲液与30 μg总蛋白震荡混匀后加到PCR管中,用10%的SDS溶液补充所有样本至10 μL,使用金属浴95 ℃变性5 min后上样,进行SDS-PAGE电泳。电泳条件如下:80 V跑5%浓缩胶30 min,120 V跑12%分离胶60 min,至溴酚蓝到玻璃板底部时停止电泳。电泳结束后,切胶,转膜条件为恒压120 V湿转90 min于NC膜(0.22 μm)上。以上步骤完成后使用封闭液进行封闭,封闭液使用的是5%的脱脂奶粉,封闭时间是90 min。随后进行一抗孵育(一抗稀释比例为 Rac1 1∶1 500、GAPDH 1∶3 000),4 ℃摇床孵育过夜。第二天使用TBST洗膜,每次10 min,共洗3次,每次洗膜更换新的TBST;二抗室温摇床孵育90 min,同样TBST洗膜,每次10 min,共洗3次。ECL化学发光法进行显色反应,凝胶成像系统成像,使用Image labTMsoftware version 4.0分析软件对条带进行灰度值分析。
1.2.5 数据统计与分析
SPSS 17.0统计软件的GLM对Rac1基因mRNA和蛋白在马身猪和大白猪背最长肌中的发育性表达差异进行数据统计分析,模型中包括品种、日龄等固定效应及互相之间的互作效应,配合的统计模型为:
yijk=μ+Bi+Dj+BMij+eijk
其中,μ为总体均值;yijk为Rac1基因mRNA和蛋白相对表达量;Bi为品种效应(i=1, 2);Dj为日龄效应(j=1-7);BMij为品种与日龄的互作效应;eijk为随机残差。
2 结果与分析
2.1 RNA纯度鉴定
本研究提取的总RNA经核酸蛋白测定仪检测,OD260/OD280在1.8~2.0之间,经1%琼脂糖凝胶电泳检测,28S和18SrRNA条带清晰、无拖尾、完整性好(图1),符合后续试验的要求。

图1 部分样本总RNA提取结果Fig.1 Total RNA extracted from longissimus dorsi of partial samples
2.2 大白猪和马身猪背最长肌Rac1 mRNA的发育性表达
Rac1基因mRNA在两品种猪背最长肌中的表达模式如图2所示。其中,大白猪初生1日龄、120日龄和180日龄时表达量较高,与其他日龄相比差异极显著(P<0.01)。30日龄、60日龄、90日龄、150日龄表达量均较低,且日龄间无显著差异。与大白猪的表达规律相反,马身猪60日龄时表达量最高,与其他日龄相比差异极显著(P<0.01);90日龄时表达量显著下降,之后,随日龄增加呈下降趋势并维持较低表达水平,150日龄时表达量最低。同一发育阶段两品种间进行比较,30日龄时,大白猪和马身猪的表达量无明显差异,其余各阶段,差异均达到极显著水平(P<0.01),在1日龄、120日龄、150日龄、180日龄,大白猪的表达量极显著高于马身猪(P<0.01),而在60日龄和90日龄,马身猪的表达量极显著高于大白猪(P<0.01)。
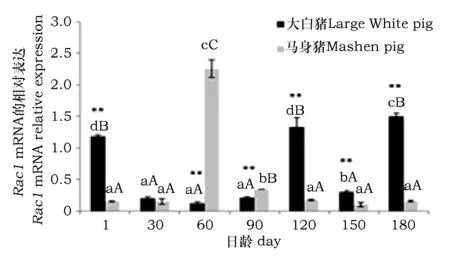
图2 Rac1 mRNA在马身猪和大白猪背最长肌中的发育性表达Fig.2 The developmental expression of Rac1 mRNA in longissimus dorsi of Mashen and Large White pigs 注:(1)上标字母相同表示同品种不同日龄间差异不显著,字母不同表示差异显著或极显著。(2)*表示同日龄品种间差异显著(P<0.05),**表示同日龄品种间差异极显著(P<0.01)。下同。Note:(1)The same superscript letter indicates no significant difference among seven stages of same breed,the different letters means that difference is significant at the levelof 0.05 and 0.01, respectively.(2)* means significant difference betweentwo breeds of same stages at 0.05 level, **means significant difference at 0.01 level. The same as below.
2.3 大白猪和马身猪背最长肌Rac1蛋白的发育性表达
Rac1蛋白在大白猪和马身猪背最长肌的蛋白印迹图和发育性表达比较见图3和图4。就大白猪而言,Rac1蛋白在1日龄时表达量最高,120日龄表达量最低,30日龄至120日龄表达量成呈下降趋势,后又呈上升趋势;马身猪各日龄间表达量均维持在较高水平,其中60日龄表达量最高,与其他日龄相比差异极显著(P<0.01),90日龄表达量最低。两猪种间比较发现,Rac1蛋白每个阶段的表达量均高于大白猪,其中1日龄和60日龄与大白猪相比差异极显著(P<0.01),120日龄和150日龄差异显著(P<0.05)。

图3 马身猪和大白猪背最长肌Rac1蛋白免疫印迹图Fig.3 Immunoblotting of Rac1 protein in longissimus dorsi of Mashen and Large White pigs
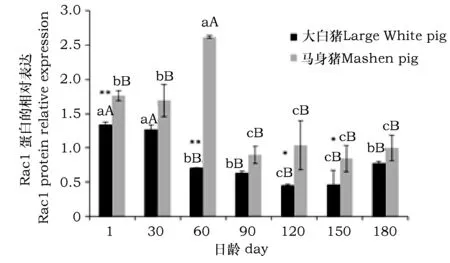
图4 Rac1蛋白在马身猪和大白猪背最长肌组织中的发育性表达Fig.4 The developmental expression of Rac1 protein in longissimus dorsi of Mashen and Large White pigs
3 讨 论
本研究中,在大白猪中,从初生到180日龄,Rac1基因mRNA和蛋白质的表达量均呈现出先降低又升高的趋势,在1日龄时较高,随后降低,在mRNA水平上降低速度很快,在60日龄时降到最低值,随后逐渐升高;而在蛋白水平上,降低幅度较慢,到120日龄时降到最低值,此后逐渐升高。这种规律与大白猪的生长发育规律基本一致。研究发现Rac1基因在胚胎干细胞时期调控肌源细胞的迁移,大白猪在1日龄时表达量高的原因可能是在初生时期成肌细胞融合较快,肌细胞生长发育较早;随后表达量下降,到150日龄时表达量又上升,此时正是大白猪快速生长时期,肌肉、脂肪等组织均在快速生长,可能Rac1的高表达促进了大白猪150日龄到180日龄阶段的快速生长。马身猪60日龄时Rac1基因mRNA和蛋白质表达量均最高,极显著高于其他日龄。Zhao 等[12]研究表明,马身猪30~60日龄的日增重为410.33 g,显著高于30日龄之前和60~90日龄的日增重(180.33 g),这可能与马身猪60日龄阶段Rac1的高表达有关,研究表明Rac1是细胞内重要的“分子开关”,具有促进细胞增殖分化的作用。
大白猪为引进猪种,各个时期的生长速度均显著高于马身猪。而本研究中,马身猪各生长阶段背最长肌中Rac1蛋白的表达量始终高于大白猪,这与马身猪和大白猪的生长特点及Rac1促进细胞增殖的功能不相符,原因可能是Rac1发挥作用时需要其他因子将其活化,虽然马身猪各阶段背最长肌中Rac1的表达量均高于大白猪,但两猪种背最长肌中活化的Rac1量未测定。此外,Rac1在机体免疫调控中起重要作用。Hu等[13]研究表明,Rac1参与了草鱼免疫系统的功能调控,经嗜水气单胞菌和细菌PAMPs诱导后,Rac1的过表达能调高gcPAK1,gcIL1-β,gcTNF-α和gcIFN等基因的表达;而Rac1敲除后,再用嗜水气单胞菌攻击后,这些基因的表达下降。马身猪为地方猪种,抗病力强,其各阶段Rac1表达量高于大白猪是否与Rac1在先天免疫中的作用有关,值得进一步研究。
4 结 论
大白猪背最长肌中Rac1基因的mRNA和蛋白均在初生时表达量最高,马身猪中背最长肌中Rac1基因的mRNA和蛋白在60日龄表达量最高。马身猪Rac1蛋白每个阶段的表达量均高于大白猪。Rac1基因的发育性表达规律与猪的生长发育阶段和品种的遗传背景有关。
[1]Sandrine Etienne, Alan Hall. Rho GTPases in cell biology[J].Nature, 2002, 420(6916): 629-635.
[2]Xosé R Bustelo, Vincent Sauzeau, Inmaculada M Berenjeno. GTP-binding proteins of the Rho/Rac family: regulation, effectors and functions in vivo[J].Bioessays, 2007, 29(4): 356-370.
[3]Raftopoulou M,Hall A. Cell migration: Rho GTPases lead the way[J].DeVBiol, 2004, 265(1):23-32.
[4]Noordermeer J, Klingensmith J, Perrimon N, et al. dishevelled and armadillo act in the wingless signalling pathway in Drosophila[J].Nature, 1994, 367(6458):80-83.
[5]周嘉黎,张玉,师少军. RAC1基因遗传多态性研究进展[J].药物流行病学杂志, 2014, 23(8): 509-512.
[6]Clare Davies, Cathy Tournier. Exploring the function of the JNK(c-Jun N-terminal kinase)signalling pathway in physiological and pathological processes to design novel therapeutic strategies[J].Great Britain, Biochemical Society Transactions,2012(40):85-89.
[7]Elena Vasyutina, BenedettaMartarelli, Cord Brakebusch, et al. The small G-proteins Rac1 and Cdc42 are essential for myoblast fusion in the mouse[J].PNAS, 2009, 106(22):8935-8940.
[8]Nobuyuki Takenaka, Yuma Nihata, Takaya Satoh. Immunofluorescent detection of the activation of the small GTPase Rac1 in mouse skeletal musclefibers[J].Analytical Biochemistry, 2014, 476(1):5-7.
[9]Riane M, Roux P, Primig M, et al. Critical activities of Rac1 and Cdc42Hs in skeletal myogenesis: Antagonistic effects of JNK and p38 pathways[J].Mol.Biol.Cell, 2000, 11(18):2513-2528.
[10]Shashi Kant, TameraBarrett, AnastassiiaVertii, et al. Role of the Mixed-Lineage Protein Kinase Pathway in the Metabolic Stress Response to Obesity[J].Cell Reports, 2013, 4(4):681-688.
[11]Sophie Charrasse, Franck Comunale, Mathieu Fortier, et al. M-Cadherin activates Rac1 GTPase through the Rho-GEF Trio during Myoblast Fusion[J].Molecular Biology of the Cell,2007, 18(5):1734-1743.
[12]Yuanyuan Zhao, pengfei Gao, wei Li, et al. Study on the developmental expression of Lbx1 gene in Longissimus Dorsi of Mashen and Large White pigs [J]. Italian journal of animal science, 2015, 14(1):109-112.
[13]Mo-Yan Hu, Yu-Bang Shen, Xiao-Yan Xu, et al.. Identification, characterization and immunological analysis of Ras related C3 botulinum toxin substrate 1 (Rac1) from grass carp Ctenopharyngodon idella [J]. Developmental and Comparative Immunology, 2016, 54:20-31.
(编辑:武英耀)
Developmental expression ofRac1 gene in longissimus dorsi in mashen and large white pigs
Wang Zeyi1, Shi Jianzhong2, Liu Zhengyu1, Gao pengfei1, Pu zhongde1, Yang qingchun1, Guo Xiaohong1, Li Bugao1, Cao Guoqing1*
(1.CollegeofAnimalScienceandVeterinaryMedicine,ShanxiAgriculturalUniversity,Taigu,Shanxi030801,China, 2.Datongpigbreedingfarm,Datong,Shanxi037000,China)
[Objective]The aim of this study was to investigate the developmental patterns ofRac1 gene inlongissimusdorsiand its influence on muscle growth and development in Mashen and Large White pigs. [Methods]The relative expressions at the levels of mRNA and protein ofRac1 gene inlongissimusdorsiat the ages of 1, 30, 60, 90, 120, 150, and 180 days old in Mashen and Large White pigs were detected by quantitative real-time PCR and western blot. [Results]The main results showed that the mRNA relative expression ofRac1 gene inlongissimusdorsiat the ages of 1, 120, and 180 days old in Large White pig was greater than those at other ages (P<0.01), whose relative expression was low. In Mashen pig, the highest relative expression ofRac1 mRNA was at 60 day-old (P<0.01), then at 90 day-old. The expressions at other ages were kept low and stable levels and no significant difference was found among them. Concerning to the relative expression ofRac1 protein, the changing trend in Large White pig was decreasing and increasing from one day-old to 180 day-old, and the greatest peak was at one day-old, the lowest point was at 120 day-old. The developmental expression trend ofRac1 in Mashen pig was the opposite with that in Large White, and followed the trend of increasing and decreasing. The greatest relative expression was at 60 day-old, and significantly greater than those at other ages (P<0.01). The relative expression amount was became low and stable since 60 day-old, and lower than those at one day-old and 30 day-old (P<0.05). [Conclusion]The relative expression ofRac1 gene at the levels of mRNA and protein was associated with age and genetic background of pigs.
Pig,Rac1 gene, Developmental expression
2016-06-19
2016-07-12
王泽艺(1989-),女(汉),山东烟台人,硕士生,研究方向:遗传学与动物育种
*通讯作者:曹果清,博士,教授。Tel:13403665105;E-mail:anniecao710502@aliyun.com
山西省科技攻关项目(20140311020-5);山西省研究生教育创新项目(2015SY25)
S828
A
1671-8151(2016)11-0827-05

