大西洋鲑循环水养殖水体异养细菌组成的研究
王先平,李 杰,韩厚伟,胡佳平,赵丽丽,邵 伟,王振洋
( 山东东方海洋科技股份有限公司,山东 烟台 264003 )
大西洋鲑循环水养殖水体异养细菌组成的研究
王先平,李 杰,韩厚伟,胡佳平,赵丽丽,邵 伟,王振洋
( 山东东方海洋科技股份有限公司,山东 烟台 264003 )
采集养殖池水样,选取Zobell 2216E琼脂培养基、溶菌肉汤琼脂培养基、硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂培养基、脑心浸液琼脂培养基、胰蛋白胨大豆琼脂培养基、营养琼脂培养基6种常见固体培养基进行细菌分离培养,以平板菌落计数法和菌落外观形态特征辨别及16S rRNA基因测序方法进行异养菌计数和种类组成分析。结果显示:(1)养殖池水体异养菌可分为4大类,分别属于变形菌门(包括α-、γ-变形菌纲)、厚壁菌门、拟杆菌门、放线菌门,其中以γ-变形菌纲为优势菌群。按属分类大多为假交替单胞菌属和弧菌属。(2)不同培养基分离菌落数量2216E培养基>溶菌肉汤琼脂培养基>胰蛋白胨大豆琼脂培养基>脑心浸液琼脂培养基>营养琼脂培养基>硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂培养基,且2216E培养基菌落数极显著高于其余5种培养基(P<0.01);2216E培养基所分离细菌的种类最多,分属于12个属,假交替单胞菌属为优势类群,占比50%,弧菌属仅占3.13%;脑心浸液琼脂培养基、溶菌肉汤琼脂培养基、胰蛋白胨大豆琼脂培养基所分离细菌均以弧菌属为优势菌群,分别占33.33%、60%、25%;硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂培养基所分离细菌仅分属于1个属,即弧菌属;营养琼脂培养基无弧菌,但有假单胞菌分离出。
大西洋鲑;循环水养殖水体;异养细菌组成;不同培养基
大西洋鲑(Salmosalar)原产于大西洋北部和北美,是人工养殖产量最高的冷水性鱼类[1]。传统养殖模式多为网箱、流水或水库养殖,而随着农业工业化的进程,循环水养殖系统已经成为一个越来越常见的养殖大西洋鲑的工业模式。但循环水养殖系统在病害预警机制与预防策略等方面存在较大问题与不足[2]。目前关于养殖水循环处理效果的研究多集中于水质理化指标检测和硝化细菌研究方面[3-5],而对循环水养殖处理系统中细菌的种群结构及动态变化研究较少。异养细菌数量的多寡可以反映水体中有机物的污染程度[6],而对潜在病原菌的调查,对病害的发生有一定的预警指示作用[7],因此对养殖水体异养细菌组成研究有一定的意义。
微生物的生长和代谢产物的积累受制于培养基的组分等多种因子的影响[8],因此选择适宜的培养基尤为重要。传统培养方法通常采用营养较为丰富的培养基,以使微生物能够快速生长并达到最大的生物产量[9],而自然界中除了少部分能够利用高浓度营养物质的微生物种群外,其余大部分是以中低营养甚至寡营养的方式存活,如海洋环境中的微生物多为寡营养型[10],而同时某些潜在病原菌一般都是偏爱丰富营养的种类,与环境水体菌的营养需求存在差异。本研究旨在以大西洋鲑循环水养殖水体为研究对象,利用6种营养成分不同的培养基,使用传统的平板稀释涂布法和现代分子测序技术相结合的手段,分析研究养殖水体异养菌种类组成的情况、调查潜在病原菌的存在情况,并比较不同营养成分的培养基所能分离培养的异养菌种类的差异,为大西洋鲑循环水养殖的病害工作提供一定的数据参考。
1 材料与方法
1.1 试验材料
1.1.1 试验系统
试验地点在山东东方海洋科技股份有限公司开发区分公司,选择一套大西洋鲑成鱼养殖系统进行水样采集。该系统为循环水养殖系统(图1),养殖单元水体总体积为300 m3,共分为5口八角形池子,每池体积60 m3,水深2.5 m;水体盐度28~30,深水井(深度约120 m)地下盐水。养殖密度12.25 kg/m3,循环量450~500 m3/h,pH值7.0,水温(15±0.2 ) ℃,溶解氧(2.94±1.70) mg/L。水样采集期间养殖系统正常运行,紫外灯5组正常开启,臭氧3.5 L/min。
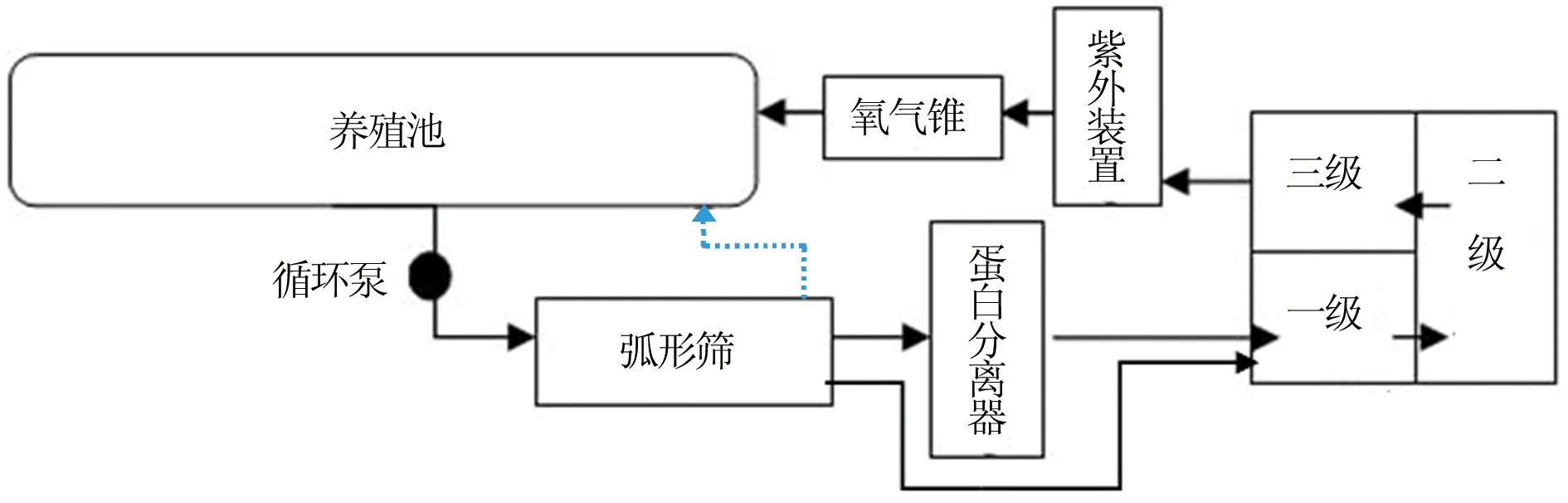
图1 循环水养殖系统构造注:黑色箭头示水流方向,虚线示备用管道.
1.1.2 培养基
所有培养基均是购自青岛海博的商品化培养基成品,①Zobell 2216E琼脂培养基成分:蛋白胨、酵母浸粉、柠檬酸铁、氯化钠、氯化镁、硫酸钠、氯化钙、氯化钾、碳酸钠、溴化钾、氯化锶、硼酸、硅酸钠、氟化钠、硝酸钠、磷酸氢二钠、琼脂;②溶菌肉汤琼脂培养基成分:胰蛋白胨、酵母粉、氯化钠、琼脂;③硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂培养基成分:酵母粉、蛋白胨、硫代硫酸钠、枸橼酸钠、牛胆酸钠、蔗糖、氯化钠、柠檬酸铁、溴麝香草酚兰、麝香草酚兰、琼脂;④脑心浸液琼脂培养基成分:胰蛋白胨、氯化钠、磷酸氢二钠、葡萄糖、牛心浸出粉、琼脂;⑤胰蛋白胨大豆琼脂培养基成分:胰蛋白胨、大豆胨、氯化钠、琼脂;⑥营养琼脂培养基成分:蛋白胨、牛肉粉、氯化钠、琼脂。以上培养基均按指定方法配制后经121 ℃高压灭菌20 min,冷却倾倒灭菌平板。
1.2 试验方法
1.2.1 水样采集
选择系统某一养殖池为采样点,分别用水样采集器在池中心、进水口附近及池子另一端采集中层水样3个(约水层下1.25 m处)。将水样采集器内水样引流至采样瓶内,摇晃瓶体洗涤2次,再将瓶体注满,拧紧瓶盖后瓶体喷洒75%酒精消毒,带回实验室进行试验。
1.2.2 水样预处理
从采样瓶中吸取一定体积的水样以溶菌肉汤琼脂培养基液体培养基按3∶1的体积比例稀释后,170 r/min、28 ℃摇床活化1 h,根据预试验结果选择用无菌海水稀释10倍,菌落数不影响计数。
1.2.3 细菌培养
从试管中吸取200 μL已活化稀释好的水样分别滴加于2216E培养基、溶菌肉汤琼脂培养基、硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂培养基、脑心浸液琼脂培养基、胰蛋白胨大豆琼脂培养基、营养琼脂培养基6种培养基平板上,静置数秒后用灼烧充分并已冷却的玻璃涂布棒涂布均匀,每个稀释度设2个平行,于28 ℃恒温培养箱中倒置培养。
1.2.4 细菌数量统计和种类分析
分别于24、48、72、96 h,以计数器辅助统计平板菌落数,记录成表。
在培养过程中,根据菌落的外部形态特征辨别菌落(菌落大小、颜色、透明度、边缘是否规则、湿润或干燥菌落突起、凹陷或平坦等),做好记录,同时挑取不同形态菌落,划线纯化3次,并统计菌落的种类数量;最终分离菌株于超低温冰箱-80 ℃冻存。
采用酚-氯仿法提取纯化的各菌株基因组DNA,1%琼脂糖凝胶电泳检测(电泳条件为100 V,30 min)。再以细菌16S rRNA基因通用引物27F-1492R[11](由上海生工生物工程股份有限公司合成)扩增16S rRNA基因序列,上游引物27F序列为:5′-AGAGTTTGATC(C/A)TGGCTCAG-3′,下游引物1492R序列为:5′-GGCTCCTTGTTACGACTT-3′。PCR产物于1%琼脂糖凝胶进行电泳检测,并在253 nm波长下观察。PCR产物送至上海生工生物工程股份有限公司进行纯化和序列测定,测序结果通过美国国立生物技术信息中心的BLAST检索系统(http://www.ncbi.nlm.nih.gov/Blast/)进行同源序列比对。
1.3 数据处理
利用SPSS 18软件对不同培养基在时间轴上的菌落数进行单因素方差分析比较,以P<0.05为差异显著;同时对各培养基最终菌落数进行方差分析比较,以P<0.05为差异显著,P<0.01为差异极显著。
2 试验结果
2.1 不同培养基培养所得异养菌菌株数量的比较
所采集水样涂布于不同培养基平板,分别于24、48、72、96 h,对生长菌落进行数量统计(图2),结果显示,所分离平板菌落数量呈现2216E培养基>溶菌肉汤琼脂培养基>胰蛋白胨大豆琼脂培养基>脑心浸液琼脂培养基>营养琼脂培养基>硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂培养基,其中2216E培养基分离的菌落数最高,为40~124 cfu,随培养时间的增加而显著增加(P<0.05),且最终培养所得菌落数(96 h)极显著高于其他5种培养基(P<0.01)。所分离菌落数溶菌肉汤琼脂培养基次之,为30~36 cfu,且随时间增加变化不显著(P>0.05),其余4种培养基菌落数均较低,整体均处于20 cfu以下。

图2 6种不同培养基于不同培养时间的平板菌落数注:数值为3个水样平板菌落数的平均值,具有不同上标字母的平均值间差异显著(P<0.05).
2.2 养殖水体异养菌种类组成
经外观形态辨别后,挑选139株菌株经16S rRNA基因通用引物做PCR分析后送测序,共获得118条有效序列。BLAST分析结果可分为4大类,分别属于变形菌门(包括α-、γ-变形菌纲),厚壁菌门(仅芽孢杆菌纲),拟杆菌门(仅黄杆菌纲),放线菌门(仅放线菌纲)。其中以γ-变形菌纲细菌为优势类群。所有菌株共分属于24个属,其中以假交替单胞菌属(Pseudoalteromonas)的菌株最多,为32株,弧菌属(Vibrio)菌株次之,为29株。
不同培养基间比较发现(图3,表1),除营养琼脂培养基外,其余5种培养基均有弧菌属细菌分离出,而假交替单胞菌仅2216E培养基分离出。其中:
① 2216E培养基所分离细菌送测80株,获得64条有效序列,属于变形菌门和拟杆菌门,分别占比93.75%和6.25%,属于12个属,假交替单胞菌属为优势类群,占比50%,弧菌属占比3.13%。
② 溶菌肉汤琼脂培养基培养基所分离细菌送测16株,获得15条有效序列,属于变形菌门和拟杆菌门,分别占比80%和20%,属于3个属,弧菌属为优势菌群,占比60%。
③ 脑心浸液琼脂培养基所分离细菌共送测18株,获得18条有效序列,属于变形菌门和厚壁菌门,分别占比66.67%和33.33%,属于5个属,弧菌属为优势菌群,占比33.33%。
④ 胰蛋白胨大豆琼脂培养基所分离细菌送测4株菌,获得4条有效序列,属于变形菌门、厚壁菌门和放线菌门,分别占比25%、50%、25%,属于4个属,弧菌数占25%。
⑤ 硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂培养基所分离细菌送测13株,获得11条有效序列,仅属于1个属,即变形菌门的弧菌属。
⑥ 营养琼脂培养基所分离细菌送测8株,获得6条有效序列,属于变形菌门、厚壁菌门和放线菌门,各占比1/3,属于3个属,无弧菌分离出。
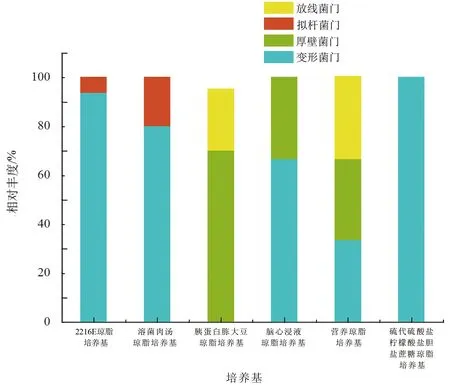
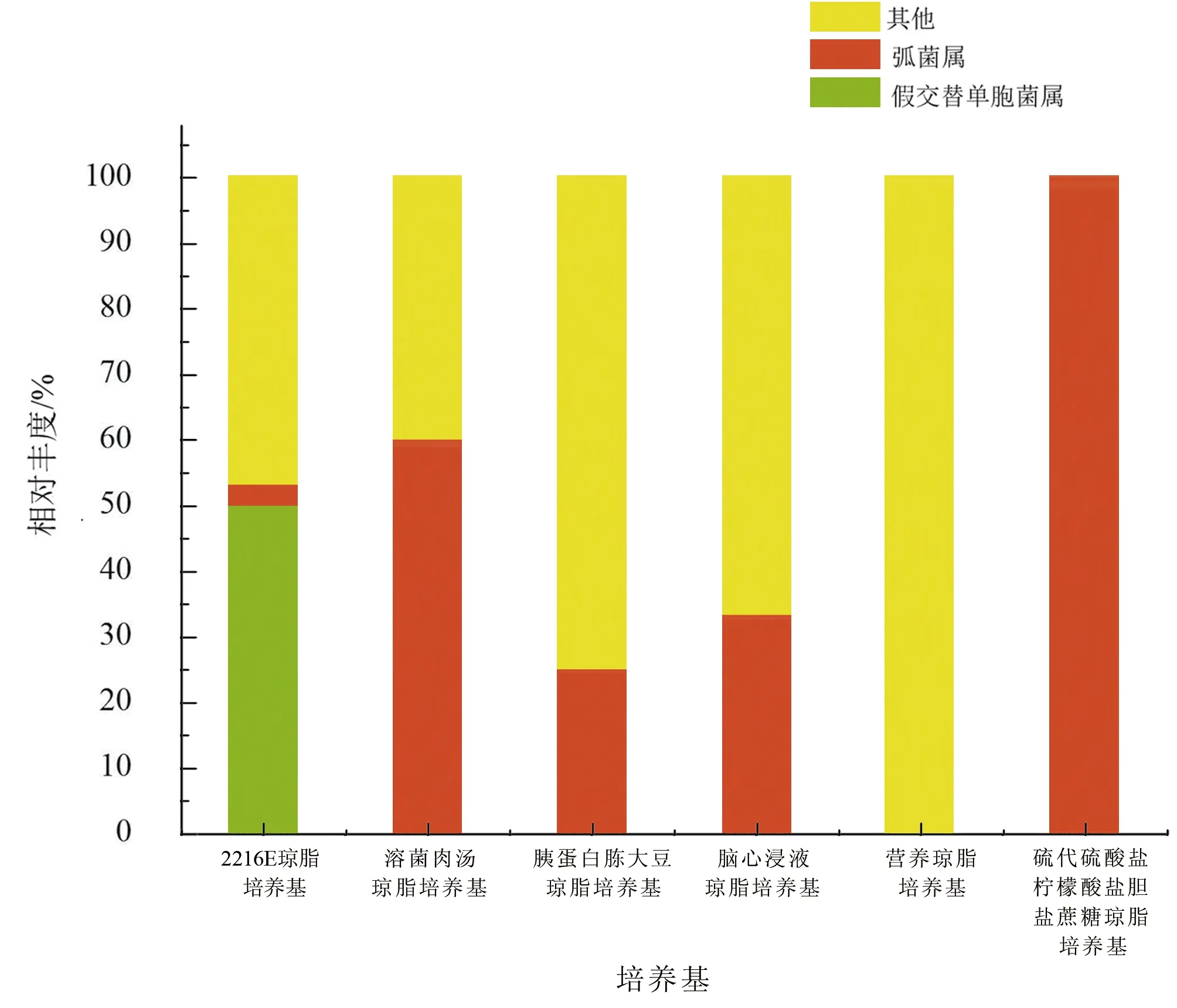
图3 各培养基所分离菌株的种类组成左:按门划分,右:按属划分

表1 6种不同培养基上可培养细菌的属/种类型
3 讨 论
水细菌是水域生态系统重要的矿化者, 同时也作为初级生产力成为部分微型浮游动物的饵料, 其活跃的代谢促进了系统中的物质循环和能量流动,维系着一个系统的正常运转[12]。天然海水细菌种类多、分布广,主要是弧菌科细菌、肠杆菌科细菌,其中尤以弧菌科数量最多[13-14]。而在养殖密集区水域,细菌类群种类比较丰富,它们多属于假交替单胞菌属和弧菌属[15-16],同时多数假单胞菌在工农业污水处理、消除环境污染中起重要作用[17-18]。本研究对大西洋鲑养殖水体异养细菌组成分析发现,假交替单胞菌属和弧菌属所属细菌最多,可认为是大西洋鲑循环水养殖水体的两类优势菌群。而变形菌门和厚壁菌门所占比最大,也与大菱鲆(Scophthalmusmaximus)养殖水体优势门组成一致[19]。
海水细菌与淡水或土壤细菌不同,大多数海水细菌为嗜盐性菌,分解蛋白能力强,而分解糖能力较弱,能生长在低营养和低温环境中。由于海水细菌的特殊性,分离培养海水细菌需要特殊培养基,且海水细菌在分离及传代过程中易发生变异和死亡,给海水细菌研究工作带来一定困难[13]。2216E培养基作为高盐度寡营养的培养基,其营养特点适合海水环境菌的生长,所培养的异养菌菌落数极显著高于其他5种培养基(P<0.01),且随培养时间的增加而显著增加(P<0.05),尤其假交替单胞菌在该环境下生长迅速,占50%,为养殖水体优势菌群。据文献记载,培养基营养基质的含量最好与微生物自然生长环境相近[9],且低含量基质的培养基培养出的细菌在数量和种类上均多于高含量基质的培养基[20],本研究中,高营养培养基脑心浸液琼脂培养基平板中菌落数<20 cfu,分离细菌分属于5个属,低于2216E培养基所分离培养的菌落数和种类数,说明在寡营养的海水环境中的异养细菌不易在溶菌肉汤琼脂培养基上生长,但同时分离出3株芽孢杆菌属细菌,均为对水体有机物有强烈分解能力的水体异养细菌。
养殖水体潜在病原菌情况的调查,对病害预警有一定的指示作用[7]。在除营养琼脂培养基外的5种培养基均有弧菌分离出,说明其在大西洋鲑循环水养殖水体中广泛存在,为优势菌群。同时在营养琼脂培养基分离得到假单胞菌属细菌,该种属包括荧光假单胞菌(P.fluorescens)、铜绿假单胞菌(P.aeruginosa)等致病性较强的水产动物病原菌[11],因此作为潜在病原菌,其数量的监测和控制措施的制定均值得重视。
本文研究了大西洋鲑循环水养殖水体的异养细菌的种类组成,为循环水养殖水质净化和病害预警提供了一定的参考资料。后续研究应扩大调查取样点,研究循环水不同水处理环节的异养细菌的数量和种类组成差异,为进一步丰富病害预警理论、评价循环水系统水处理效果提供数据支持。
[1] 曹成易,汪开毓,王玲,等. 大西洋鲑杀鲑气单胞菌的分离鉴定[J]. 淡水渔业, 2009, 39(1):54-57.
[2] 刘鹰.海水工业化循环水养殖技术研究进展[J].中国农业科技导报,2011,13(5):50-53.
[3] Zhang D,Zhang D,Liu Y P,et al. Community analysis of ammonia oxidizer in the oxygen-limited nitritation stage of OLAND system by DGGE of PCR amplified 16S rDNA fragments and FISH[J]. Journal of Environmental Sciences, 2004, 16(5):838-842.
[4] 姜辉,宋德敬,宋协法,等. 工厂化循环水养殖预排污系统与排水系统研究与设计[J].海洋水产研究,2007,28(4):77-82.
[5] 马悦欣,许兵玲,何洁,等. 牙鲆自净式养殖槽中异养细菌和硝化细菌数量及硝化速率[J].中国水产科学,2001,8(1):33-36.
[5] 徐飞,叶友红,江迎春,等. 地表水细菌总数检测方法探讨[J]. 净水技术, 2007,26(6):66-69.
[7] 薛超波,王建跃,王世意,等. 大黄鱼养殖网箱内外细菌的数量分布及区系组成[J]. 中国微生态学杂志, 2005, 17(5):336-338.
[8] 李孱,白景华,蔡昭铃,等. 细菌素发酵培养基的优化及动力学初步分析[J]. 生物工程学报, 2001, 17(2): 187-192.
[9] 郭斌,吴晓磊, 钱易. 提高微生物可培养性的方法和措施[J]. 微生物学报, 2006, 46(3):504-507.
[10] 王保军, 刘双江. 环境微生物培养新技术的研究进展[J]. 微生物学通报, 2013, 40(1):6-17.
[11] 崔来宾, 叶星, 邓国成,等. 草鱼铜绿假单胞菌的鉴定及药物敏感性分析[J]. 大连海洋大学学报, 2010, 25(6):488-494.
[12] 邓德波, 马英, 徐春燕,等. 鳗鲡养殖循环水处理系统细菌的组成及其数量[J]. 集美大学学报:自然科学版, 2010, 15(9):321-326.
[13] 韩善桥, 虞积耀, 姜涛,等. 东南沿海海域海水细菌的分布[J]. 解放军预防医学杂志, 2008, 26(1):18-21.
[14] 马聪, 陈昌国, 蒋学兵,等. 中国海域海洋细菌分布特征分析[J]. 解放军医学杂志, 2012, 37(9):909-913.
[15] 李筠, 周宏霞, 刘佳琳, 等. 青岛近岸特征环境中海洋异养细菌的分布规律及其分子鉴定[J]. 中国海洋大学学报:自然科学版, 2006, 36(6):965-970.
[16] 覃映雪, 王晓林, 鄢庆枇, 等.青石斑鱼肠道菌群研究[J] .海洋水产研究, 2007,28(5):18-23.
[17] Behrendt U, Ulrich A, Schumann P, et al. A taxonomic study of bacteria isolated from grasses: a proposed new speciesPseudomonasgraminissp. nov. [J]. International Journal of Systematic Bacteriology, 1999(49):297-308.
[18] Lack A, Fuchs G. Evidence that phenol phosphorylation to phenylphosphate is the first step in anaerobic phenol metabolism in a denitrifyingPseudomonassp[J]. Arch Microbiol, 1994, 161(2):132-139.
[19] 邢孟欣.养殖大菱鲆肠道微生物多样性及功能分析[D].青岛:中国科学院研究生院(海洋研究所),2013.
[20] Aagot N, Nybroe O, Nielsen P,et al. An alteredPseudomonasdiversity is recovered from soil by using nutrient-poorPseudomonas-selective soil extract media[J].Appl Environ Microbiol,2001,67(11):5233-5239.
CompositionofHeterotrophicBacteriainaRecirculatingAquacultureSystemforAtlanticSalmon(Salmosalar)
WANG Xianping,LI Jie,HAN Houwei,HU Jiaping,ZHAO Lili,SHAO Wei, WANG Zhenyang
( Shandong Oriental Ocean Sci-Tech Co., Ltd,Yantai 264003,China )
The aim of this work was to study the composition of heterotrophic bacteria in a Recirculating Aquaculture System(RAS)for Atlantic salmon (Salmosalar) and to compare the difference in bacterial isolation and cultivation in different culture media. The bacteria in water samples collected from the tanks were cultured in 6 types of medium including 2216E, BHI, LB, NA, TSA, and TCBS, and composition and quantity of the bacteria were determined by a plate count method, bacterial morphological identification and 16S rRNA gene sequencing analysis method. It was found that the heterotrophic bacteria in the tank water were divided into 4 major groups: Proteobacteria (including the α-,γ-Proteobacteria),Firmicutes, Bacteroidetes, and Actinobacteria, with the dominant γ-Proteobacteria, especially the generaPseudoalteromonasandVibrio. The plate colony numbers in different media were shown as the order of 2216E >LB >TSA>BHI>NA>TCBS,significantly higher in the 2216E than in the other 5 culture media (P<0.01). The bacteria isolated from 2216E culture medium belonged to 12 genera, the maximal becteria in genusPseudoalteromonasin accounting for 50% and genusVibriorepresenting only 3.13%. The genusVibriowas the dominant genus in various culture media, accounting for 33.33% in BHI, 60% in LB, 25% in TSA and 100% in TCBS (only one genusVibrio), but noVibriobutPseudomonaswas isolated from NA culture mediuma.
Atlantic salmon (Salmosalar); recirculating aquaculture system(RAS); composition of heterotrophic bacterium; different culture medium
10.16378/j.cnki.1003-1111.2016.03.003
S943
A
1003-1111(2016)03-0210-05
2015-07-08;
2015-10-08.
国家国际科技合作项目(2014DFA31030).
王先平(1987-),男,助理工程师,硕士;研究方向:循环水养殖病害防控技术.E-mail:wxp_606@163.com.通讯作者:韩厚伟(1981-),男,工程师,硕士;研究方向:循环水养殖技术.E-mail:hanhouwei@163.com.

