血鹦鹉鱼木糖葡萄球菌的分离鉴定和耐药性研究
刘 青,赵铭武,曹鑫磊,刘新政
( 1.山西农业大学,山西 太谷 030801; 2.太原市鱼种场,山西 太原 030025 )
血鹦鹉鱼木糖葡萄球菌的分离鉴定和耐药性研究
刘 青1,赵铭武2,曹鑫磊2,刘新政2
( 1.山西农业大学,山西 太谷 030801; 2.太原市鱼种场,山西 太原 030025 )
自患病血鹦鹉鱼肾脏分离获得优势菌CVSX1,做分离纯化培养、生化与分子鉴定、人工感染试验和药敏试验,以期对该病有效预防和治疗。分离菌株血液培养菌落呈圆形,表面光滑,边缘整齐,颜色灰白色至略黄,周围有弱溶血环。经过涂片染色镜检,该菌株革兰氏染色为阳性圆形球菌,直径约为0.8~1.0 μm,多数成堆,少数散在、成对或四联状排列。该菌株无荚膜或鞭毛,亦无芽孢,根据形态和生理、生化性状可初步鉴定为木糖葡萄球菌。菌株的16S rDNA序列比对表明,菌株CVSX1与已登录GenBank数据库的木糖葡萄球菌16S rDNA序列的相似性>99%,聚类分析结果表明菌株CVSX1与葡萄球菌属的木糖葡萄球菌遗传距离最小。通过人工感染试验证明木糖葡萄球菌CVSX1对血鹦鹉幼鱼有较强的致病性。应用临床常用的抗生素对木糖葡萄球菌CVSX1进行药敏检测,菌体CVSX1对磺胺嘧啶、青霉素G、诺氟沙星、四环素高度耐药,对红霉素、丁胺卡那敏感,对环丙沙星、氧氟沙星表现为中介。
血鹦鹉鱼;木糖葡萄球菌;16S rDNA;分离鉴定;耐药性
血鹦鹉鱼(Cichlasomavar.)又名红财神、发财鱼等,是由红魔鬼(C.citrinellum♂) 和紫红火口(C.synspilum♀) 杂交所得的热带观赏鱼[1-3]。该鱼形态可爱,通体红色、寓意吉祥,在市场上深受欢迎,然而在养殖过程中易发病,轻则易失去观赏价值,重则死亡,给养殖户造成经济损失。在集约化养殖过程中能对血鹦鹉鱼造成较大危害的病原有:车轮虫(Trichodinasp.)、指环虫(Dactylogyrussp.)等寄生虫病[4],嗜水气单胞菌(Aeromonashydrophila)、铜绿假单胞菌 (Pseudomonasaeruginosa)等细菌病[5],还有病毒感染的报道[6]。目前,尚未见葡萄球菌(Staphylococcus)病原相关的报道,因首次从观赏鱼车间工厂化养殖的患病血鹦鹉鱼肾脏分离得到1株葡萄球菌,本文对该病原的形态和生化反应特征、分子生物学鉴定、药敏情况进行研究和探讨,旨在对水产养殖业中葡萄菌的感染进行报道,并为该病原的诊断和治疗提供实践依据,为进一步深入研究提供参考。
1 材料与方法
1.1 材料来源
患病鱼取自于太原市鱼种场观赏鱼养殖车间,发病鱼为新购进的血鹦鹉鱼种。患病血鹦鹉鱼主要表现为萎靡不振,离群躲在角落或扎堆,体表颜色暗淡,尾鳍、背鳍蜷缩。随着病情的发展,患病血鹦鹉鱼常沉于水底,不游动。解剖可见病鱼腹腔有少量积液,肝脏发白,鳃部发白,肠道无食物,胆囊肿大,最终导致死亡,病程短,死亡率高。
试剂药品:普通营养琼脂培养基、MH琼脂、溶菌肉汤培养基购自杭州百思生物技术公司,血液琼脂购自南京便诊生物科技有限公司,微量鉴定管等生化鉴定试剂和药敏纸片购自杭州天和生物微生物试剂公司,其他药品均为分析纯。分子生物学鉴定试剂有EX Taq酶(TaKaRa),dNTP(TaKaRa),引物(Invitrogen合成),ddH2O,Marker(DL2000)。主要试验仪器:恒温培养箱(哈东联),低温离心机、 PCR仪(Eppendorf),凝胶成像仪、电泳仪(Bio-Rad),测序仪(ABI 3730XL)等。
1.2 病原菌分离纯化
取症状典型的垂死患病血鹦鹉鱼种,采用无菌解剖操作,取肝、肾等器官组织分别加入适量灭菌生理盐水进行研磨,分别倒入7.5%氯化钠肉汤和普通肉汤增菌液中,置于37 ℃ 恒温培养箱中培养24 h。之后划线于血液琼脂平板,在37 ℃ 培养24 h,然后挑取优势菌落进行染色镜检。以金黄色葡萄球菌(S.aureus)做阳性对照菌(菌株ATCC25923,为山西省生态畜牧与环境兽医学重点实验室保存),观察细菌的形态及染色特性。将菌株纯培养物划线接种于普通营养琼脂,37 ℃ 培养24 h,观察菌落的特征。
1.3 鉴定方法
通过病鱼的病理特征观察,病原提取分离、纯化并进行菌落观察和革兰氏染色显微观察。进一步做菌株的生化鉴定,分子生物学分类鉴定,最后进行回归感染试验及药敏试验。
1.3.1 菌株的生化鉴定
取37 ℃培养过夜的菌株用灼烧冷却的接种针接种至微凉生化鉴定管中,于37 ℃培养24 h后观察记录反应结果。根据参考文献[7]方法,选择血浆凝固酶、过氧化氢酶等项目检测。通过《伯杰氏细菌鉴定手册》[8]所列葡萄球菌属各菌株的生理生化特性进行比较,确立该菌株的分类地位。
1.3.2 分子生物学分类鉴定
通过菌株总DNA的提取、采用细菌16S rDNA 通用引物进行PCR扩增。PCR反应体系(20 μL):10×Ex Taq buffer(2.0 μL)、2.5 mmol/L dNTP Mix(1.6 μL)、5p Primer(各0.8 μL)、Template (0.5 μL)、5u Ex Taq(0.2 μL)、ddH2O(14.1 μL)。PCR程序设置为:95 ℃ 预变性5 min;95 ℃变性30 s,55 ℃退火30 s、72 ℃延伸1.5 min,共24个循环;循环结束后,72 ℃再延伸10 min,4 ℃终止反应,PCR产物取出于-20 ℃保存待用。电泳检测PCR产物并切胶纯化后,送至美吉生物公司测序。对菌株的16S rDNA序列分析,并与美国国立生物技术信息中心网站数据库中木糖葡萄球菌(S.xylxosus)16S rDNA序列进行相似度比较,以辅助界定该菌株种属。
1.3.3 回归感染
将培养纯化后的菌悬液对试验鱼腹腔注射,菌悬液密度2.6×108cfu/mL,注射剂量50 μL/尾。设3个平行试验组,每组10尾,第4组为对照组,注射等量的pH为7.0的灭菌生理盐水。人工感染试验鱼均养殖于隔离的恒温试验水族箱中,观察感染后的发病与死亡情况。死亡试验鱼及时捞出解剖观察,分离病菌。分离菌经纯化后用血液琼脂平板培养,观察菌落的形态,生理生化特征与注射菌进行对比是否与注射菌株一致。
1.3.4 药敏试验
药敏试验采用K-B纸片扩散法。将分离菌株接种于溶菌肉汤在37 ℃恒温震荡培养16~18 h。将培养物均匀地涂布到MH 琼脂平板表面,用无菌镊子将药敏纸片贴于平板上,28 ℃培养18~24 h后观察测量抑菌圈直径大小,并根据《抗菌药物敏感性试验执行标准》[8]判断细菌对药物的敏感性。
2 结果与分析
2.1 染色镜检结果
分离获得的菌株命名为CVSX1,该菌为革兰氏阳性圆形球菌(图1),直径约0.8~1.0 μm,呈单个、二联、四联或葡萄串状,无荚膜或鞭毛,不产生芽孢。

图1 菌株形态特征
2.2 普通营养琼脂培养基培养结果
分离菌株CVSX1血液琼脂上进行初代培养约18 h,菌落灰白色呈稍凸圆形,直径约为1 mm,边缘整齐表面光滑,不溶血;24 h后,菌落颜色略黄,直径约2.0~2.5 mm,周围有弱溶血环。
2.3 菌株的生化鉴定结果
菌株CVSX1的生理生化指标结果为:发酵葡萄糖、果糖、甘露糖、麦芽糖、乳糖、阿拉伯糖、蔗糖及甘露醇产酸;半乳糖苷酶、过氧化氢酶及脲酶阳性,氧化酶、血浆凝固酶均为阴性,对新生霉素具有抗性。将菌株CVSX1的生化指标与《伯杰氏细菌鉴定手册》[8]的木糖葡萄球菌的生理生化特性进行比较,反应结果均基本相符(表1)。因此可初步分析判定菌株CVSX1为葡萄球菌属的木糖葡萄球菌。

表1 分离菌株的生化特性
注:+表示阳性; -表示阴性; w表示微弱阳性.
2.4 分子生物学分类鉴定结果
采用葡萄球菌16S rDNA引物对菌株CVSX1进行PCR并对扩增产物进行序列测定,得到样本CVSX1的16S rDNA拼接序列结果。测得样本CVSX1的16S rDNA序列大小为1442 bp,并与美国国立生物科技信息中心网站中登录的的木糖葡萄球菌16S rDNA序列比较,Blast检测结果显示,两者16S rDNA序列的相似度大于99%,只存在3个核苷酸差异(图2)。根据查询网站数据筛选出的与该菌株相似度99%的菌株,采用最小欧氏距离法(图3)进行聚类分析,查询菌株CVSX1最终与木糖葡萄球菌聚类在一起,表明分离菌株CVSX1与葡萄球菌属的木糖葡萄球菌遗传距离最近。
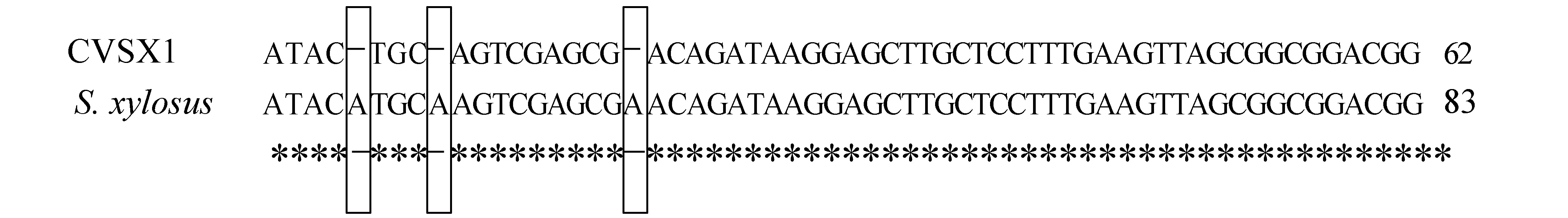
图2 菌株CVSX1 16S rDNA差异序列“*”表示相同核苷酸,“-”表示碱基不同.
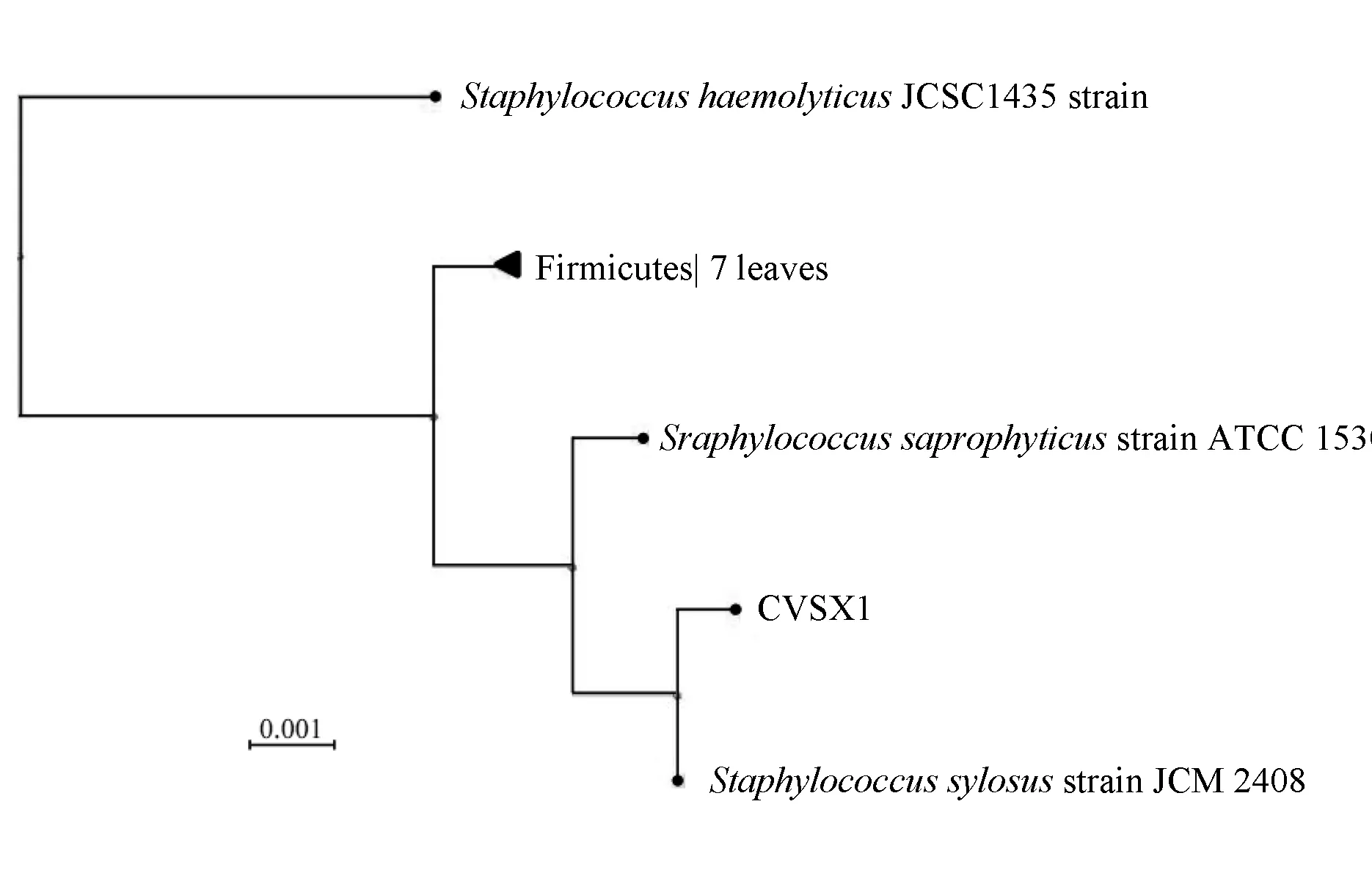
图3 菌株16S rDNA序列聚类分析(最小欧氏距离法)
2.5 回归感染结果
用分离得到的木糖葡萄球菌CVSX1对试验鱼进行注射感染,试验鱼表现出活动减弱,食欲减退,对刺激无反应、注射处伤口感染等症状。试验鱼腹部发红,有腹水,注射处有出血点。腹腔注射攻毒试验鱼后,鱼的腹部出现发红症状,在注射处有出血点,96 h内均全部死亡,死亡特征与发病鱼基本一致。对照组未见异常症状,无死亡。攻毒后死亡鱼体分离的病菌在普通营养琼脂培养平板上长出的菌落特征、菌株生化特征等均与感染所用的试验菌株一致。
2.6 药敏试验结果
木糖葡萄球菌CVXS1的药敏试验结果见表2。参照评价标准[9],木糖葡萄球菌 CVSX1对磺胺嘧啶(250 μg/片)、青霉素G(10 μg/片)、诺氟沙星(10 μg/片)、四环素(30 μg/片)高度耐药;对环丙沙星(5 μg/片)、氧氟沙星(5 μg/片)中介;对红霉素(5 μg/片),丁胺卡那(30 μg/片)敏感。
表2木糖葡萄球菌CVSX1对临床常用抗生素的敏感性mm

抗生素种类磺胺嘧啶青霉素G诺氟沙星四环素环丙沙星氧氟沙星红霉素丁胺卡那抑菌圈直径5.213.812.07.618.214.140.119.0敏感性RRRRIISS
注:“R”表示耐药,“S”表示敏感,“I”表示中介.
3 讨 论
3.1 凝固酶阴性葡萄球菌及其危害
葡萄球菌属是从临床标本检出的革兰氏阳性球菌中最为常见的细菌,分为凝固酶阴性和凝固酶阳性两类[10]。凝固酶阳性葡萄球菌包括金黄色葡萄球菌(S.aureus)、中间型葡萄球菌(S.intermedius)和家畜葡萄球菌(S.hyicus)等。金黄色葡萄球菌多为致病菌,能够引起诸多人和畜禽感染等,表皮葡萄球菌(S.epidermidis)和腐生葡萄球菌(S.saprophyticus)可引起尿路感染、败血症和心内膜炎等各种感染,属于条件致病菌[11]。近年来由凝固酶阴性葡萄球菌引起的感染正逐渐上升,并且耐药菌株不断增加[12]。
木糖葡萄球菌属于血浆凝固酶阴性葡萄球菌,该菌自然界分布广泛,致病性较弱[13],以往被认为是非致病菌[14]。但是近年来,抗生素被广泛应用于疾病治疗,血浆凝固酶阴性葡萄球菌也开始成为重要的条件致病菌,并已出现多重耐药菌株[15]。导致人类患病的葡萄球菌中致病力较弱的血浆凝固酶阴性葡萄球菌逐渐占据重要位置[16]。木糖葡萄球菌可引起术后患者并发医院感染[17]、肺炎败血症[18]等。在畜牧生产过程中也可引发病害,例如在引起奶牛乳房炎的细菌中,血浆凝固酶阴性葡萄球菌的总体比例呈逐渐上升趋势[19]。从目前报道可知,葡萄球菌感染养殖鲜活鱼类的报道较少,仅有中间葡萄球菌感染红龙鱼(Scleropagesformosus)[20]、松鼠葡萄球菌(S.sciuri)感染黄鳝(Monopterusalbus)[21]的两例。也有一些木糖葡萄球菌致病的报道,如在水产养殖上,该菌与罗氏沼虾(Macrobrachiumrosenbergii)肌肉白浊病密切相关,引起虾苗大批死亡,该病发病率高达80%以上,受感染的虾苗死亡率可达90%,因此造成了巨大的经济损失[22-23]。因此对木糖葡萄球菌等凝固酶阴性葡萄球菌生物学特性及耐药性监测就显得很有必要。
3.2 观赏鱼感染葡萄球菌防治
木糖葡萄球菌感染鱼类尚未见报道,需多加注意该病原的流行传播。在未查明木糖葡萄球菌对于水产养殖重要热带鱼类如罗非鱼等大宗生产的血鹦鹉近缘品种鱼类的致病性的情况下,应密切监控和预防此病原的传播。本次发病的原因可能与长途运输回来的鱼苗体质较弱,对环境的适应能力差有关,病原菌在封闭循环水体中大量繁殖感染其他健康鱼苗从而造成大批量的死亡。因养殖车间苗种外购于南方,中间环节较多,血鹦鹉鱼如何感染木糖葡萄球菌,尚需进一步调查。通过对该菌在其他鱼类及陆生动物的攻击试验研究表明,该菌在较低温度时对斑马鱼(Brachydaniorerio)和金鱼 (Carasiusauratus)致病性不强[24],但腹腔注射对小鼠有一定致病力。从本研究和红龙鱼感染人畜共患中间葡萄球菌的报道来看,观赏鱼感染此类病原菌的潜在危害较大,如果携带病菌或发病的鱼进入普通家庭,在日常养殖过程中可能成为潜在传染源,造成宠物或接触者感染[25]。
在病害防治过程中也应注意链球菌病害与该病原造成病症的区分。目前对于控制水产养殖动物疾病的发生和流行大多仍采用抗菌药物,然而依靠化学药物防治容易导致病原菌产生耐药性,需要有效合理地应用抗生素是防治鱼类细菌性疾病的重要措施之一[26]。在水产动物中此类疾病传播的防控中需要注意科学用药降低多重耐药菌的产生几率。
4 结 论
根据从患病的血鹦鹉鱼肝脏组织分离菌株的形态学特征、生理生化特征、药敏试验、分子生物学鉴定、攻毒试验的结果可以初步判定分离于患病血鹦鹉鱼的病原菌为木糖葡萄球菌。木糖葡萄球菌为人—兽—鱼、虾共患病原,在观赏鱼养殖过程中应注意该病原的潜在公共安全隐患。试验应用临床常用抗生素对该菌进行药敏检测,结果表明本次分离的木糖葡萄球菌对磺胺嘧啶、青霉素G、诺氟沙星、四环素高度耐药,对环丙沙星、氧氟沙星中度敏感,对红霉素,丁胺卡那敏感。
[1] 王甘翔, 潘亚均, 宋之琦, 等. 血鹦鹉人工养殖技术[J]. 水产科技情报, 2009, 36(3):143-146.
[2] 牟春艳, 郑曙明, 任胜杰, 等.不同体色血鹦鹉鱼的色素细胞种类、数量及色素含量[J]. 水产科学, 2015, 34(8):497-501.
[3] 石英, 冷向军, 李小勤, 等.饲料蛋白水平对血鹦鹉幼鱼生长、体组成和肠道蛋白消化酶活性的影响[J]. 水生生物学报, 2009, 33(5):874-880.
[4] 马树敏, 李秀梅, 常洪敏, 等. 地热水养殖血鹦鹉车轮虫病的治疗方法[J].天津水产, 2008 (增1):40-41.
[5] 梁利国, 秦国民, 张晓君, 等.血鹦鹉铜绿假单胞菌病原菌鉴定和药敏试验[J].淡水渔业, 2010, 40(6): 50-55.
[6] 王春清. 一颗心鹦鹉鱼病毒性睡眠病的诊断与防治[J].黑龙江畜牧兽医, 2013, 7(14):118.
[7] 张曦, 杨增岐, 宋长绪. 猪渗出性皮炎病原的分离鉴定[J]. 西北农业学报, 2011,17(4):38-41.
[8] William R H.Bergey’s manual of determinative bacteriology [M]. 9th edition. Philadelphia: Lippincott Williams & Wilkins, 1994: 532-551.
[9] 孙长贵, 成军, 杨燕. 2009年CLSI M100-S19文件主要更新内容介绍[J]. 浙江检验医学, 2009, 7(2): 8-10.
[10] 钱晋希, 吴辉云. 153株血浆凝固酶阴性葡萄球菌感染及药敏分析[J].实验与检验医学, 2012, 30(5): 493-494.
[11] 孙鹤年. 腐生葡萄球菌和其他几种葡萄球菌的血凝作用[J]. 国外医学: 微生物学分册, 1979, 2(4):193.
[12] 施雪梅, 彭少华, 樊秀华, 等. 凝固酶阴性葡萄球菌医院感染及耐药性分析[J].中国人兽共患病杂志,1999,15(4):71-72.
[13] 车惠琴, 韩敏娣. 19株木糖葡萄球菌的生物学特性和鉴定[J]. 临床检验杂志, 2001, 19(4):226.
[14] Rupp P E, Archer G L. Coagulate-negative staphylococci: pathogens associated with medical progress [J].Clin Infect Dis, 1994, 19(6):231.
[15] Martin de Nicolás M M, Vindel A , Offez-Nieto J A. Epidemiological typing of clinically significant strains of coagulase-negative staphylococci [J]. Journal of Hospital Infection, 1995, 29(1):35-43.
[16] Harmon R J,Langlois B E. Mastitis due to coagulase negativeStaphylococcusspecies [J].Agri Practice, 1989, 10(1):29-34.
[17] 洪帮兴, 江丽芳, 曾敏.凝固酶阴性葡萄球菌引发术后医院感染的鉴定与相关分析[J].中国卫生检验杂志, 2000, 10(5):554.
[18] 李淑云, 蔡淑清, 宋明忠, 等.木糖葡萄球菌引起肺炎败血症1例[J].齐齐哈尔医学院学报, 1994, 15(4):198.
[19] 戈胜强, 柴同杰, 秦梅. 奶牛乳房炎葡萄球菌的分离鉴定及耐药性检测[J].西北农林科技大学学报: 自然科学版, 2008, 36(11):40-46.
[20] 姜娜, 罗琳, 李铁梁, 等.红龙鱼中间葡萄球菌病的诊治实例[J].科学养鱼, 2010, 26(7):59.
[21] 周煜华.黄鳝鱼的松鼠葡萄球菌的分离与鉴定[J].广西畜牧兽医, 2000, 16(1):15-17.
[22] 梁森汉, 郑重, 邓国成, 等. 罗氏沼虾肌肉白浊病的防治研究[J].淡水渔业, 2001, 31(5):34-36.
[23] 姜兰, 劳海华, 简清, 等. 罗氏沼虾木糖葡萄球菌Xia-5#菌株的分类鉴定[J].水产学报, 2004, 28(增刊):124-129.
[24] 葛丽婷, 刘青, 王一帆,等. 鱼源葡萄球菌对金鱼和斑马鱼致病性的研究[J].黑龙江农业科学, 2014(8):69-70.
[25] 徐晓丽, 李贺密, 崔宽宽, 等. 养殖观赏鱼六鞭毛虫感染症的防治[J].河北渔业, 2013(5):37-39.
[26] 苏应兵, 邹桂伟, 袁科平, 等.斑点叉尾鮰暴发性败血症病原的分离与鉴定[J].淡水渔业, 2006,36(5):37-41.
IdentificationandDrugResistanceofStaphylococcusxylosusIsolatedfromCichlidCichlasomavar.
LIU Qing1, ZHAO Mingwu2, CAO Xinlei2, LIU Xinzheng2
( 1. College of Animal Science and Veterinary Medicine, Shanxi Agricultural University, Taigu 030801, China;2. Fish Hatchery of Taiyuan, Taiyuan 030025, China )
The pathogenic bacteria were isolated from the kidney of diseased CichlidCichlasomavar. and made physiological,biochemical and molecular biological identification. Furthermore,drug sensitive tests and artificial infection experiments were performed in order to develop effective control and prevention measures. After 24 hours, the bacteria cultured on blood agar and clones were circular with smooth and neat edges and a weak zone of hemolysis around. The bacteria were Gram positive coccobacteria and had the diameter about 0.8 — 1.0 μm, most of which were acervate, a few scattered pairs or quadruple-like arrangement, without capsule or flagella and no spores either. Based on physiological and biochemical characteristics, the strain was identified asStaphylococcusxylosus. Analysis of the 16S rDNA sequence of the strain showed that it belonged toStaphylococcus, and had farther distance withStreptococcus, and that the similarity to uploaded 16S rDNA sequence ofS.xylosusin GenBank database was 99%. Cluster analysis revealed that the bacteria had the smallest genetic distance withS.xylosus. Pathogenicity of the isolated strain was determined by artificial infection experiment and it was found that it had strong pathogenicity toCichlasomavar. juveniles. The bacteria susceptibility test indicated that the bacterial strain was resistant to sulfadiazine, penicillin, norfloxacin, tetracycline, but sensitive to erythromycin, and amikacin, and moderately sensitivity intermediate with ciprofloxacin and ofloxacin.
Cichlasomavar.;Staphylococcusxylxosus; 16S rDNA; identification; drug resistance
10.16378/j.cnki.1003-1111.2016.02.014
S917.1
A
1003-1111(2016)02-0174-05
2015-09-21;
2015-11-12.
山西省科学技术发展计划项目 (20130311028-5);山西农业大学育种基金资助项目(20132-22).
刘青(1980-),男,讲师;研究方向:水产动物健康养殖与病害防治. E-mail:liuqing_sxau@126.com.

