一例藏香猪混合感染猪流行性腹泻病毒与圆环病毒2型的报告
索朗扎西,许思遥,杨凡,李雨濛,樊毅,文军,朱玲,徐志文,4
(1.四川农业大学动物生物技术中心,四川成都611130;2.西藏自治区山南市琼结县农牧综合服务中心,西藏山南856800;3.阿坝州博文农牧科技有限公司,四川阿坝藏族羌族自治州624000;4.四川农业大学动物疫病与人类健康重点实验室,四川成都611130)
一例藏香猪混合感染猪流行性腹泻病毒与圆环病毒2型的报告
索朗扎西1,2,许思遥1,杨凡1,李雨濛1,樊毅1,文军3,朱玲1,徐志文1,4
(1.四川农业大学动物生物技术中心,四川成都611130;2.西藏自治区山南市琼结县农牧综合服务中心,西藏山南856800;3.阿坝州博文农牧科技有限公司,四川阿坝藏族羌族自治州624000;4.四川农业大学动物疫病与人类健康重点实验室,四川成都611130)
2016年3月四川九寨沟某藏香猪养殖基地出现10余例仔猪死亡案例,临床症状主要表现为呕吐,腹泻,水样稀便及消瘦,病程短,病死率高,呈典型病毒病症状。剖解发现小肠大面积充气,肠壁明显变薄,肠系膜淋巴结充血肿大,肾脏有大量出血点,腹股沟淋巴结充血肿大。采集病料进行实验室RT-PCR、PCR检测,结果为猪流行性腹泻病毒和圆环病毒2型阳性。结合临床症状、病理解剖特征及实验室检测结果,确诊为猪流行性腹泻病毒与圆环病毒2型混合感染。
藏香猪;猪流行性腹泻病毒;圆环病毒2型;混合感染
藏香猪,别名“藏血豚”、“人参猪”,是我国川西高原、云南、西藏、甘肃甘南和岷县特有的一种古老畜种,也是我国唯一的高原、高寒放牧猪种[1]。藏香猪除具有耐严寒、耐粗饲、抗病性强等优点外,猪肉特有的营养及风味使之成为高端产品的必选。伴随藏香猪养殖规模化程度提高,由此所致疫病增多、疫情更复杂,使藏香猪养殖面临着新的挑战和困难。2016年3月,四川九寨沟某藏香猪养殖基地出现10余例仔猪腹泻,主要表现为呕吐,腹泻,水样稀便及消瘦,病程短,病死率高,经采样后送四川农业大学动物生物技术中心做实验室检测。
1 材料与方法
1.1 临床症状及样品采集
2016年3月四川九寨沟某自繁自养式藏香猪养殖基地3~20日龄仔猪发病,主要表现为呕吐、消瘦、水样腹泻、腹泻1 d后迅速死亡。青霉素、链霉素治疗效果不明显,死亡率高。解剖后发现病理变化主要在肠道,出现明显的小肠肠壁变薄、充气、出血,肠内有未消化乳块,肠系膜淋巴结肿大、出血呈深褐色。采集症状典型新死亡仔猪肠黏膜、肠内容物、肠系膜淋巴结冰冻保存,送四川农业大学动物生物技术中心进行实验室病原学检测。
1.2 主要仪器和材料
Mastercycler PCR扩增仪(Eppendorf,德国)、Gel Doc 2000凝胶图像分析系统(BIO-RAD,美国)、2×Taq Plus PCR MasterMix(含染料)购自天根生化科技(北京)有限公司,反转录试剂盒、TakaRa Taq DNA酶和DL 2 000 DNA Marker(宝生物工程大连有限公司)。
1.3 引物设计与合成
根据GenBank中收录的猪流行性腹泻病毒(PEDV)、猪传染性胃肠炎病毒(TGEV)、猪轮状病毒(PoRV)、伪狂犬病病毒(PRV)、圆环病毒2型(PCV2)序列,设计特性检测引物(表1)。

表1 检测引物序列
1.4 病料处理及DNA/RNA提取
取采集病料0.5~2.0 g研磨,并按1∶3比例加入生理盐水配成病料悬液,随后反复冻融3次。冻融后按12 000 r/min离心5 min后取上清液,分别按照Trizol法和酚-氯仿法提取RNA和DNA,并将提取的RNA按照反转录试剂盒方法制成cDNA保存备用。
1.5 PCR扩增反应
将cDNA进行PEDV、TGEV、PoRV检测,提取的DNA进行PRV、PCV2检测。PCR扩增体系见表2,各病毒PCR扩增程序见表3。

表2 PCR扩增体系(20 μL)

表3 PCR扩增程序
2 结果
以实验室保存的阳性毒株作为各检测的阳性对照,若出现与阳性对照相符的目的条带,则判定为阳性,反之判定为阴性。琼脂糖凝胶电泳结果显示PEDV、PCV2为阳性,结果见图1。
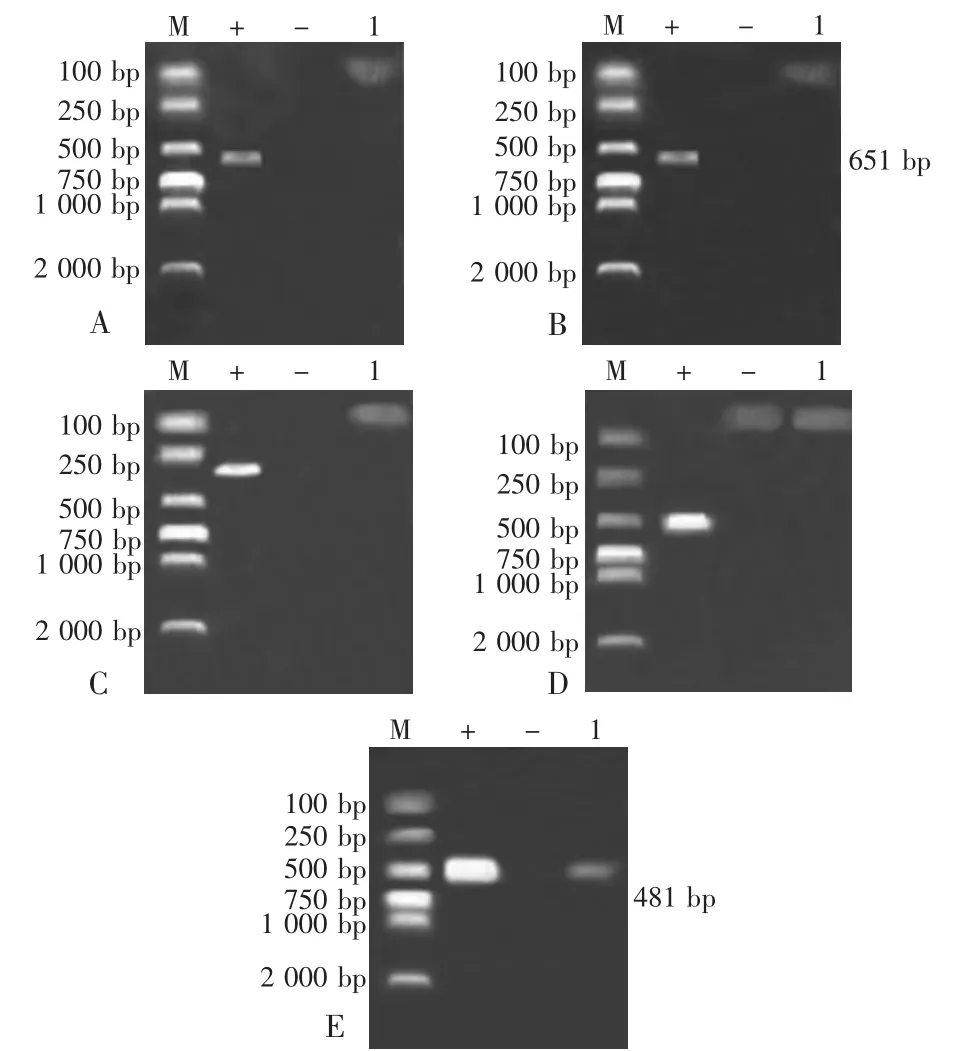
图1 PCR产物琼脂糖凝胶电泳
3 分析与讨论
藏香猪作为我国优良地方猪种,抗病性强、耐粗饲是其突出的优点。随着饲养模式的改变近年关于藏香猪病例报道也日益增加,2011年湖南报道了藏香猪传染性胸膜肺炎与毛首线虫混合感染案例[2],2014年3月辽宁报道一起藏香猪感染附红细胞体致育成猪死亡42头、仔猪死亡138头的严重案例[3],同年4月,贵州报道另一起藏香猪混合感染PRV、PCV2和附红细胞体的案例[4],可见疫病控制是藏香猪规模化养殖过程中面临的新问题,其抗病性强的优点并不能起绝对的保护作用。经对本次病例送检样品进行相应分子检测,结果显示为PCV2与PEDV混合感染,分析认为,九寨沟县3月处于较为寒冷的初春季节,加之发病猪群没有接种PCV2、PEDV相关疫苗,这些因素均有利疫情的发生。PEDV和PCV2都会引起新生仔猪腹泻,早期Hirai等[5]就已经报道了新生仔猪的PEDV和PCV2双重感染病例,并有人提出PCV2可能参与新生仔猪PEDV感染的病理进程。临床观察发现感染PCV2的仔猪在感染PEDV时会出现更为严重的腹泻[6]。且已有试验证明,母猪感染PCV2后,会加快仔猪感染PEDV后的病程发展[7]。有研究指出,多病原混合感染会影响细胞因子的产生和表达类型,阻碍仔猪对PCV2的清除,仔猪体内细胞因子数量的下降为PCV2提供了有利的体内环境,从而促进病毒增殖[8],可见二者在感染仔猪过程中存在关联。近期对四川PCV2流行病学调查结果也证实了以上观点,发生腹泻仔猪中PCV2阳性率呈现升高趋势,对四川13个地市436份样品检测,结果显示,PCV2阳性样本有312份,阳性率为71.55%,其中攀枝花市阳性率最高,达88.89%。而重点对采自9个地市的75份仔猪腹泻病料分析,共有66份PEDV阳性病料,总阳性率为88.00%,个别市区阳性率甚至达100%;75份样品PCV2的检出率高达80%[9],可见目前四川PEDV、PCV2流行较为普遍,且混合感染严重。
建议发病场进行相关疫苗的免疫,母猪产前40 d、20 d用灭活疫苗配合活疫苗进行PEDV的加强免疫;按程序进行PCV2疫苗的免疫;同时加强综合措施,重点注意圈舍保温、保持干燥,病猪的隔离、对症处理及环境消毒,疫情很快得到有效控制。
[1]周治宏,贡吉卓玛.养殖技术顾问[J],2012(12):198-199.
[2]唐伟.现代畜牧兽医[J],2012(7):43-44.
[3]梅强.畜牧兽医科技信息[J],2016(1):64.
[4]姜玲玲,史开志,徐景峨,等.中国畜牧兽医[J],2014,41(10):225-229.
[5]Hirai T,Nunoya T,Ihara T,et al.Veterinary Record[J],2001, 148(15):482-484.
[6]Kim O,Chae C.Veterinary Pathology[J],2000,37(1):62-67.
[7]Jung K,Kim J,Ha Y,et al.Veterinary Journal[J],2006,171(3): 445-450.
[8]Chae C.The Veterinary Journal[J],2005,169(3):326-336.
[9]阳酉萍,黄小波,曹三杰,等.中国兽医学报[J],2015,35(5):704-710.
(编辑:郭玉翠)
S858.28
A
1002-1957(2016)05-0103-02
2016-07-12
四川省科技支撑计划(2014NZ0043;2015NZ0072)
索朗扎西(1981-),男,藏族,西藏拉萨人,兽医师,主要从事兽医方向研究.E-mail:15378277188@163.com

