2,9-二甲基-1,10-菲罗啉促进的直接C-H芳基化反应
朱逸伟,施一新,伍中豪
安徽工程大学生物与化学工程学院,安徽芜湖,241000
2,9-二甲基-1,10-菲罗啉促进的直接C-H芳基化反应
朱逸伟,施一新,伍中豪
安徽工程大学生物与化学工程学院,安徽芜湖,241000
对几种菲罗啉的衍生物进行了考察,结合叔丁醇钾,在没有过渡金属催化剂参与的情况下,2,9-二甲基-1,10-菲罗啉能有效地催化苯与芳基碘化物的直接C-H芳基化反应。通过模板反应考察了催化剂、催化剂用量、温度以及碱对反应的影响,确定了最佳反应条件。随后考察了反应底物范围,不同的芳基碘化物能取得48%~81%的偶联反应产率。同时讨论了催化剂的作用,随后通过相关实验证明反应中存在自由基中间体,并提出此催化反应可能的反应机理:链式均裂芳环取代。
2,9-二甲基-1,10-菲罗啉;无过渡金属参与;绿色化学
自然界中,在一些有生物活性的物质里经常发现联苯化合物;在一些药物和功能分子中[1-3],联苯结构也是不可或缺(图1)。近年来,化学工作者对联苯化合物的研究也越来越多,在合成联苯类化合物方面,通用而又有效的方法是过渡金属催化法,且这一方法一度成为合成此类化合物的主流。但在很多情况下,对金属的残留有非常严格的限制,比如药物合成,因此,无过渡金属参与的反应受到了更多的重视[4-8]。

图1 带联苯结构单元的几种生物活性分子
对于联苯类化合物的合成,目前出现了一种新方法,即均裂芳环取代(homolytic aromatic substitution,HAS)法,该方法在叔丁醇钾参与下,无需过渡金属就能在较为温和的条件下高效地合成联苯化合物[9-12],此类反应一般会经历含有自由基负离子的反应过程。越来越多的化学工作者投入到相关工作的研究中,发现了很多有效的催化体系,比如DMEDA、苯肼、特殊结构的自由基分子、脯氨酸,甚至简单的醇都能结合相应的碱有效催化C-H直接芳基化反应,得到联苯类化合物[13-15],这些研究开启了研究C-H直接芳基化反应的新篇章(图2)。
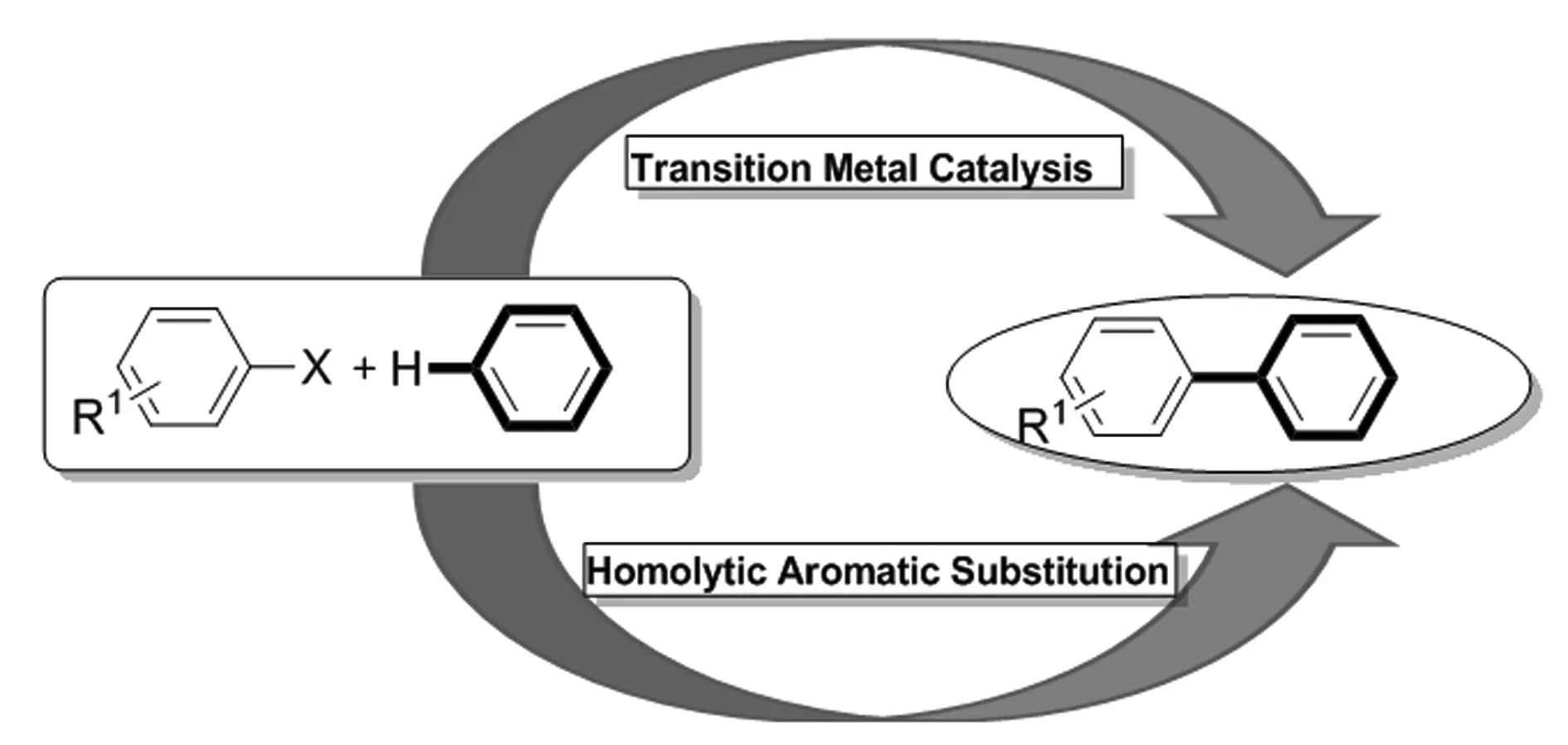
图2 过渡金属催化对比芳环均裂取代
1 实验部分
1.1 试剂与仪器
本实验中所用试剂和溶剂均为商业化产品(分析纯)且并未进一步提纯。气相色仪型号:Agilent 7890A,生产厂家:安捷伦公司 (测试条件:Column:Agilent 19091J-413:30 m×320 mm×0.25 mm,carrier gas:N2,Injector:300℃,FID detection detector:initial temperature 80℃,temperature program:15℃/min,final temperature 325℃.H230 mL/min,air 400 mL/min,N225 mL/min);气质联用仪器型号:Trace DSQ (Finnigan),生产厂家:美国热电集团;核磁共振仪型号:Bruker Avance 500 MHz或者300 MHz,生产厂家:德国布鲁克公司,内标为TMS。
1.2 实验方法
在室温下,将KOt-Bu(224.4 mg,2.0 mmol)、4-甲氧基碘苯(117.0 mg,0.5 mmol)、2,9-二甲基-1、10-菲罗啉(312.4 mg,1.5 mmol) 以及苯(5.0 mL)一次加入到配有四氟乙烯塞的耐压管中,随后将塞子塞紧,在100℃下磁力搅拌反应24 h。待反应混合物降至室温后,用乙酸乙酯萃取(10 mL×3),将有机层合并,用无水硫酸钠干燥有机层,过滤出固体后,减压除去溶剂。最后进行柱层析分离(石油醚),得到目标产物(67.2 mg,73% yield)。
1.3 部分产物的表征数据

1H NMR(500 MHz,CDCl3)δ7.59-7.55(m,4H),7.44(t,J=7.6,7.5 Hz,2H),7.33(t,J=5 Hz,1H),7.01(d,J=5 Hz,2H),3.87(s,3H);13C NMR(125 MHz,CDCl3)δ158.2,139.9,132.8,127.8,127.2,125.8,125.7,113.3,54.4。
1H NMR(500 MHz,CDCl3)δ7.66(d,J=10Hz,4H),7.50(t,J=7.5Hz,4H),7.41(t,J=7.5Hz,2H);13C NMR(125 MHz,CDCl3)δ140.3,127.9,126.4,126.3。

1H NMR(500MHz,CDCl3)δ7.69-7.65(m,8H),7.47(t,J=7.5 Hz,4H),7.37(t,J=7.5 Hz,2H);13C NMR(125MHz,CDCl3)δ139.7,139.2,127.9,126.6,126.4,126.1。

1H NMR(500 MHz,CDCl3)δ7.57-7.54(m,4H),7.45(t,J=7.5 Hz,2H),7.35(t,J=7.5 Hz,1H),7.13(t,J=7.5 Hz,2H);13C NMR(125 MHz,CDCl3)δ161.5,139.3,136.4,127.9,127.8,127.7,126.3,126.1,114.7,114.6。
2 结果与讨论
2.1 反应最佳条件确定
以4-甲氧基碘苯(1a)与苯(2a)作为模板反应底物来确定反应的最佳条件,见表1。当用0.5 mmol的1a和2 mmol的KOt-Bu以及50 mol%的催化剂C1在100℃的2a(5 mL)中反应24 h后,得到产物4-甲氧基联苯(3a)的产率为64%(entry 1);随着催化剂用量增加到100 mol%和300 mol%时,模板反应分别得到相应产物的产率为77%和81% (entries 2,3);当把反应温度降低至80℃时,产率只有62%;在探索最佳反应条件过程中,不同的碱被用于反应之中,如K2CO3、NaOt-Bu、KOH和LiOt-Bu(entries 6~9),但效果不如KOt-Bu好;催化反应同样进行了不同菲罗啉类催化剂的考察,C2~C5被用到了模板反应中,当C2和C3作为催化剂时,得到了不错的产率(entries 10,11),但C4和C5作为催化剂时,没有得到让人满意的效果(entries 12,13);如果此反应中不加入催化剂C1,基本没有产物3a的生成(entry 5)。最后entry 3的反应条件被定位最佳条件,并用于随后的底物拓展中。
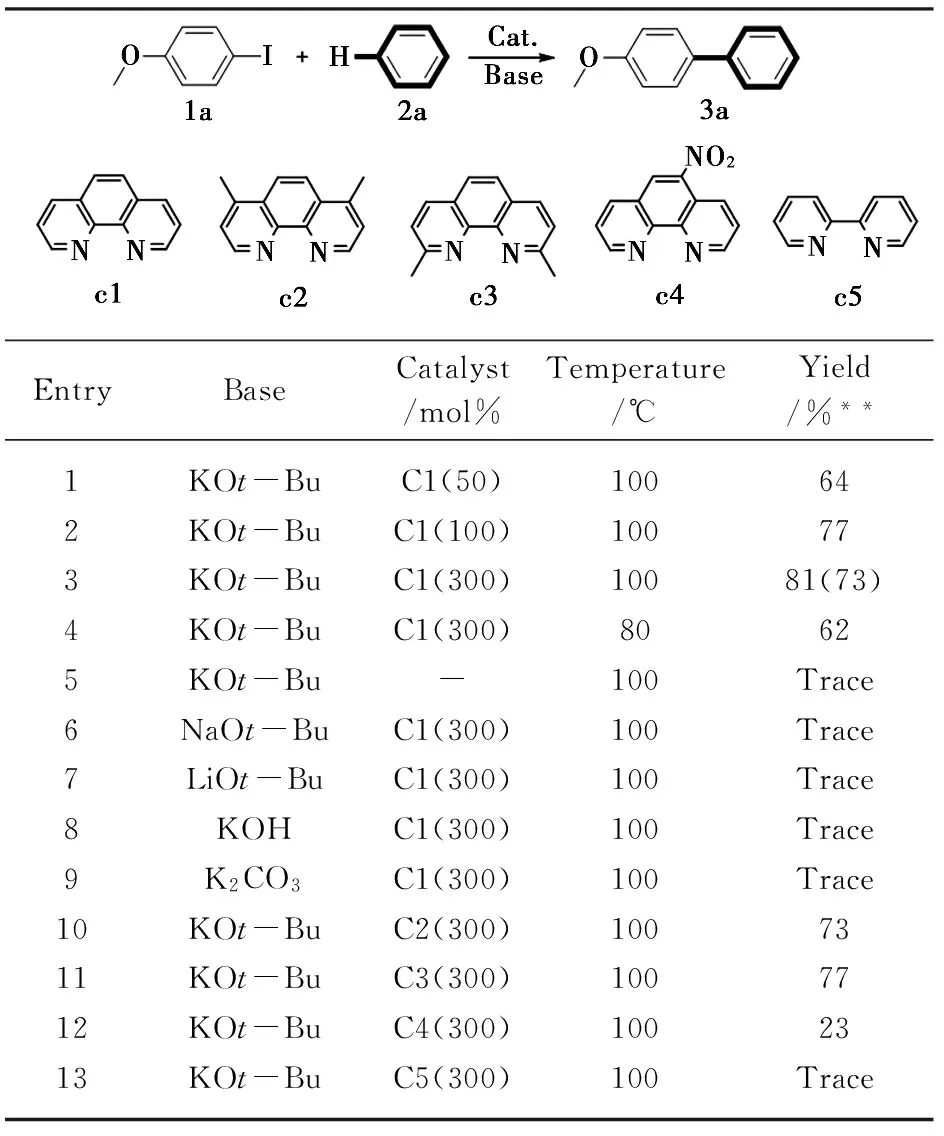
表1 模板反应最佳条件选择*
*反应条件:对甲氧基碘苯0.5 mmol,碱2 mmol,苯2a 5 mL;**气相色谱产率(内标法)。
2.2 反应底物范围
随后,对C1与KOt-Bu结合催化的苯与芳基卤化物的直接C-H芳基化反应进行了反应底物范围的研究(表2)。在模板反应确定的最佳反应条件下,所有的芳基碘化物都能顺利反应,并且得到不错的反应产率 (entries 1,4~14), 而溴苯或氯苯与苯的芳基化反应进行得并不很顺利,只能得到26%和11%的气相产率,这很可能是因为C-I键的均裂要比C-Br键和C-Cl键的均裂更加容易(entries 1-3)。有趣的是,当1,4-二碘苯被用作反应的底物时,三联苯的产率为68%,如果将反应的底物换位1-氯-4-碘苯或者1-溴-4-碘苯作为时,反应的产率非但没有明显下降,而且不比二碘苯作为底物时的低(entries 10~12)。

表2 正丁醇与叔丁醇钾结合催化苯与芳基卤化物直接C-H芳基化的底物探索
*芳基碘化物10.5 mmol;叔丁醇钾2 mmol;苯2a 5 mL;反应温度100℃;**气相色谱产率 (内标法)。
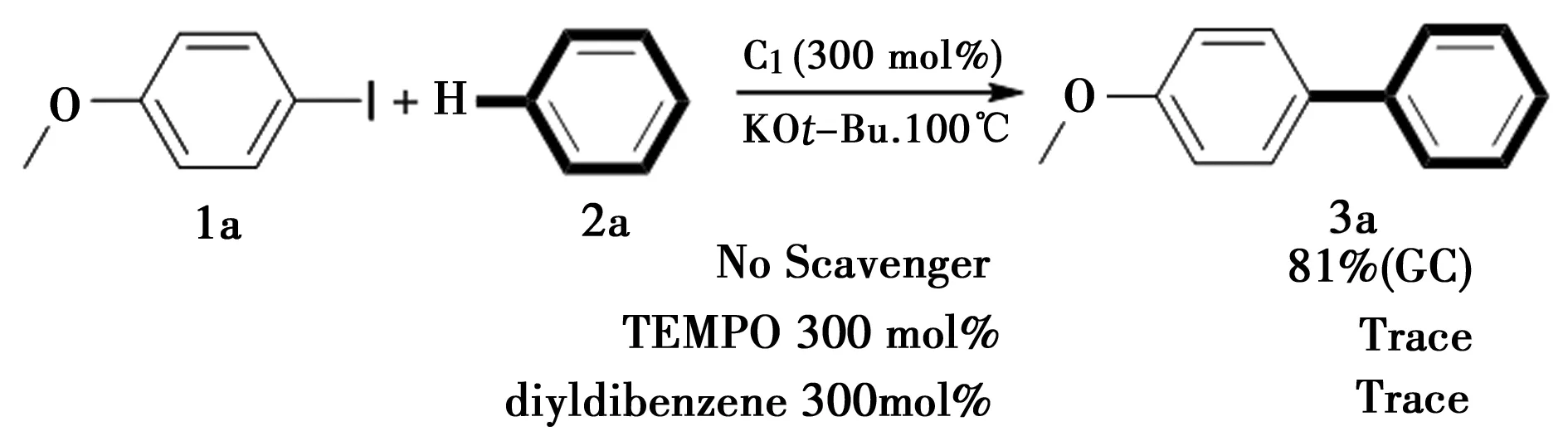
图3 自由基捕获试验
2.3 反应机理
为了能更深入地认识由2,9-二甲基-1,10-菲罗啉结合叔丁醇钾促进的直接C-H芳基化,两种常用的自由基捕获剂——1,1-二苯基乙烯(diyldibenzene)和2,2,6,6-四甲基哌啶-氮-氧化物(Tempo)被加入到之前的模板反应中。自由基捕获试验如图3所示,加入这两种自由基捕捉剂后,模板反应不能够顺利进行,没有被检测到联苯产物,说明此反应中存在自由基历程。
相关研究表明[16-18],2,9-二甲基-1,10-菲罗啉C1这样的二胺结构应作为有机电子给予体的前体存在。对整个催化反应,单电子转移(SET)的过程存在于2,9-二甲基-1,10-菲罗啉C1与KOt-Bu结合催化苯的直接C-H芳基化反应的机理中。首先,在C1与KOt-Bu作用下,通过单电子转移,芳基卤化物1b生成卤化物自由基阴离子4,此自由基阴离子随后转变为自由基5,自由基5随即与苯2a结合后生成了稳定的六元环自由基6,此步反应发生很快,在KOt-Bu的协助下夺取质子,产生自由基7,自由基7随后又回过头与1b作用,形成自由基的链转移,生成了最终产物3b和另一分子自由基4(图4)。
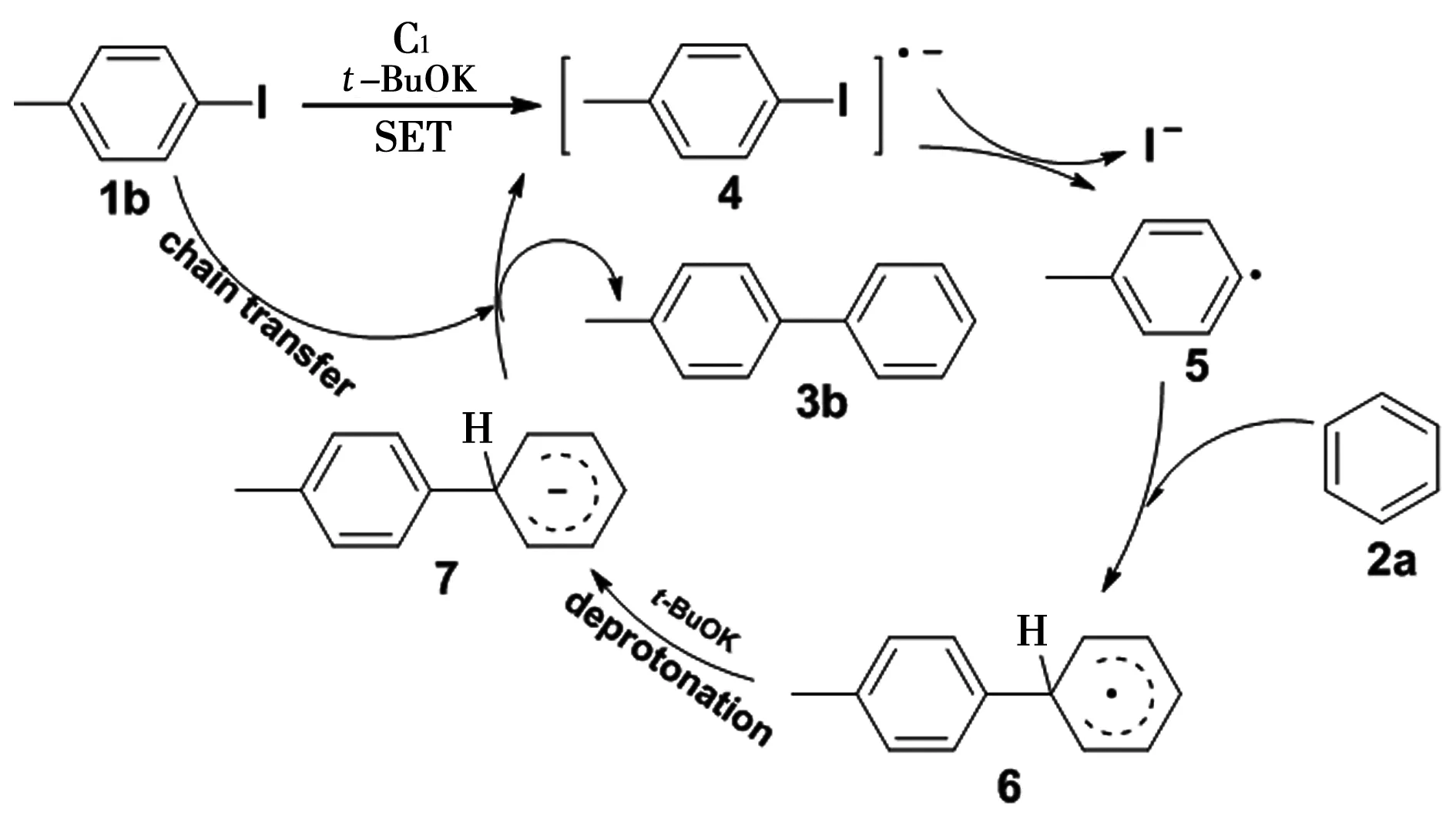
图4 可能的反应机理
3 结 论
(1)对于菲罗啉类催化剂中,2,9-二甲基-1,10-菲罗啉C1表现出最高的反应活性,且整个反应过程并无过渡金属参与。
(2)C1结合KOt-Bu能顺利催化4-甲氧基碘苯与苯的偶联反应,对甲氧基碘苯用量为0.5 mmol、KOt-Bu用量为2 mmol、催化剂C1用量为300 mol%、苯用量为5 mL,反应温度为100℃时,反应产率能达到81%,在这种反应条件下,不同芳基碘化物能得到48%~81%的偶联反应产率。
(3)催化反应存在自由基负离子,二胺结构的催化剂作为有机电子给予体的前体存在,整个反应以链式均裂芳环取代机理发生。
[1]Dewanji A,Murarka S,Curran D P,et al.Phenyl hydrazine as Initiator for direct arene C-H arylation via base promoted homolytic aromatic substitution[J].Organic Letters,2013,15(23):6102-6105
[2]Fujiwara Y,Domingo V,Seiple I B,et al.Practical C-H hunctionalization of quinones with boronic acids[J].Journal of the American Chemical Society,2011,133(10):3292-3295
[3]Sun C L,Li B J,Shi Z J.Direct C-H transformation via iron catalysis[J].Chemical Reviews,2011,111(3):1293-1314
[4]Uchiyama N,Nishikawa E,R,et al.Iron-catalyzed oxidative coupling of arylboronic acids with benzene derivatives through homolytic aromatic substitution[J].Chemical Communications,2011,47(42):11671-11673
[5]Wen J,Zhang J,Chen S Y,et al.Iron-mediated direct arylation of unactivated arenes [J].Angewandte Chemie International Edition,2008,47(46):8897-8900
[6]Liu D,Liu C,Li H,et al.Direct functionalization of tetrahydrofuran and 1,4-dioxane:nickel-catalyzed oxidative C(sp3)-H arylation[J].Angewandte Chemie International Edition,2013,52(16):4453-4456
[7]Studer A,Curran D P.Organocatalysis and C-H activation meet radical-and electron-transfer reactions[J].Angewandte Chemie International Edition,2011,50(22):5018-5022
[8]Noel T,Maimone T J,Buchwald S L.Accelerating Pd-catalyzed C-F bond formation:use of a microflow packed-bed reactor [J].Angewandte Chemie International Edition ,2011,50(38):8900-8903
[9]Yanagisawa S,Ueda K,Taniguchi T,Itami K.Potassium t-butoxide alone can promote the biaryl coupling of electron-deficient nitrogen heterocycles and haloarenes[J].Organic Letters,2008,10(20):4673-4676
[10]Qiu Y,Liu Y,Yang K,et al.New ligands that promote cross-coupling reactions between aryl halides and unactivated arenes[J].Organic Letters,2011,13(14):3556-3559
[11]Sun C L,Li H,Yu D G,et al.An efficient organocatalytic method for constructing biaryls through aromatic C-H activation [J].Nature Chemistry,2010,2(12):1044-1049
[12]Shirakawa E,Itoh K,Higashino T,et al.tert-butoxide-mediated arylation of benzene with aryl halides in the presence of a catalytic 1,10-phenanthroline derivative[J].Journal of the American Chemical Society,2010,132(44):15537-15539
[13]Pschierer J,Plenio H.Retraction:Suzuki-Miyaura coupling of aryl tosylates and mesylates in water [J].European Journal of Organic Chemistry,2010,2010(15):2934-2937
[14]Bertelsen S,Jorgensen K A.Organocatalysis-after the gold rush [J].Chemical Society Reviews,2009,38:2178-2189
[15]Zhao D,Wang W,Yang F,et al.Copper-catalyzed direct C arylation of heterocycles with aryl bromides:discovery of fluorescent core frameworks [J].Angewandte Chemie International Edition,2009,48(27):3296-3300
[16]Zhou S,Doni E,Anderson G M,et al.Identifying the roles of amino acids,alcohols and 1,2-Diamines as mediators in coupling of haloarenes to arenes [J].Journal of the American Chemical Society,2014,136(44):17818-17826
[17]Doni E,Murphy J A.Evolution of neutral organic super-electrondonors and their applications [J].Chemical Communications,2014,50(42):6073-6087
[18]Murphy J A.Discovery and development of organic super-electron-donors[J].The Journal of Organic Chemistry,2014,79(15):3731-3746
(责任编辑:汪材印)
2016-07-25
安徽省高校自然科学研究重点项目(KJ2014A014);安徽工程大学引进人才项目(2014YQQ011);安徽工程大学自然科学基金预研项目(2016yyzr06)。
朱逸伟(1988-),江苏淮阴人,博士,讲师,主要研究方向:绿色有机合成。
10.3969/j.issn.1673-2006.2016.11.030
O622
A
1673-2006(2016)11-0114-04

