中药骨康方对体外培养大鼠成骨细胞骨架保护作用的初步实验研究
张姝江 李 颖 白 波 陈 艺
(1 广州医科大学附属第一医院,广东省矫形技术与植入材料重点实验室,广州,510120;2 广东省中西医结合医院骨科,佛山,528200)
中药骨康方对体外培养大鼠成骨细胞骨架保护作用的初步实验研究
张姝江1李 颖2白 波1陈 艺1
(1 广州医科大学附属第一医院,广东省矫形技术与植入材料重点实验室,广州,510120;2 广东省中西医结合医院骨科,佛山,528200)
目的:探讨在离心力作用下中药骨康方对大鼠成骨细胞微丝结构的保护与修复作用。方法:选用成年新西兰白兔,分2组分别灌服中药骨康方及戊酸雌二醇,制备中药骨康方和雌激素的含药血清。原代培养大鼠成骨细胞,制备细胞爬片,分为中药骨康方血清培养组(中药组),雌激素血清培养组(西药组)、不含药血清组(对照组)以及空白组。中药组、西药组及对照组3组细胞分别在240 g、200 g离心力下离心4 min,空白组不离心,离心后培养24 h以多聚甲醛固定各组细胞,鬼笔环肽荧光染色后,于共聚焦显微镜下观察。每张细胞爬片随机取5个视野,每个视野5~7个细胞,计算平均荧光值,并作统计学计算,P<0.05为有统计学意义。结果:不同离心力作用下,中药组、西药组细胞与对照组细胞比较荧光强度明显较强,且差异有统计学意义(P<0.001)。中药组与西药组中,240 g离心力与200 g离心力相比,前者细胞微丝荧光强度显著减弱(P<0.001);中药组与西药组相比,200 g时,中药组细胞微丝荧光强度强于西药组细胞,有统计学意义(P<0.001);240 g时,西药组细胞微丝荧光强度强于中药组细胞,且有统计学意义(P<0.001)。结论:离心力作用下,中药骨康方含药血清对大鼠成骨细胞的微丝结构由保护和修复作用,但随着离心力的加大,该作用有限。
中药;成骨细胞;肌动蛋白;机械应力
成骨细胞在继续分化为骨细胞并修复重建骨结构的过程会收到环境中力学刺激的影响,而成骨细胞如何感应到力学作用并转化为信号影响其自身的增殖和相关蛋白表达是如今的一个研究点。目前有研究对机械应力作用于成骨细胞后,细胞骨架的变化进行了观察,发现静压力使细胞间隙发生改变,而流体剪切力则直接影响胞质微丝排列,从而使细胞骨架异常,发生细胞皱缩和形态改变[1-2]。周期性应力对骨质疏松的成骨细胞有增粗微丝改善细胞骨架的作用。但是离心力对细胞骨架主要是破坏作用,而中药骨康方能否对这种破坏作用起到保护效果,以及其机制为何是本研究探讨的内容。
1 资料与方法
1.1 一般资料 戊酸雌二醇(拜耳医药保健有限公司,中国),中药骨康方提取液(含生药量1.43 g/mL,广州中医药大学附属骨伤科医院制剂室),药物组成为:补骨脂,制淫羊藿,熟地黄,肉苁蓉,当归,大枣,黄芪,白芍,菟丝子;小牛血清(浙江天杭生物科技有限公司),高糖DMEM培养基(Hyclon公司,美国),鬼笔环肽(FITC-Phalloidin,Sigma),共聚焦显微镜(Zeiss公司,德国),低温高速离心机(Eppendorf公司,德国),二氧化碳培养箱(Thermo公司,美国)。
1.2 方法
1.2.1 含药血清制备 将4只健康新西兰兔随机分为2组,每组2只,分为中药观察组和西药对照组。观察组灌服中药骨康方,对照组灌服戊酸雌二醇,灌胃给药容积为10 mL/kg。用药量以成人的用量推算动物用量,根据人与动物及各类动物间药物剂量换算方法计算[6]。成人按60 kg计算,每天口服28.6 g中药复方,以此推算:兔中药复方用量=2.30×28.6×60-1g×kg-1=1.096 g×kg-1;成人按60 kg计算,每天口服1 mg戊酸雌二醇,以此推算:兔戊酸雌二醇用量=2.30×1×60-1mg×kg-1=0.038 mg×kg-1。所用药物以蒸馏水定容至所需浓度,灌胃1次/d,连续灌胃7 d。2组大白免连续灌胃1周,最后一次灌胃后2 h,分别行心脏采血,将获得的全血置于含抗凝剂的试管中,5~10 min后,于3 000 r/min离心15 min,吸取上清,即获取含药血清,再灭活,抽滤除菌,置-20 ℃保存备用。
1.2.2 SD大鼠成骨细胞培养 1周龄SD大鼠的乳鼠20只,雌雄不限,处死后常规消毒。无菌条件下取乳鼠头盖骨,去掉肌肉及结缔组织,用含双抗的磷酸缓冲液(Phosphate Buffer Solution,PBS)漂洗后剪碎,加入0.1% EDTA与0.25%胰蛋白酶(Typsin,TNE),于37 ℃下消化30 min。加入含血清的培养基DMEM中止消化,弃去上清液,加入0.1%的I型胶原酶,继续于37 ℃下消化1 h。取消化后的混悬液离心,弃上清,加入20%小牛血清的高糖DMEM培养基,反复吹打使细胞分散均匀。以105个/mL接种于培养瓶内,37 ℃,饱和湿度,5%CO2条件下培养,隔天换液。选择3代成骨细胞,分别以不同含药血清做预处理培养,分为中药骨康方血清培养组(中药组)、雌激素血清培养组(西药组)以及空白组:分别加入10%中药组兔血清的高糖DMEM、10%西药组兔血清的高糖DMEM以及10%小牛血清高糖DMEM,培养3~5 d,待细胞达到80%融合后,用0.25%胰蛋白酶和0.1%EDTA混合液消化传代,接种于盖玻片上制成细胞爬片。
1.2.3 不同离心力对细胞骨架作用观察 中药组、西药组以及对照组的细胞爬片培养2 d后,分别于240 g和200 g离心力下离心,离心时间4 min;空白组细胞爬片不加药物亦不离心处理。离心后的细胞继续培养24 h,各组细胞爬片以多聚甲醛固定细胞。
1.2.4 成骨细胞牵引后激光共聚焦显微镜下肌动蛋白细胞骨架的原位表达 固定后的细胞爬片经PBS漂洗后,加入鬼笔环肽,5 μg/mL,避光,于37 ℃下孵育30 min;PBS洗片两次,避光,以PI20 μg/mL复染30 min,50%甘油封片。激光共聚焦显微镜(LSM70,德国Zeiss)下观察,选择波长为488 nm。随机取5个视野,每个视野读取荧光强度并计算平均值。
2 结果
共聚焦荧光显微镜下观察,荧光染色后的细胞骨架。240 g离心力作用后,对照组与含药血清培养的中药组及西药组比较,前者微丝松散、紊乱,细胞出现皱缩、翻卷,荧光强度明显较弱(图1);而240 g离心力作用后,中药组与西药组成骨细胞的微丝松散程度相似,形态略皱缩,荧光强度差异不大。200 g受力细胞中,中药组与西药组成骨细胞的微丝保持较完整,形态正常,2组在荧光显微镜下细胞形态差别不大;未用药的对照组细胞在受离心力作用后,细胞皱缩翻卷明显,细胞骨架荧光暗淡、紊乱(图2)。与不受力的空白对照组相比,中药组200 g和西药组200 g的细胞形态与正常贴壁细胞相同。

图1
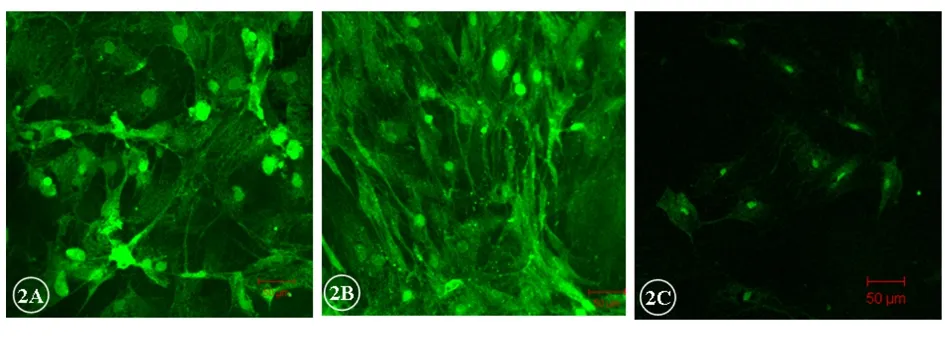
图2
每组荧光染色细胞爬片在镜下随机取5个视野,每个视野读取5~7个细胞的荧光强度平均值,结果计算s,具体结果见表1。中药组与西药组之间进行比较,并与未用药的对照组比较发现:不同离心力作用下,含药血清培养的2组细胞与未用药对照组细胞,其荧光强度明显较强,且差异有统计学意义(P<0.001)。含药血清培养的2组细胞中,240 g受力与200 g受力相比,前者细胞微丝荧光强度显著减弱(P<0.001);中药组与西药组相比,在200 g时,中药组细胞微丝的荧光强度强于西药组细胞,有统计学意义(P<0.001),但240 g时,西药组细胞微丝荧光强度强于中药组细胞,且有统计学意义(P<0.001)。
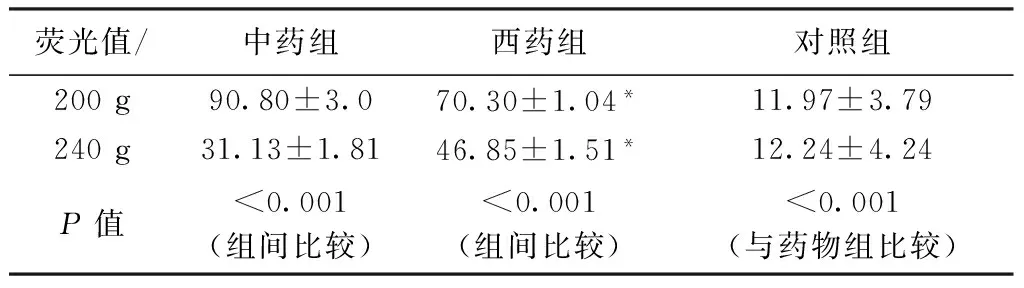
表1 中西药物组在不同转速离心后的细胞骨架荧光值读数比较(s)
3 讨论
力学刺激在骨的发生以及成骨细胞修复骨组织损伤都有重要的作用。在周期性的机械应变力、太空微重力等环境下,骨细胞骨架可以发生重排,机械力对细胞的成长分化有重要作用[3-5]。静压力和剪切力对成骨细胞骨架的调节作用不同,静压力作用下的细胞形态变化微弱,但剪切力可以使细胞内微丝成束重排,细胞变形脱落[2],陈伟辉等[1]发现在流体剪切力作用后,受力的大鼠成骨细胞株出现皱缩、脱落和微丝解聚消散。而离心力对细胞内微丝系统有类似剪切力的效果。陈国平等[6]观察到在离心力作用下,成骨细胞的微丝结构出现解聚,去除刺激后可以缓慢恢复。关键等发现[7],离心力对MC3T3成骨细胞株的刺激可导致Runx2的mRNA表达增加;Li等[8]对成骨样细胞施加离心力10 min后检测到Runx2/Cbfal mRNA表达水平有短暂地增加改变,认为成骨细胞通过多种复杂途径响应机械力学刺激。Fitzgerald等[9]认为对MC3T3-E1细胞加载3×g到287×g离心力都会引起特定基因的mRNA表达增加。机械力学刺激对细胞的多种影响最终体现在细胞骨架的改变上,机械应力作用下,在细胞表面的信号通路相关蛋白觉察到应力刺激信号后,通过细胞骨架介导下游(Down Stream)反应[10-11],从而调节成骨细胞增殖和分化,影响骨改建。
中药对于治疗骨病及关节炎性反应已有悠久历史,目前也有许多研究者针对中药治疗骨病的药物作用机制进行研究。有研究报道,骨康方可以调高成骨细胞保护素和核内因子a1mRNA的表达水平,从而促进骨保护蛋白的表达分泌[12],而该方在大鼠骨质疏松模型的研究中也表现出可以调高骨密度的作用[13]。成骨细胞在未受力时,纤维束粗大而分布均匀,应力纤维清晰可见,受力后,大多数细胞的纤维束变得纤细而稀疏,分布不均匀,方向性变差,并且随加力时间延长而更加明显[14]。通过共聚焦荧光显微镜对细胞骨架进行观察,可以了解在机械力作用后细胞骨架的变化。总荧光强度、绿色荧光强度随加力时间延长均显著降低,这说明微丝结构在机械牵张下发生了解聚和重排。肌动蛋白F-actin是微丝的主要成分,其重排和解聚的动态变化,可以反映部分细胞的功能状况,尤其是细胞结构的状况。以含药血清体外培养细胞并观察药物对细胞的影响是常用的实验研究手段[12,15-16]。本研究采用中药骨康方汤剂喂食大鼠后制备同种动物系的含药血清,并通过荧光染色观察F-actin的变化,从而研究含药血清对大鼠MSC细胞骨架的保护和修复作用。经骨康方含药血清培养的大鼠MSC细胞在经过离心力作用后,细胞骨架微丝系统能获得一定程度的保护和修复,其效果与雌激素含药血清培养的细胞类似,在200 g离心力时,甚至优于雌激素含药血清的保护作用。但随着离心力的加大,该保护作用有限,到240 g时,该保护作用弱与雌激素含药血清的效果,细胞还是会出现骨架微丝系统紊乱的现象。但与完全无含药血清的对照组细胞相比,实验组细胞骨架被破坏程度小,且在停止离心力作用并培养1 d后,可以得到恢复。
目前已知常用的治疗骨质疏松的药物包括雌激素,阿仑膦酸钠等,此类药物对成骨细胞骨架有修复和保护的作用[17]。中药骨康方也是用于骨质疏松防治的中药方剂,有实验研究[18-20]证明中药骨康方对骨代谢既可抑制骨吸收,又可促进骨形成,从而改善骨的质量。临床研究发现对于骨质疏松的患者采用该方治疗后,骨密度有明显增加[20]。根据本研究的结果,中药骨康方在成骨细胞受到外力刺激,对细胞微丝等结构系统产生破坏作用后,该方也显示出了保护和修复的作用。此修复与保护效果为骨质疏松的防治也提示了一条新的路径。
[1]陈伟辉,乔鞠,田卫东,等.不同流动剪切力对原代大鼠成骨细胞细胞骨架的调节作用[J].广东牙病防治,2003,11(2):83-85.
[2]毛勇,段小红,王忠义,等.不同应力对成骨细胞和细胞骨架影响的实验研究[J].牙体牙髓牙周病学杂志,2001,11(2):98-100.
[3]Lozupone E,Favia A,Grimaldi A.Effects of intermittent mechanical force on bone tissue in vitro:preliminary results[J].J Bone Miner Res,1992(Suppl 2):S407-409.
[4]Buckley MJ,Banes AJ,Jordan RD.The effects of mechanical strain on osteoblasts in vitro[J].J Oral Maxillofac Surg,1990,48(4):276-282.
[5]Vico L,Lafage-Proust MH,Alexandre C.Effects of gravitational change on bone system in vitro and in vivo[J].Bone,1998,22(5Suppl):95S-100S.
[6]陈国平,周征,郑翼,等.成骨样细胞受力后细胞骨架中微丝形态结构变化的初步研究[J].华西口腔医学杂志,2002,2(3):213-215.
[7]关键,程宗生,王健平,等.成骨细胞Runx2对机械离心力刺激的响应[J].华西口腔医学杂志,2010,28(l):38-40.
[8]Li J,Jiallg L,Liao G,et a1.Centrifugal forces within usually—used magnitude elicited a transitory and reversible change in proliferation and gene expression of osteoblastie cells UMR-106[J].Mol Biol Rep,2009,36(2):299-305.
[9]Fitzgerald J,Hughes-Fulford M.Mechanically induced c-fos expression is mediated by cAMP in MC313-El osteoblasts[J].FASEB J,1999,13(3):553-557.
[10]Pender N.Quantitation of actin polymerization in two human fibroblast subtypes responding to mechanical stretching[J].J Cell Sci,1991,100(Pt1):187-193.
[11]Damsky CH.Signal transduction by integrin receptors for extracellular matrix:cooperative processing of extracellular information[J].Curr Opin Cell Biol,1992,4(5):772-781.
[12]赵可伟,邱俊林,潘旭枫,等.中药骨康调控成骨细胞核内结合因子α1的表达[J].中国组织工程研究,2013,17(33):5929-5935.
[13]黄杰文,秦佳佳,张素萍.中药骨康对骨质疏松大鼠模型骨密度的影响[J].广州中医药大学学报,2009,26(6):546-549.
[14]戚孟春,胡静,韩立赤,等.成骨细胞在机械力刺激下细胞骨架及细胞形态改变的体外研究[J].中国口腔领面外科杂志,2004,2(3):181-184.
[15]赵可伟,唐菊英,肖林,等.中药骨康含药血清培养脂肪干细胞移植促进骨质疏松性骨折愈合过程中cbfa1和OCN的表达变化[J].中国骨质疏松杂志,2013,19(6):561-567.
[16]Wang B,Luo YW,Hu NH.Gukang containing serum-induced rat bone marrow stromal cell diffentiation into osteoblasts direction experimental study[J].Chinese Journal of Traumatology,2007,11(1):32-36.
[17]艾江平,谭光宏,余德涛,等.阿仑膦酸钠对机械应力下大鼠成骨细胞骨架修复的影响[J].中国医药,2013,8(5):659-661.
[18]庄洪,邵敏.中药骨康对去势大鼠骨吸收与骨形成影响的实验研究[J].中国中医骨伤科杂志,2002,10(4):26-29.
[19]庄洪,魏合伟,林一峰.中药骨康含药血清中类雌二醇样物质含量的测定[J].中医正骨,2003,15(11):14-16.
[20]李志辉,王兴水,韦玉玲,等.骨康方促进骨质疏松性骨折愈合的机理[J].中医临床研究,2014,6(1):1-2.
(2015-08-20收稿 责任编辑:徐颖)
Preliminary Study on the Protective Effects of Gukang Fang on Microfilaments of Osteoblasts in Rats
Zhang Shujiang1, Li Ying2, Bai Bo1, Chen Yi1
(1TheFirstAffiliatedHospitalofGuangzhouMedicalUniversity,GuangdongKeylaboratoryofOrthopaedicTechnologyandImplantMaterials,Guangzhou510120,China; 2GuangdongIntegratedHospitalofTraditionalChineseMedicineandWesternMedicine,Foshan528200,China)
Objective: To explore the protective and repairing effect of Gukang serum for the F-actin of osteoblasts. Methods: Two groups of New Zealand adult rabbits were fed with Chinese medicine Gukang Fang and estradiol valerate to make the serum containing Gukang and estrogen. The osteoblasts were separated from SD rats and then cultured. The cells were seeded onto cover glasses, and divided into Chinese medicine group and estrogen group, which were cultured with Gukang-containing serum and estrogen-containing serum respectively. Non-drug group(control group) and blank group were also set up. The Chinese medicine group, estrogen group and control group were centrifuged at 240 g and 200 g for 4 min. All the samples were fixed by paraformaldehyde solution and then dyed by FITC-phalloidin. The samples were observed by confocal microscope, and the fluorescence intensities were calculated and compared by one-way ANOVA. Results: The two groups disposed by drug-containing serum showed better fluorescence intensitiy than the control group(P<0.001). At 200 g, Chinese mecicine group presented better than the estrogen group in fluorescence intensity; while at 240 g, estrogen group performed better in fluorescence intensity, and the differences were significant(P<0.001). Conclusion: Gukang-containing serum may protect and repair the microfilaments in osteoblasts of rat when exposed to centrifugal force, yet as the force increases, the protective and repairing effect might be limited.
Medicine; Chinese traditional; Osteoblast; Actins; Stress; Mechanical
广州市科技计划项目创新人才培养计划珠江科技新星专项(编号:2012J2200037);国家自然科学基金项目(编号:81001532);广东省自然科学基金项目(编号:S2014A030313748);广东省科技计划项项目(编号:2013B021800162)
张姝江(1977.02—),女,医学博士,骨外科学讲师,研究方向:骨与软骨的损伤修复及组织工程,E-mail:orthop_zsj@163.com,Tel:(020)83341479
李颖(1979.02—),男,医学博士,骨外科学副主任医师,研究方向:中西医结合骨质疏松治疗,E-mail:leewinly@163.com
R285
A
10.3969/j.issn.1673-7202.2016.01.035

