水中Mn(Ⅱ)对大菱鲆幼鱼生长及碱性磷酸酶和超氧化物歧化酶活性的影响
何忠伟,宫春光,殷 蕊,孙桂清,于 骞,符冬林
( 1. 河北农业大学 海洋学院,河北 秦皇岛 066003; 2. 河北省海洋与水产科学研究院,河北 秦皇岛 066200 )
水中Mn(Ⅱ)对大菱鲆幼鱼生长及碱性磷酸酶和超氧化物歧化酶活性的影响
何忠伟1,宫春光1,殷 蕊2,孙桂清2,于 骞1,符冬林1
( 1. 河北农业大学 海洋学院,河北 秦皇岛 066003; 2. 河北省海洋与水产科学研究院,河北 秦皇岛 066200 )
水温14~16 ℃下,将初始体质量为(5.0±1.0) g的大菱鲆养殖在40 L水体的水族箱中,研究在不同Mn(Ⅱ)质量浓度(0.04、0.08、0.16、0.32、0.64、1.28、2.56、5.12、10.24 mg/L)下大菱鲆的生长及碱性磷酸酶和超氧化物歧化酶的活性。结果表明,当水体中Mn(Ⅱ)质量浓度低于2.56 mg/L时,鱼的生长较快,其中Mn(Ⅱ)质量浓度为0.64 mg/L时生长最快;当Mn(Ⅱ)质量浓度低于0.64 mg/L时,大菱鲆肝脏的碱性磷酸酶和超氧化物歧化酶活性随着Mn(Ⅱ)质量浓度的提高而增加,当Mn(Ⅱ)质量浓度超过0.64 mg/L时,碱性磷酸酶和超氧化物歧化酶的活性急剧下降;0.64 mg/L组的碱性磷酸酶和超氧化物歧化酶的活力均较高,随着Mn(Ⅱ)质量浓度增加,碱性磷酸酶和超氧化物歧化酶的活力先增后减;据剂量效应推测,0.64 mg/L为Mn(Ⅱ)表现出毒性作用的临界质量浓度。
锰;大菱鲆幼鱼;超氧化物歧化酶;碱性磷酸酶
大菱鲆(Scophthalmusmaximus)是我国北方重要的海水养殖鱼类,主要以“地下井水+自然海水”的模式进行养殖,而我国大菱鲆的主要养殖区山东、河北等地的地下水中常含有大量的锰[1],在缺氧的地下水环境中锰通常以二价形式存在,即Mn(Ⅱ)。这些地区养殖的大菱鲆经常出现原因不明的生长缓慢、体质差、易患病、死亡率高等现象,分析可能与养殖用水中含有较多的Mn(Ⅱ)有关。锰广泛地存在于自然界中,是许多种酶的激活剂,对动物骨骼的发育、脂肪代谢以及生殖能力具有重要作用,但水中锰含量过高对水生动物有一定的危害[2]。
碱性磷酸酶是一种包含锌离子和镁离子的非特异性磷酸水解酶,催化磷酸单脂水解及磷酸基团的转移反应,对钙质吸收、骨骼生成、形成甲壳素均具有重要的作用[3]。超氧化物歧化酶在机体中承担维护生物膜的完整性,清除氧自由基、保护细胞免受氧化损伤的作用,而锰是其重要的活性组成部分,其生物功能不能被其他的金属离子所代替[4]。锰缺乏时,此酶的活性降低,抗氧化能力减弱;但当锰过量时,则可抑制超氧化物歧化酶的活性,使其对超氧阴离子的歧化作用减弱而在体内堆积,引起脂质过氧化物增加,使细胞膜结构发生改变,正常的生理功能受损,线粒体肿胀、解体,溶酶体破坏,神经细胞变性、坏死,神经递质代谢障碍。有关锰对超氧化物歧化酶影响的研究主要集中在人和鼠类上,而对水生动物的研究较少。
我国现行的渔业水质标准(GB 11607—1989)[5]和海水养殖用水水质标准(NY 5052—2001)[6]均未对水中锰的含量做出具体限制要求。目前有关水中Mn(Ⅱ)对大菱鲆的毒性作用的研究尚未见报道,Mn(Ⅱ)对大菱鲆生长及免疫力的影响尚不得知。笔者研究了养殖用水中不同含量的Mn(Ⅱ)对大菱鲆幼鱼的生长及碱性磷酸酶与超氧化物歧化酶活性的影响,以评价水中Mn(Ⅱ)对大菱鲆的毒性,寻找其安全用量,为大菱鲆的养殖生产提供参考。
1 材料与方法
1.1 材料与培育
试验用大菱鲆幼鱼初始体质量为 (5.0±1.0) g,购自山海关某大菱鲆养殖场,暂养7 d后开始试验。试验期间,自然光照,水温14~16 ℃,溶解氧7.2~7.8 mg/L,pH 7~7.8,盐度30。每日8:00和17:00投喂适口的大菱鲆饵料(广东东丸海水鱼种苗饲料),18:00时吸底、换水90%。
1.2 试验设计
向水中加入适量的MnCl2,使9个试验组水体中Mn(Ⅱ)质量浓度分别达到0.04、0.08、0.16、0.32、0.64、1.28、2.56、5.12、10.24 mg/L ,设置1个空白对照组。所有试验组均设置了重复。每组20尾鱼,养殖在40 L水体的水族箱中。每日18:00吸底、90%换水1 次。试验持续28 d,试验取样前,各组均停止投喂24 h。
1.3 组织样品的采取与制备
在试验的第7、14、21、28 d,每组随机抽取鱼3尾,用间氨基苯甲酸乙酯甲磺酸盐麻醉后,逐尾测量体质量和体长;取出肝脏用于制作组织匀浆液。先将肝脏在冰冷的生理盐水中漂洗,除去表面的血液,用滤纸擦干,称量质量并记录后,按照1∶9(g/mL)的比例,加入9倍体积的生理盐水,冰水浴条件下手动匀浆,3500 r/min冷冻离心10 min,取上清液(即10%的匀浆上清液),根据所测酶的要求用生理盐水稀释成不同比例的组织匀浆溶液。
试验开始和结束时测各组鱼的体长、体质量及肝质量,测定前24 h停食。计算下列指标:
相对增长率/%=(终末体长-初始体长)/初始体长×100%
质量相对增加率/%=(终末质量-初始质量)/初始质量×100%
肝质量指数/%= 肝质量/体质量×100%
1.4 酶活力检测方法
采用南京建成生物公司提供的检测试剂盒测定碱性磷酸酶和超氧化物歧化酶的活力,参照试剂盒说明书进行操作和计算。
碱性磷酸酶活力以每克组织蛋白在37 ℃与底物作用15 min产生1 mg酚为1个单位(U/g)。超氧化物歧化酶酶活力单位定义为:每毫克组织蛋白在1 mL反应液中抑制超氧化物歧化酶率达50%时,所对应的超氧化物歧化酶量为一个亚硝酸盐单位(NU/mg)。
1.5 数据统计
试验数据用平均值±标准差表示,用SPSS 15.0进行单因素方差分析,并对数据进行Duncan多重比较,取显著性水平为0.05。
2 结 果
试验期间,对照组和Mn(Ⅱ)质量浓度为2.56 mg/L及其以下质量浓度组均未见大菱鲆幼鱼死亡,幼鱼的游泳与摄食也均未出现异常。幼鱼的死亡出现在Mn(Ⅱ)质量浓度 5.12 mg/L组和10.24 mg/L质量浓度组,其中5.12 mg/L质量浓度组的鱼在第8 d摄食开始明显减少,第12 d后几乎不进食;并于第10 d开始试验鱼陆续有死亡,至第21 d该组试验鱼全部死亡; 10.24 mg/L质量浓度组在第1 d时,鱼摄食即明显少于其他质量浓度组,并有鱼死亡,至第14 d时该组试验鱼全部死亡。死亡大菱鲆幼鱼体色先明显变深、随后明显变淡,鳃盖张开,个别死鱼鱼体弯曲。2.56 mg/L及以下质量浓度组中,1.28 mg/L和2.56 mg/L质量浓度组摄食量较其他组略少,但差异不明显,其他质量浓度组摄食正常。
2.1 生长性能
5.12 mg/L质量浓度组和10.24 mg/L质量浓度组的试验鱼在第21 d前已全部死亡,因此,这两组鱼的生长性能数据不具有比较意义,予以剔除。本次试验有关生长性能的比较为2.56 mg/L及其以下质量浓度组。
2.1.1 相对增长率
各质量浓度组大菱鲆幼鱼的相对增长率均高于对照组,且随水中Mn(Ⅱ)质量浓度的增加先升后降。2.56 mg/L质量浓度组与1.28、0.04 mg/L质量浓度组无显著性差异(P>0.05),1.28 mg/L质量浓度组与0.08 mg/L质量浓度组间无显著性差异(P>0.05),其余各组之间均差异显著(P<0.05)(表1)。
2.1.2 质量相对增加率
各质量浓度组大菱鲆幼鱼的相对质量增加率均高于对照组(表1)。当Mn(Ⅱ) 质量浓度由0.04 mg/L增至0.64 mg/L时,大菱鲆幼鱼的相对质量增加率也逐步增加,0.64 mg/L质量浓度组大菱鲆幼鱼的相对质量增加率达到最大值,之后随着Mn(Ⅱ) 质量浓度的继续增加,相对质量增加率急剧下降,但仍高于对照组(P<0.05)。0.04 mg/L质量浓度组大菱鲆幼鱼的相对质量增加率与对照组无显著差异(P>0.05),0.08 mg/L质量浓度组与1.28 mg/L质量浓度组无显著性差异(P>0.05),2.56 mg/L质量浓度组与0.16 mg/L质量浓度组无显著性差异(P>0.05),其余各组之间均差异显著(P<0.05)。
2.1.3 肝质量指数
1.28 mg/L质量浓度组与2.56 mg/L质量浓度组大菱鲆幼鱼的肝质量指数显著低于对照组(P<0.05),但这两组间无显著性差异(P>0.05),其余各组间均差异显著(P<0.05)(表1)。肝质量指数随Mn(Ⅱ)质量浓度的增加先增后减,最大值出现在0.64 mg/L质量浓度组。
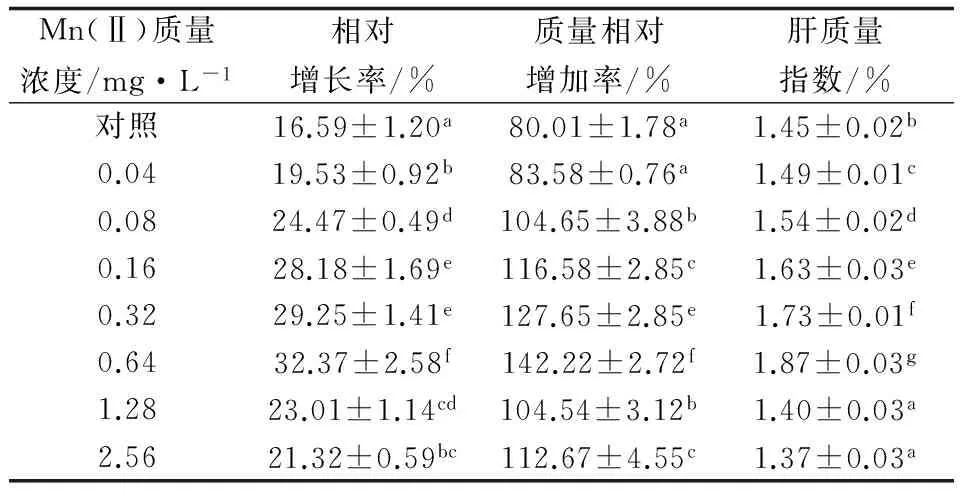
表1 第28 d时各组大菱鲆幼鱼的生长性能
注:同列数据肩标不同字母平均值间差异显著(P<0.05),相同字母的平均值间差异不显著(P>0.05)(下同).
2.2 酶活性指标
2.2.1 碱性磷酸酶活力
处理7 d时,各组间大菱鲆肝脏碱性磷酸酶活力均显著高于对照组(P<0.05)。第14 d时,Mn(Ⅱ) 5.12 mg/L质量浓度组大菱鲆肝脏碱性磷酸酶活力显著低于对照组(P<0.05),2.56 mg/L质量浓度组略高于对照组,但差异不显著(P>0.05),其余各组均显著高于对照组(P<0.05);第21 d时,除2.56 mg/L质量浓度组与对照组无显著差异外(P>0.05),其余各组均显著高于对照组(P<0.05);第28 d时,2.56 mg/L质量浓度组显著低于对照组(P<0.05),0.04 mg/L和1.28 mg/L质量浓度组与对照组无显著性差异(P>0.05),其余各组均显著高于对照组(P<0.05)(表2)。
2.2.2 超氧化物歧化酶活力
处理7 d时,Mn(Ⅱ) 2.56 mg/L质量浓度组大菱鲆肝脏超氧化物歧化酶的活力与对照组无显著性差异(P>0.05),5.12 mg/L和10.24 mg/L质量浓度组显著低于对照组(P<0.05),其余组别均显著高于对照组(P<0.05);第14 d时,各试验组均显著高于对照组(P<0.05);第21 d时,除2.56 mg/L质量浓度组与对照组无显著差异外(P>0.05),其余各试验组均显著高于对照组(P<0.05);第28 d时,2.56 mg/L质量浓度组显著低于对照组(P<0.05),其余各试验组均显著高于对照组(P<0.05)。在每个时间段内,超氧化物歧化酶活性均随着Mn(Ⅱ)质量浓度的增加先增后减(表3)。
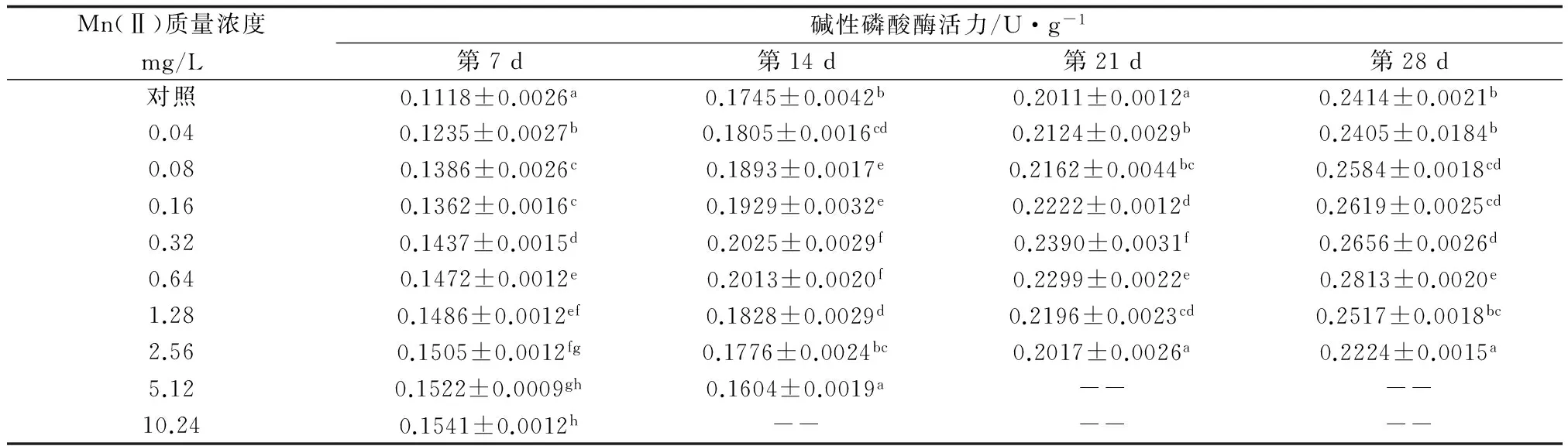
表2 不同处理时间水中Mn(Ⅱ)质量浓度对大菱鲆肝脏碱性磷酸酶活力的影响

表3 不同处理时间水中Mn(Ⅱ)质量浓度对大菱鲆肝脏超氧化物歧化酶活力的影响
3 讨 论
3.1 养殖用水中Mn(Ⅱ)对大菱鲆生长的影响
锰是动物体内重要的微量元素之一,适量的锰是动物正常生长和发育所必需,但过量的锰对动物生长极为不利。有研究表明,饲料中锰含量过高,会影响团头鲂(Megalobramaamblycephala)对铁、锌和铜元素的吸收[7],也会抑制黄颡鱼(Pelteobagrusfulvidraco)的生长[8]。当饲料中锰的添加量大于30 mg/kg时,牙鲆(Paralichthysolivaceus)幼鱼的质量增加率会明显下降[9]。又有研究表明,当水体中Mn(Ⅱ)质量浓度超过49.0 mg/L,仿刺参(Apostichopusjaponicus)幼参的生长会受到影响,同时锰元素会在幼参体内蓄积[10]。
本试验表明,当水体中Mn(Ⅱ)质量浓度低于2.56 mg/L时,大菱鲆生长显著加快,但高于该值时大菱鲆陆续中毒死亡;水体中Mn(Ⅱ)质量浓度高于0.64 mg/L时,大菱鲆的肝脏指数急剧下降,显著低于对照组。本试验持续28 d,水体中Mn(Ⅱ)质量浓度为5.12、10.24 mg/L时大菱鲆幼鱼陆续中毒死去,其他组鱼生长正常。本次饲养时间较短,随着养殖时间的延长,锰还会在大菱鲆幼鱼体内继续富集,长期处于Mn(Ⅱ)质量浓度1.28、2.56 mg/L下的大菱鲆幼鱼在后期的养殖中是否会中毒或死亡还需延长试验时间进行判断;不同规格的大菱鲆对锰的耐受能力不同,各个生长阶段大菱鲆对养殖用水中锰的耐受能力还需进一步研究。
3.2 水中Mn(Ⅱ)对大菱鲆体内碱性磷酸酶、超氧化物歧化酶的影响
碱性磷酸酶和超氧化物歧化酶为代谢或抗氧化过程中的关键酶,常用其活力来研究重金属或其他外源污染物对鱼类的毒性作用,如重金属镉影响鲢鱼(Hypophthalmichthysmolitrix)的超氧化物歧化酶活性[11],以及鲫鱼(Carassiusauratus)的碱性磷酸酶活性[12]。有研究表明,饲料中添加适量的锰显著激活不同生长阶段凡纳滨对虾(Litopenaeusvannamei)的碱性磷酸酶活力[13];海水中锰质量浓度为20 μg/L 和 40 μg/L 时中国明对虾(Fenneropenaeuschinensis)仔虾和日本囊对虾(Marsupenaeusjaponicus)仔虾的碱性磷酸酶活性最高, 但锰质量浓度过高则会抑制其活性[14-15]。
本试验中,养殖用水中Mn(Ⅱ)质量浓度低于0.64 mg/L时,大菱鲆肝脏碱性磷酸酶的活性显著提高;碱性磷酸酶活性随 Mn(Ⅱ)质量浓度的升高呈先升后降的趋势,呈生物对污染反映的最常见形式——明显的抛物线形的剂量—效应曲线。一般认为,抛物线顶点所对应的含量即为该污染物对这种生物毒性的阈值[12]。汞对草鱼(Ctenopharyngodonidella)[16]、镉对鲫鱼[17]以及铁对大菱鲆[18]的碱性磷酸酶活性影响也呈抛物线形的剂量—效应曲线。本次试验中,抛物线顶点所对应的Mn(Ⅱ)质量浓度为0.64 mg/L,即当Mn(Ⅱ)质量浓度超过0.64 mg/L,对大菱鲆有毒性作用。
本试验中,Mn(Ⅱ)对大菱鲆超氧化物歧化酶活力的影响也呈抛物线形的剂量—效应曲线。在处理7、14、21、28 d时,随着水中Mn(Ⅱ)质量浓度增加,大菱鲆超氧化物歧化酶活力均呈现先增后减的趋势,并随着处理时间的延长,各组超氧化物歧化酶活力有所降低并趋于稳定,但仍随Mn(Ⅱ)质量浓度增加呈抛物线形曲线。在各个处理时间段,Mn(Ⅱ) 0.64 mg/L质量浓度组的超氧化物歧化酶活力最高且稳定。根据剂量效应,0.64 mg/L为Mn(Ⅱ)表现出毒性作用的临界质量浓度。在第7 d时,5.12、10.24 mg/L质量浓度组的超氧化物歧化酶活性显著低于对照组,表明水体中锰含量过高抑制了大菱鲆肝脏超氧化物歧化酶的活性,甚至导致鱼体中毒死亡。
综上所述,养殖用水中的Mn(Ⅱ)影响大菱鲆幼鱼的生长及免疫力。当Mn(Ⅱ)质量浓度低于0.64 mg/L时,促进了大菱鲆的生长,维持了高碱性磷酸酶和超氧化物歧化酶活性;而当Mn(Ⅱ)质量浓度高于0.64 mg/L时,则抑制了大菱鲆的生长和碱性磷酸酶、超氧化物歧化酶活性。可以认为,0.64 mg/L是Mn(Ⅱ)对大菱鲆幼鱼的安全质量浓度。
Srivastava等[26]证实了水生动物能够从水体中摄取锰,但摄取的机制尚不清楚。有研究表明,仿刺参会从水中摄取Mn(Ⅷ),并且Mn(Ⅷ)会在仿刺参体内富集[27]。锰在海水中主要以不溶态的Mn(Ⅲ)和Mn(Ⅳ)的氧化物及可溶性的Mn(Ⅱ)存在。有研究表明,通过搅拌、降低pH值、增加光照度,海水中的锰会由四价的颗粒态转化为二价的可溶态;而当水体处于富氧状态时, Mn(Ⅱ)可被氧化成水合二氧化锰并发生沉积[28]。本次试验模仿大菱鲆养殖生产环境,力求与其实际生产相吻合,但在实际生产中有很多影响水体中Mn(Ⅱ)质量浓度的因素,如溶氧量、水交换量等。如果溶解氧含量高,水体中Mn(Ⅱ)质量浓度由二价的可溶态氧化成水合二氧化锰而沉积;水交换量大的水体中Mn(Ⅱ)含量会更高一些,要将Mn(Ⅱ)含量降低到同一水平所需的时间相应会变长。因此,在生产中应根据各大菱鲆养殖场的实际情况,采取有效措施,尽量将水中Mn(Ⅱ)质量浓度降至0.64 mg/L以下,以确保大菱鲆的养殖安全。
[1] 唐文伟,肖耀明,郝西平,等.生物法去除地下水中铁锰的研究进展[J].工业用水与废水,2009,40(6):14-17.
[2] 荆俊杰,谢吉民.微量元素锰污染对人体的危害[J].广东微量元素科学,2008,15(2):6-9.
[3] 陈清西, 陈素丽, 朱凌翔,等. 长毛对虾碱性磷酸酶功能基团的研究[J]. 厦门大学学报:自然科学版,1996, 35(4): 587-591.
[4] 乔丹,刘丹丹,王美娟,等.水生动物铜锌超氧化物歧化酶及其对致病微生物的响应[J].水产科学,2014,33(6):398-402.
[5] 国家环境保护局.GB 11607—1989,渔业水质标准[S].北京:中国标准出版社,1990.
[6] 中华人民共和国农业部.NY 5052—2001,无公害食品海水养殖用水水质[S].北京:中国标准出版社,2001.
[7] 董娇娇.日粮中添加 Mn、Mg对团头鲂生长、体形及鱼体铁、铜、锰、锌含量的影响[D].苏州:苏州大学, 2014.
[8] 蒋蓉.铜、铁、锰、锌对黄颡鱼生长和生理机能的影响[D].苏州:苏州大学, 2006.
[9] 李爱杰,张道波,魏万权,等. 牙鲆营养需要的研究[J]. 饲料工业,2009,30(16):770-774.
[10] 黎奥,刘鹏,姜玉声,等.Mn2+对仿刺参幼体的急性毒性试验[J].水产科学,2014,33(12):770-774.
[11] 赵元凤,吕景才,宋晓阳,等.镉污染对鲢鱼超氧化物歧化酶和过氧化氢酶活性的影响[J].农业生物技术学报,2002,10(3):267-271.
[12] 詹付凤,赵欣平.重金属镉对鲫鱼碱性磷酸酶和酸性磷酸酶活性的影响[J].四川动物,2007,26(3):641-643.
[13] 张艳秋,詹勇,许梓荣.鱼类免疫机制及其影响因子[J].水产养殖,2005, 26(3):1-5.
[14] Chrousos G P, Gold P W. The concepts of stress and stress system disorders. Overview of physical and behavioural homeostasis[J]. JAMA, 1992, 267(9):1244-1252.
[15] Mercier L,Palacios E, Campa-Córdova A I, et al. Metabolic and immune responses in Pacific white leg shrimpLitopenaeusvannameiexposed to a repeated handling stress[J]. Aquaculture, 1996, 258(1/4): 633-640.
[16] 孔祥会,刘占才,郭彦玲,等.汞暴露对草鱼器官组织中碱性磷酸酶活性的影响[J].中国水产科学,2007,14(2):270-274.
[17] Hsieh Y H P, Hsieh Y P. Valences state of iron in the presence of ascrorbic acid and ethylenediaminetetraacetic acid [J].J Agr Foodchem, 1997, 45(4): 1126-1129.
[18] 吴志昊. Fe(Ⅱ)、DO 含量对养殖大菱鲆幼鱼生理学性状影响的研究[D].青岛:中国科学院海洋研究所,2011.
[19] Campa-Córdova A I, Hernández-Saaverdra N Y, De Philippis R, et al. Generation of superoxide anion and SOD activity in haemocytes and muscle of American white shrimp (Litopenaeusvannamei) as a response to β-glucan and sulphated polysaccharide[J]. Fish and Shellfish Immunol, 2002, 12(4):353-366.
[20] Yao C L, Wang A L. Purification and partial characterization of Mn superoxide dismutase from muscle tissue of the shrimpMacrobrachiumnipponense[J]. Aquaculture, 2004, 241(1/4):621-631.
[21] Zhang Q, Li F, Wang B, et al. The mitochondrial manganese superoxide dismutase gene in Chinese shrimpFenneropenaeuschinensis: cloning, distribution and expression[J]. Developmental and Comparative Immunology, 2007, 31(5):429-440.
[22] 王宏伟,曹向可,钱庆增,等.饲料中锰对日本沼虾抗氧化酶活性的影响[J].河北大学学报:自然科学版,2008, 28(3):300-304.
[23] 于晶锋.无角多赛特肉羊与蒙古羊铜、锌、锰、超氧化物歧化酶、羟自由基及细胞免疫动态的比较研究[D].呼和浩特:内蒙古农业大学,2006:15-32.
[24] 郭建林,叶元土,蔡春芳,等.日粮中添加 Fe、Cu、Mn、Zn 对异育银鲫生长及其形体的影响[J].江苏农业学报,2009,25(1):154-159.
[25] 王宏伟,郭立格,赵建华,等.饲料中锰对中华米虾超氧化物歧化酶活性的影响[J].河北大学学报:自然科学版,2006,26(6):649-653.
[26] Srivastava A K, Agrawal S J. Changes induced by manganese in fish testis[J]. Experientia, 1983, 39(11):1309-1310.
[27] 李斌,马元庆,邢红艳,等. Zn2+、Mn7+对刺参幼参的急性毒性及富集作用研究[J]. 浙江海洋学院学报:自然科学版,2014, 33(4):298-303.
[28] 杨桂朋,王玉珏,胡立阁,等.海水中锰的光化学反应研究[J].海洋学报,2007,27(3):69-75.
EffectsofWaterborneMn(Ⅱ)onGrowthandActivitiesofAKPandSODinJuvenileTurbot(Scophthalmusmaximus)
HE Zhongwei1, GONG Chunguang1, YIN Rui2, SUN Guiqing2, YU Qian1, FU Donglin1
( 1.Ocean College, Agricultural University of Hebei, Qinhuangdao 066003, China; 2. Hebei Ocean & Fisheries Science Research Institute, Qinhuangdao 066200, China )
In this study, growth and alkaline phosphatase (AKP), and superoxide dismutase (SOD) activities were studied in juvenile turbotScophthalmusmaximusexposed to 0.04 mg/L, 0.08 mg/L, 0.16 mg/L, 0.32 mg/L, 0.64 mg/L, 1.28 mg/L, 2.56 mg/L, 5.12 mg/L, and 10.24 mg/L waterborne Mn(Ⅱ). The results showed that better growth was observed in the turbot exposed to the waterborne Mn(Ⅱ) concentration of less than 2.56 mg/L, the best growth at 0.64 mg/L waterborne Mn(Ⅱ). The AKP and SOD activities in the liver were shown to be increased with increasing Mn(Ⅱ) concentration, within less than 0.64 mg/L. At higher than 0.64 mg/L in Mn(Ⅱ) concentration, however, AKP and SOD activities were decreased dramatically. During various treatment periods, the maximal AKP and SOD activities were observed in the turbot juveniles exposed to Mn(Ⅱ) concentration of 0.64 mg/L, indicating that 0.64 mg/L was inferred as the critical concentration to exhibit toxic effects according to dose-effect relation. The findings help to assess the toxicity of the water Mn(Ⅱ) to juvenile turbot, and provide the basis for aquaculture water management for Mn(Ⅱ) including determination of safe concentration.
Mn(Ⅱ);Scophthalmusmaximus; AKP; SOD
S965.399
A
1003-1111(2016)04-0364-06
10.16378/j.cnki.1003-1111.2016.04.009
2015-11-16;
2016-03-02.
国家鲆鲽类产业技术体系项目(nycytx-50);河北省科学技术厅项目(12226748,14227111D);河北省教育厅项目(ZD20131062).
何忠伟(1989—),男,硕士研究生;研究方向:水产动物病害防治.E-mail:veryzones@163.com.通讯作者:宫春光(1971—),男,副教授;研究方向:水产动物病害和海水鱼养殖.E-mail:gongcg2005@163.com.

