补喂瘤胃液制备物对羔羊肠道黏膜及血浆中免疫球蛋白含量的影响
吴婷婷 韩 冰 聂彪彪 董伟伟 杨开伦*
(1.新疆农业大学动物科学学院,新疆肉乳用草食动物营养重点实验室,乌鲁木齐830052;2.新疆畜牧科学院生物技术研究中心,新疆维吾尔自治区动物生物技术重点开放实验室,农业部草食家畜遗传育种与繁殖重点实验室,乌鲁木齐830000)
补喂瘤胃液制备物对羔羊肠道黏膜及血浆中免疫球蛋白含量的影响
吴婷婷1韩 冰2聂彪彪1董伟伟1杨开伦1*
(1.新疆农业大学动物科学学院,新疆肉乳用草食动物营养重点实验室,乌鲁木齐830052;2.新疆畜牧科学院生物技术研究中心,新疆维吾尔自治区动物生物技术重点开放实验室,农业部草食家畜遗传育种与繁殖重点实验室,乌鲁木齐830000)
本试验旨在研究补喂瘤胃液制备物对羔羊肠道黏膜和血浆中免疫球蛋白含量的影响,探讨瘤胃液制备物对新生羔羊肠道黏膜免疫及体液免疫的影响。选取50只初生体重接近的新生羔羊为模型动物,随机分为5组,每组10只。试验组羔羊1日龄开始补喂健康成年绵羊瘤胃液制备物[瘤胃液(Ⅰ)、灭菌瘤胃液(Ⅱ)、超声波破碎瘤胃液(Ⅲ)和灭菌超声波破碎瘤胃液(Ⅳ)],对照组羔羊补喂等量生理盐水,每天1次,连续5 d。在24日龄时每组选取3只羔羊屠宰,采集肠道黏膜;在羔羊14和28日龄时颈静脉采血并分离血浆。测定肠道黏膜及血浆中免疫球蛋白含量。结果显示:1)小肠黏膜蛋白质中,各试验组免疫球蛋白A(IgA)、分泌型免疫球蛋白A(SIgA)和免疫球蛋白G(IgG)总量均高于对照组。其中,试验Ⅲ组IgA总量极显著高于对照组(P<0.01),显著高于其他试验组(P<0.05);试验组SIgA和IgG总量与对照组相比无显著差异(P>0.05)。总体来说,免疫球蛋白含量变化趋势为回肠>十二指肠>空肠,试验Ⅲ组免疫球蛋白总量较对照组增加较多。2)血浆中,羔羊28日龄时免疫球蛋白含量均高于14日龄。14日龄时试验各组血浆中IgA含量差异不显著(P>0.05),但28日龄时试验Ⅰ组显著高于对照组(P<0.05),极显著高于其他试验组(P<0.01);试验各组IgG含量在14和28日龄时差异均不显著(P>0.05)。结果表明,给新生羔羊补喂不同处理的瘤胃液制备物均能提高羔羊肠黏膜免疫能力,补喂超声波破碎瘤胃液效果最佳。
瘤胃液制备物;新生羔羊;肠道黏膜;血浆;免疫球蛋白
肠道黏膜免疫系统是机体免疫系统内最大也是最为复杂的部分。对于新生动物来说,肠道黏膜免疫系统的发育很大程度上依赖于微生物的接触[1-3],细菌微生物刺激机体产生大量的淋巴细胞和淋巴组织,促进黏膜免疫系统的正常发育并逐步成熟。动物出生后尽早通过口服接种有益菌(如来自健康动物胃肠道中的微生物制剂)或其成分可调节肠道黏膜免疫,新生动物早期肠道接种细菌后的早期刺激,能促使小肠黏膜免疫系统发育、成熟。早期的研究表明,瘤胃微生物或者瘤胃液接种物对犊牛和羔羊有积极作用,能增加动物体重[4-7],减少腹泻的发生[5-6]和增强瘤胃活力[8]等,但是研究者们未注意到瘤胃液或瘤胃细菌及其组分对新生羔羊、犊牛等机体免疫方面的可能作用。本试验给新生羔羊补喂4种瘤胃液制备物,对羔羊肠道和血浆中免疫球蛋白含量进行测定,探讨瘤胃液及其制备物对新生羔羊小肠黏膜免疫的影响,为成年反刍动物瘤胃微生物是否能作为一种合适的微生物抗原并促进羔羊肠道黏膜免疫系统的发育提供参考。
1 材料与方法
1.1 瘤胃液样品的采集及处理
试验选用安装有永久性瘤胃瘘管的1.5岁中国美利奴羊(新疆型)公羊,饲喂精粗比(干物质基础)为40∶60的饲粮(精料补充料组成为黄玉米64.5%、棉籽粕32%,食盐1%、磷酸氢钙0.5%,预混料2%;粗饲料主要是玉米秸秆)。在饲喂后6 h采集瘤胃液,60目尼龙袋过滤后收集滤液,再将滤液1 100×g,4 ℃离心5 min,除去瘤胃原虫,收集含大量瘤胃细菌的上清液,作为试验用瘤胃液并取一部分用来制备试验所需其他瘤胃液制备物;灭菌瘤胃液参照Muscato等[6]报道方法进行:取部分瘤胃液使用高压蒸汽灭菌锅(121 ℃,30 min)使其灭菌,冷却,用磁力搅拌器搅拌,分装,制成灭菌瘤胃液;超声波破碎瘤胃液参照翟卫爽[9]报道的方法进行:取部分瘤胃液用超声波破碎仪破碎(工作时间4 s,间隔时间2 s,工作次数90次,频率400 W,重复3次),用磁力搅拌器搅拌,分装,制成超声波破碎瘤胃液;取部分超声波破碎瘤胃液使用高压蒸汽灭菌锅(121 ℃,30 min)使其灭菌,冷却,用磁力搅拌器搅拌,分装,制成灭菌超声波破碎瘤胃液。
1.2 试验动物与试验设计
试验在新疆畜牧科学院下属的中澳绵羊繁育中心进行。选取初生体重接近的特克赛尔羔羊作为试验羔羊,随机分成对照组、试验Ⅰ组、试验Ⅱ组、试验Ⅲ组和试验Ⅳ组,共5组,每组10只,分别补喂生理盐水、瘤胃液、灭菌瘤胃液、超声波破碎瘤胃液和灭菌超声波破碎瘤胃液。
每只羔羊在出生后24 h内(哺乳初乳后)根据分组分别补喂瘤胃液制备物和生理盐水,每只羊每天补喂1次,每次5 mL瘤胃液制备物+5 mL煮沸商品牛奶,补喂前先温热样品至37 ℃左右。补喂时人下蹲,用左手大臂辅助夹着羔羊,用左手手掌辅助固定让羔羊颈头部自然抬起,右手拿着奶瓶适当倾斜,把奶瓶的奶头自然含到羔羊嘴中,让羔羊自行吮吸,连续补喂5 d。除补喂瘤胃液制备物外,试验羔羊其他饲养管理按照羊场规定管理方法进行。
1.3 样品采集与处理
1.3.1 血液采集与处理
在羔羊14和28日龄时颈静脉采血5 mL(肝素钠抗凝),4 ℃静置2 h后3 500×g离心15 min,收集上清液,分装于1.5 mL Eppendorf管中,放置-20 ℃冷冻保存。
1.3.2 羔羊屠宰及肠段收集
在24日龄时每个试验组选取3只公羔,用抹脖法放血屠宰,在手术台上保定,使腹部朝上,沿腹线用手术刀划开腹腔,立即分离胃肠道各段,用预冷生理盐水冲洗各腔段除掉残渣,从每段的远端取5 cm长,用液氮冷冻后-70 ℃保存,供测定黏膜中蛋白质、免疫球蛋白含量。
1.4 指标测定
1.4.1 羔羊肠道黏膜中蛋白质、免疫球蛋白A(immunoglobin A,IgA)、分泌型免疫球蛋白A(secretory immunoglobin A,SIgA)和免疫球蛋白G(immunoglobin G,IgG)含量的测定
样品从-70 ℃冰箱取出后,放入-20 ℃冰箱2 h后将样品取出在4 ℃冰箱中缓慢融化,待样品完全融解后将肠段铺展在白瓷盘中,快速从中间剪开,用钝玻片将肠道黏膜刮取到1.5 mL Eppendorf管中,称重,然后按1∶4加入灭菌pH 7.2的0.01 mol/L磷酸盐缓冲液(PBS),混匀,4 ℃下13 800×g离心10 min,取上清液。蛋白质含量用Bradford[10]的方法测定,以牛血清白蛋白为标准蛋白质。用酶联免疫吸附测定法(ELISA)按照厂家使用说明书进行测定肠道黏膜中IgA、SIgA和IgG含量,试剂盒购置于上海华壹生物科技有限公司。
1.4.2 羔羊血浆中IgA和IgG含量的测定
用ELISA按照厂家使用说明书测定羔羊血浆中IgA和IgG含量,试剂盒购置于上海华壹生物科技有限公司。
1.5 数据统计及分析
试验结果均以平均值±标准差(mean±SD)表示。试验数据的统计分析均采用SPSS 16.0中单因素方差分析,用Duncan氏法进行多重比较,以P<0.05和P<0.01分别为差异显著和极显著的标准。
2 结果与分析
2.1 补喂瘤胃液制备物对新生羔羊肠道黏膜免疫球蛋白含量的影响
2.1.1 24日龄羔羊小肠黏膜蛋白质中IgA的含量
补喂瘤胃液制备物对24日龄羔羊小肠黏膜蛋白中IgA的含量见表1。十二指肠中,试验Ⅱ组IgA含量最高,与试验I组、试验Ⅳ组和对照组差异显著(P<0.05),与试验Ⅲ组差异不显著(P>0.05),试验Ⅲ组显著高于试验Ⅰ组(P<0.05);空肠中,试验Ⅲ组IgA含量最高,与试验Ⅰ组、试验Ⅳ组和对照组差异极显著(P<0.01),其他试验各组IgA含量差异不显著(P>0.05);回肠中IgA含量较十二指肠、空肠中都有增加,其中试验Ⅲ组回肠中IgA含量最高,对照组回肠中IgA含量最低,各组IgA含量差异不显著(P>0.05)。总体来看,IgA含量在各肠段中分布趋势为回肠>十二指肠>空肠。试验Ⅲ组IgA总量极显著高于对照组(P<0.01),显著高于其他各组(P<0.05),试验Ⅰ组、试验Ⅱ组和试验Ⅳ组IgA总量比对照组高,但是差异不显著(P>0.05)。
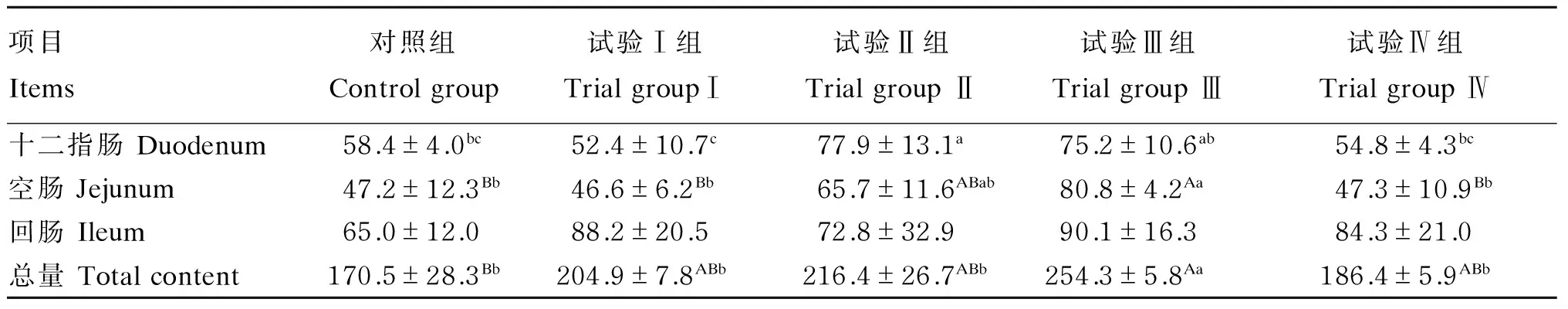
表1 24日龄羔羊小肠黏膜蛋白质中IgA含量
同行数据肩标无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。下表同。
In the same row, values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05), and with different capital letter superscripts mean significant difference (P<0.01). The same as below.
2.1.2 24日龄羔羊小肠黏膜蛋白质中SIgA的含量
补喂瘤胃液制备物对24日龄羔羊小肠黏膜蛋白中SIgA的含量见表2。十二指肠中,试验Ⅲ组中SIgA含量最高,试验Ⅳ组SIgA含量最低,试验Ⅲ组和试验Ⅳ组间差异显著(P<0.05),而其他各组之间差异不显著(P>0.05);空肠中,各组SIgA含量有所不同,其中试验Ⅱ组和试验Ⅲ组含量较高,但各组间差异均不显著(P>0.05);回肠中,试验组SIgA含量均高于对照组,但各组间差异不显著(P<0.05)。总体来看,SIgA含量在各肠段中分布趋势为回肠>十二指肠>空肠,其中试验Ⅰ组和试验Ⅳ组在回肠段增加较多。试验组SIgA总量均比对照组高,但差异不显著(P<0.05),试验Ⅰ组、试验Ⅱ组、试验Ⅲ组和试验Ⅳ组SIgA总量分别比对照组高了7.14%、23.70%、27.60%和14.29%。
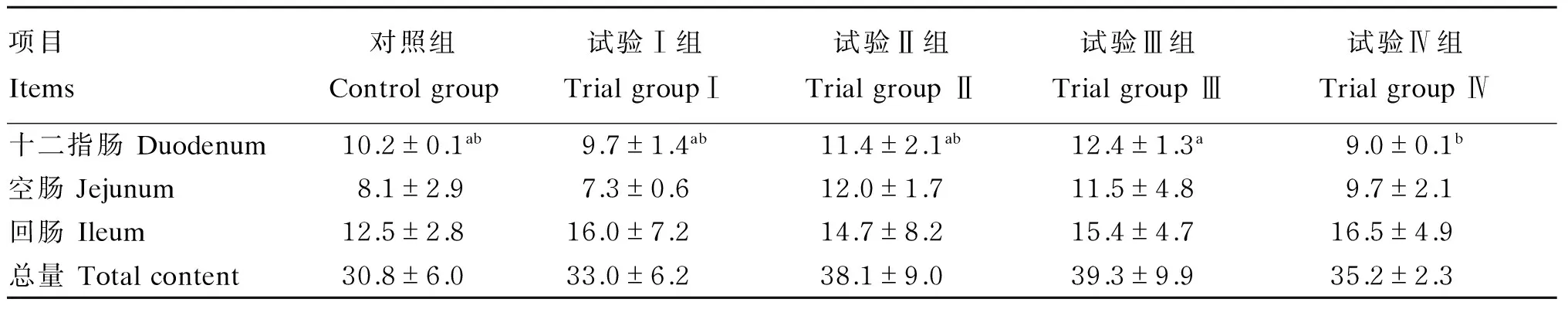
表2 24日龄羔羊小肠黏膜蛋白质中SIgA含量
2.1.3 24日龄羔羊小肠黏膜蛋白质中IgG的含量
补喂瘤胃液制备物对24日龄羔羊小肠黏膜蛋白中IgG的含量见表3。十二指肠中,试验Ⅱ组和试验Ⅲ组IgG含量较高,试验Ⅰ组含量最低,试验Ⅱ组和试验Ⅲ组与试验Ⅰ组含量差异显著(P<0.05),其他各组差异不显著(P>0.05);空肠中,各组IgG含量也有所不同,但差异不显著(P>0.05),试验Ⅰ组仍为最低,试验Ⅲ组最高;回肠中,试验Ⅳ组IgG含量最高,与试验Ⅱ组和对照组差异显著(P<0.05),与其他各组差异不显著(P>0.05)。总体来看,IgG含量在各肠段中分布趋势为回肠>十二指肠>空肠,其中试验Ⅰ组、试验Ⅲ组和试验Ⅳ组在回肠段增加较多。试验Ⅲ组和试验Ⅳ组IgG总量较高,但各组间差异不显著(P>0.05),试验Ⅰ组、试验Ⅱ组、试验Ⅲ组和试验Ⅳ组较对照组IgG总量分别增加了4.74%、23.81%、37.19%和38.66%。

表3 24日龄羔羊小肠黏膜蛋白质中IgG含量
2.2 补喂瘤胃液制备物对新生羔羊血浆中免疫球蛋白含量的影响
补喂瘤胃液制备物对14和28日龄羔羊血浆中IgA和IgG的含量见表4。血浆中IgA和IgG含量在28日龄时均高于14日龄。14日龄时各试验组血浆中IgA含量差异不显著(P>0.05),其中对照组最高,试验Ⅱ组最低;28日龄时试验Ⅰ组中IgA含量最高,与对照组差异显著(P<0.05),与试验Ⅱ组、试验Ⅲ组和试验Ⅳ组差异极显著(P<0.01),其他各组差异不显著(P>0.05)。试验各组血浆中IgG含量在14和28日龄时差异不显著(P>0.05),但试验各组血浆中IgG含量在28日龄时比14日龄时增加。
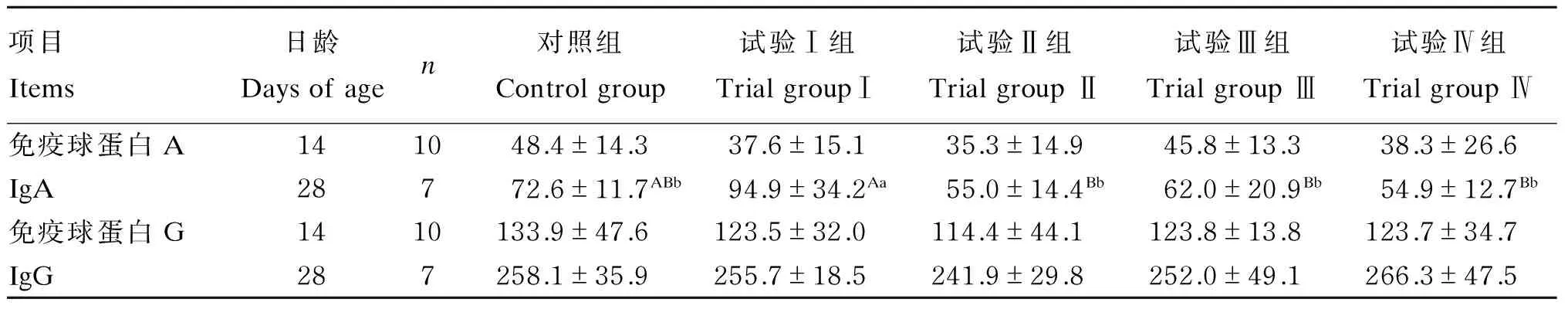
表4 14和28日龄羔羊血浆中IgA和IgG含量
3 讨 论
3.1 补喂瘤胃液制备物对新生羔羊肠道黏膜免疫的影响
Husband[11]和Peterson等[12]研究证实肠黏膜免疫系统中浆细胞产生的抗体主要是IgA,而IgA在浆细胞内合成后,与上皮细胞分泌成分结合,形成SIgA。SIgA是黏膜免疫反应中的重要效应因子,主要由黏膜固有层中的B细胞合成,而IgG则与机体抵抗疾病以及机体对疾病的易感性密切相关。黏膜免疫系统的发育在很大程度上依赖于微生物的接触[1-2]。肠道中共生菌诱导机体产生的固有免疫反应对于黏膜和外周免疫系统的成熟和发育起到了重要性作用[13-14]。微生物暴露对黏膜免疫和肠道上皮细胞的发育的重要性[1-5],能刺激肠相关淋巴组织中分泌更多的IgA+浆细胞等。新生儿和新生动物出生时,肠道是无菌的。在无菌小鼠体内,由于缺乏肠道菌群的刺激,SIgA的分泌量显著降低,但血清中IgA含量只是下降至正常水平的1/2[15],待给小鼠肠道定植一定量的共生菌后,SIgA分泌量升高;在无特定病原体(SPF)级小鼠中,肠道菌群中不含致病菌,肠腔仍然有SIgA的大量分泌,说明肠道共生菌能刺激SIgA的分泌。Perdigón等[16]报道益生菌能增加黏膜IgA含量。Dogi等[17]研究发现,革兰氏阳性(G+)细菌,如乳酸杆菌属(Lactobacillusacidophilus)CRL1462和A9,革兰氏阴性(G-)细菌,如大肠杆菌属(Escherichiacoli)129和13-7,作用于BALB/c小白鼠,能显著增加IgA阳性B细胞的数量;车传燕[18]用人源菌群口服接种到新生SFP仔猪中,细菌定植后使仔猪肠道中IgA和IgG分泌细胞数量增加。
长期以来,研究者大多偏重于对瘤胃微生物营养价值的研究,很少注意到瘤胃液或瘤胃细菌及其组分对新生羔羊、犊牛等机体免疫方面的可能作用。反刍动物瘤胃液中含有种类多样的细菌和微生物,包含着成百种的细菌多聚糖分子[19-20],新生羔羊在出生后24 h内补喂不同处理的成年绵羊瘤胃液制备物,此时小肠的通透性特别高,出生后的几天内肠上皮发育不成熟,具有“开放性”,瘤胃液制备物中含有的细菌作为抗原物质进入仔畜肠道,被肠道吸收,可能改变了肠道内的微生物环境,引起肠道相关淋巴组织中黏膜免疫系统发生相应的变化。本试验中,各试验组肠道黏膜中IgA和SIgA含量均高于对照组,说明瘤胃细菌可能具有“益生菌”作用,能够刺激新生羔羊肠道黏膜免疫的发育和成熟,释放更多的IgA。补喂灭菌瘤胃液组比未灭菌瘤胃液组释放更多的免疫效应分子,这与Muscato等[6]报道的灭菌的瘤胃液对犊牛具有更积极的作用一致,其可能原因一方面是经过灭菌处理后的瘤胃液减少了瘤胃液中有害物质[6],另一方面灭菌处理能使瘤胃液中部分细菌的结构破坏,从而释放出更多的耐热性免疫效应因子(如细菌细胞壁中的肽聚糖、脂多糖等)。尤其是试验Ⅲ组的处理(即超声波破碎瘤胃液)可使细菌细胞壁破裂,其中的肽聚糖、脂多糖和磷壁酸等物质释放出来,而肽聚糖是免疫系统的激活剂,少量肽聚糖对于宿主重要生理功能的维持和促进是非常重要的[21]。
除了IgA,IgG也是反刍动物肠道黏膜免疫的重要效应分子。本试验中,测得IgG是24日龄羔羊肠道黏膜中含量最高的免疫球蛋白,这与Cripps等[22]和Butler[23]测定结果一致,Bouvet[24]研究表明,早期仔畜肠道黏膜中的IgG部分是母体IgG通过乳汁进入仔畜血液,再经仔畜肝脏、胆汁进入肠腔,被吸收而来,部分是由肠道黏膜局部B细胞产生,在自体未合成IgA前发挥免疫保护作用。新生哺乳动物在断奶前的被动黏膜保护依赖于母源二聚体IgA和IgG1的连续供应[25],并在体内起到抗感染的作用。而母乳中的SIgA,进入消化道后不易被破坏,保持其局部免疫性和抗感染能力,但由于肠道黏膜免疫系统发育尚未完全,可能导致肠道中SIgA含量较少。
本试验测得24日龄羔羊小肠黏膜中免疫球蛋白在肠段中的分布趋势为回肠>十二指肠>空肠,免疫球蛋白在各个肠段中分布不同可能与肠道黏膜固有层中浆细胞分布有关,而不同肠段由于接触的微生物抗原的不同也可能刺激肠道黏膜固有层中分泌的浆细胞增加。十二指肠处于小肠前端,最先接触抗原,与外来抗原作用最早,也最直接,免疫反应剧烈,所以十二指肠中免疫球蛋白含量较高,而回肠黏膜和黏膜下层含有丰富的集合淋巴小结,其内B细胞数量较多[26],具有产生浆细胞的巨大潜力,可能也是造成免疫球蛋白在回肠段较多的原因。
通过补喂不同处理的瘤胃液制备物,各试验组羔羊小肠黏膜蛋白中免疫球蛋白含量均高于对照组,这可能是由于补喂的瘤胃液制备物中存在免疫活性物质,刺激肠道黏膜产生更多的免疫效应分子,也可能是由于瘤胃液中存在的部分细菌在肠道定植后,促进羔羊肠道相关淋巴组织的发育和局部体液免疫水平的提高,增强机体免疫力,但瘤胃液中存在的具体的免疫活性物质在本试验中并没有做进一步的分析、研究,这将在以后做进一步研究。而且有关低日龄羔羊的肠道内免疫球蛋白的含量和分布特点目前尚未见报道,这方面的研究尚需深入和积累。
3.2 补喂瘤胃液制备物对新生羔羊血浆中免疫球蛋白含量的影响
IgG是血清中的重要抗体,在体液免疫中发挥关键性作用。IgG能够中和毒素和病毒、凝集颗粒抗原(如细菌、病毒)等,以便于吞噬细胞的吞噬、激活补体,血清中的IgG抗体能够阻止相应抗原穿透黏膜进入组织中[27];IgA分血清型和分泌型2种,血清型多为单体,也有二聚体,分泌型的都是二聚体,且含有分泌片,仅占血清免疫球蛋白总量的10%~15%。羔羊出生后,自身没有抵抗疾病的能力,需要在出生后24 h内从初乳中获得足量的免疫球蛋白来获得被动免疫,随着日龄的增长这种被动免疫机制逐渐减弱,大约在4周龄后自身免疫能力逐渐建立。本试验中,28日龄羔羊血浆中免疫球蛋白含量均高于14日龄,说明随着日龄的增加,羔羊自身免疫机能逐渐增强。
补喂不同处理的瘤胃液制备物对羔羊血浆中IgG含量无显著影响,这可能是由于早期幼畜血浆中IgG仍主要来自于母畜[24],所以各试验组间羔羊血浆中IgG含量差异不大。而在28日龄时各试验组羔羊血浆中IgA含量差异较大,其中补喂瘤胃液组羔羊血浆中IgA含量最高,而补喂灭菌瘤胃液和超声波破碎瘤胃液组羔羊血浆中IgA含量较低,这与肠道黏膜中IgA含量分布不一致。有研究报道表明,当健康机体黏膜或血管腔隙受到免疫刺激时,血清中单体IgA抗体响应,但是这些都不来源于肠道黏膜[28-30]。本试验结果也说明羔羊血浆中IgA含量受到肠道黏膜中IgA的影响较小,而补喂瘤胃液在一定程度上能提高羔羊体液免疫水平,其原因有待进一步研究。
4 结 论
给新生羔羊补喂不同处理的瘤胃液制备物均能提高羔羊小肠黏膜中免疫球蛋白的含量,提高了羔羊肠黏膜免疫能力,其中补喂超声波破碎瘤胃液效果最佳。
[1] BIANCHI A T J,ZWART R J,JEURISSEN S H M,et al.Development of the B- and T-cell compartments in porcine lymphoid organs from birth to adult life:an immunohistological approach[J].Veterinary Immunology and Immunopathology,1992,33(3):201-221.
[3] MACPHERSON A J,HARRIS N L.Interactions between commensal intestinal bacteria and the immune system[J].Nature Reviews Immunology,2004,4(6):478-485.
[4] POUNDEN W D,HIBBS J W.The influence of pasture and rumen inoculation on the establishment of certain microorganisms in the rumen of young dairy calves[J].Journal of Dairy Science,1949,32(12):1025-1031.
[5] JAMES R E,POLAN C E,BIBB T L,et al.Effect of orally administered duodenal fluid on susceptibility of newborn calves to anEscherichiacolichallenge[J].Journal of Dairy Science,1976,59(8):1495-1501.
[6] MUSCATO T V,TEDESCHI L O,RUSSELL J B.The effect of ruminal fluid preparations on the growth and health of newborn,milk-fed dairy calves[J].Journal of Dairy Science,2002,85(3):648-656.
[7] ABO-DONIA F M,IBRAHIM G S,NADI S,et al.Effect of inoculating new born lambs with fresh or lyophilized rumen fluid on rumen activity and lamb performance[J].Journal of American Science,2011,7(9):409-422.
[8] ZHONG R Z,SUN H X,LI G D,et al.Effects of inoculation with rumen fluid on nutrient digestibility,growth performance and rumen fermentation of early weaned lambs[J].Livestock Science,2014,162:154-158.
[9] 翟卫爽.不同精粗比日粮时绵羊瘤胃液细菌、原虫内与葡萄糖代谢相关酶活力的比较研究[D].硕士学位论文.乌鲁木齐:新疆农业大学,2014:16-17.
[10] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1/2):248-254.
[11] HUSBAND A J.Kinetics of extravasation and redistribution of IgA-specific antibody- containing cells in the intestine[J].Journal of Immunology,1982,128(3):1355-1359.
[12] PETERSON D A,MCNULTY N P,GURUGE J L,et al.IgA response to symbiotic bacteria as a mediator of gut homeostasis[J].Cell Host & Microbe,2007,2(5):328-339.
[13] MACPHERSON A J,MARTINIC M M,HARRIS N.The functions of mucosal T cells in containing the indigenous commensal flora of the intestine[J].Cellular and Molecular Life Sciences,2002,59(12):2088-2096.
[14] ARTIS D.Epithelial-cell recognition of commensal bacteria and maintenance of immune homeostasis in the gut[J].Nature Reviews Immunology,2008,8(6):411-420.
[15] CRBRA J J.Influences of microbiota on intestinal immune system development[J].The American Journal of Clinical Nutrition,1999,69(5):1046S-1051S.
[17] DOGI C A,GALDEANO C M,PERDIGN G.Gut immune stimulation by non pathogenic Gram(+) and Gram(-) bacteria.Comparison with a probiotic strain[J].Cytokine,2008,41(3):223-231.
[18] 车传燕.人源菌群仔猪模型的建立及其胃肠道黏膜免疫的研究[D].博士学位论文.南京:南京农业大学,2009.
[19] COSTERTON J W,DAMGAARD H N,CHENG K J.Cell envelope morphology of rumen bacteria[J].Journal of Bacteriology,1974,118(3):1132-1143.
[20] KRAUSE D O,RESSELL J B.How many ruminal bacteria are there?[J].Journal of Dairy Science,1996,79(8):1467-1475.
[22] CRIPPS A W,HUSBAND A J,LASCELLS A K.The origin of immunoglobulins in intestinal secretion of sheep[J].Australian Journal of Experimental Biology and Medical Science,1974,52(4):711-716.
[23] BUTLER J E.Bovine immunoglobulins:an augmented review[J].Veterinary Immunology and Immunopathology,1983,4(1/2):43-152.
[24] BOUVET J P,FISCHETTI V A.Diversity of antibody-mediated immunity at the mucosal barrier[J].Infection and Immunity,1999,67(6):2687-2691.
[26] MACPHERSON A J,GATTO D,SAINSBURY E,et al.A primitive T cell-independent mechanism of intestinal mucosal IgA responses to commensal bacteria[J].Science,2000,288(5474):2222-2226.
[27] BRANDTZAEG P,TOLO K.Mucosal penetrability enhanced by serum-derived antibodies[J].Nature,1977,266(5599):262-263.
[28] LA BROOY J T,DAVIDSON G P,SHEAMAN D J C,et al.The antibody response to bacterial gastroenteritis in serum and secretions[J].Clinical and Experimental Immunology,1980,41(2):290-296.
[29] BARTHOLOMEUSZ R C,FORREST B D,LABROOY J T,et al.The serum polymeric IgA antibody response to typhoid vaccination; its relationship to the intestinal IgA response[J].Immunology,1990,69(2):190-194.
[30] BROWN W R,KLOPPEL T M.The liver and IgA:immunological,cell biological and clinical implications[J].Hepatology,1989,9(5):763-784.
*Corresponding author, professor, E-mail: yangkailun2002@aliyun.com
(责任编辑 王智航)
Effects of Oral Administration of Ruminal Fluid Preparations on Immunoglobulin Contents in Intestinal Mucosa and Plasma of Lambs
WU Tingting1HAN Bing2NIE Biaobiao1DONG Weiwei1YANG Kailun1*
(1.XinjiangKeyLaboratoryofMeat&MilkProductionHerbivoreNutrition,XinjiangAgricultureUniversity,Urumqi830052,China; 2.KeyLaboratoryofAnimalBiotechnologyofXinjiang,KeyLaboratoryofGenetics,BreedingandReproductionofGrass-FeedingAnimal,MinistryofAgriculture,BiotechnologicalResearchCenter,XinjiangAcademyofAnimalScience,Urumqi830000,China)
This experiment aimed to study the effects of oral administration of ruminal fluid preparations on immunoglobulin contents in the intestinal mucosa and plasma of lambs, to explore the effects of ruminal fluid preparations on intestinal mucosal and humoral immunity of neonatal lambs. Fifty newborn lambs with similar birth weight as model animal were divided into 5 groups with 10 lambs per group. Lambs in trial groups were fed different preparations of ruminal fluid [ruminal fluid (Ⅰ), autoclaved ruminal fluid (Ⅱ), ultrasonic processing ruminal fluid (Ⅲ) and autoclaved ultrasonic processing ruminal fluid (Ⅳ)] from healthy adult sheep since 1 day of age once a day over a period of 5 days, and those in control group were given the same volume of sterile saline. Three lambs per group were slaughtered to obtain small intestinal tissues on 24 days of age; plasma was collected at 14 and 28 days of age, respectively. Immunoglobulin contents in intestinal mucosa and plasma were determined. The results showed as follows: 1) in intestinal mucosal protein, the contents of immunoglobulin (IgA), secretory immunoglobin A (SIgA) and immunoglobulin G (IgG) in all trial groups were higher than those in control group. The total content of IgA in trial group Ⅲ was significantly higher than that in control group (P<0.01), as well as significantly higher than that in the other trial groups (P<0.05); there were no significant differences of the total contents of SIgA and IgG among groups (P>0.05). In generally, the contents of immunoglobulins showed ileum>duodenum>jejunum, and compared with control group, the total contents of immunoglobulins in trial group Ⅲ were greatly increased. 2) In plasma, immunoglobulin contents at 28 days of age were higher than those at 14 days of age. There was no significant difference of IgA content among groups at 14 days of age (P>0.05), however, at 28 days of age, the content of IgA in trial group Ⅰ was significantly increased compared with control group (P<0.05), and was significantly increased compared with the other trial groups (P<0.01); there was no significant difference of the content of IgG among groups at 14 and 28 days of age (P>0.05). In conclusion, orally administered different ruminal fluid preparations can improve intestinal mucosal immunity of newborn lambs, and ultrasonic processing ruminal fluid shows better effects than the other preparations.[ChineseJournalofAnimalNutrition, 2016, 28(12):3811-3818]
ruminal fluid preparation; newborn lamb; intestinal mucosa; plasma; immunoglobulin
10.3969/j.issn.1006-267x.2016.12.013
2016-06-28
国家自然科学基金(31172233)
吴婷婷(1987—),女,重庆人,博士研究生,研究方向为动物营养与饲料科学。E-mail: 717557802@qq.com
*通信作者:杨开伦,教授,博士生导师,E-mail: yangkailun2002@aliyun.com
S826
A
1006-267X(2016)12-3811-08

