不同产区加工的茯砖茶中“金花”菌的分离及分子鉴定
赵仁亮,吴丹,姜依何,朱旗*
(1.湖南农业大学茶学教育部重点实验室,湖南 长沙 410128;2.国家植物功能成分利用工程技术研究中心,湖南 长沙 410128)
不同产区加工的茯砖茶中“金花”菌的分离及分子鉴定
赵仁亮1,2,吴丹1,2,姜依何1,2,朱旗1,2*
(1.湖南农业大学茶学教育部重点实验室,湖南 长沙 410128;2.国家植物功能成分利用工程技术研究中心,湖南 长沙 410128)
为探明不同地域茯砖茶中“金花”菌的异同,采用陕西、湖南和浙江3个产区同等级的黑毛茶为原料,分别在本地及其他2个产区同一时期加工成9个茯砖茶样,运用纯培养技术,观察茶样中“金花”菌在不同培养基上的形态特征,同时结合现代分子生物学技术,对茶样中的“金花”菌进行了鉴定。结果表明:从9个茯砖茶样品中,分离获得了13株“金花”菌,在不同培养基中的形态学特征与散囊菌属的特征非常相近,且菌株G9、G10的形态特征与其他“金花”菌明显不同;通过对特异性区段ITS和β–tubulin序列扩增、测序,经同源序列搜索比对及构建的系统发育树进一步分析,并参照Hubka最新的曲霉属分类系统,最终将不同地域(陕、湘、浙)加工的茯砖茶中的优势菌鉴定为冠突曲霉,异名冠突散囊菌;浙江产区加工的茯砖茶中分离获得的非优势“金花”菌G9和G10鉴定为谢瓦曲霉。
茯砖茶;“金花”菌;分子鉴定;分类
投稿网址:http://xb.ijournal.cn
茯砖茶是采用黑毛茶为原料再加工的一种紧压型黑茶,其中“发花”是其关键工序,对其独特的品质及卓越的健康功效形成具有重要的作用。茯砖茶的“发花”实质是一个以冠突散囊菌为主体的固态发酵过程,优势菌的存在对茯砖茶独特的风味品质形成具有重要影响。近年来国内外的学者曾做了大量研究[1–8],分别以发花过程的在制品、成品茶,不同季节、不同产区自然发酵的茯砖茶为研究对象,运用形态学及分子生物学技术,研究发现茯砖茶中的优势微生物除了冠突散囊菌之外,还有阿姆斯特丹、谢瓦、蜡叶等其他散囊菌。茯砖茶的自然发酵相比于人工接种冠突散囊菌的发酵,它们之间优势微生物的种群组成可能存在一定的差异,因此,产酶能力及分泌的次生代谢产物也可能存在一定的区别。本研究以不同地域同期交叉制作的茯砖茶样为研究对象,通过形态观察及多基因系统发育分析,对不同地域的“金花”菌进行了鉴定,以期探明不同地域茯砖茶品质的差异。
1 材料与方法
1.1 材料
1.1.1 供试茯砖茶样
采用陕西、湖南和浙江产区同等级的黑毛茶为原料,同一时期分别在本地及其他2个产区压制成茯砖茶样。具体茯砖茶样品信息见表1。

表1 供试茯砖茶样Table 1 The lists of Fuzhuan tea samples
1.1.2 培养基
分离、纯化培养基为PDA培养基。鉴定培养基为察氏培养基(CZ),配方为3 g NaNO3,1 g K2HPO4,0.5 g MgSO4,0.5 g KCl,0.01 g FeSO4,30 g蔗糖,20 g琼脂,定容至1 000 mL。20%察氏培养基(CZ20),除蔗糖为200 g外,其余成分同CZ培养基。察氏酵母琼脂培养基(CYA),除酵母粉为5 g外,其余成分同CZ培养基。麦芽汁琼脂培养基(MEA),成分为麦芽膏粉130 g、琼脂20 g、定容至1 000 mL。40%蔗糖麦芽汁酵母琼脂培养基(M40Y),除蔗糖为400 g,酵母粉5 g外,其余成分同麦芽汁琼脂培养基。
1.1.3 试剂
DNA提取试剂盒、琼脂糖凝胶回收试剂盒购买自天根生化科技(北京)有限公司;200 bp DNA Ladder、Taq酶、dNTP购买自生工生物工程(上海)股份有限公司。参照White等[9]的方法,合成真菌rDNA ITS序列通用引物ITS1:5'–TCCGTAGGTGA ACCTGCGG–3'和ITS4:5'–TCCTCCGCTTATTGA TATGC–3';参照Glass等[10]的方法,合成真菌β–微管蛋白基因间隔区通用引物Bt2a:5'–GGTAACC AAATCGGTGCTGCTTTC–3'和Bt2b:5'–ACCCTC AGTGTAGTGACCCTTGGC–3'。引物均由生工生物工程(上海)股份有限公司合成。其他生化试剂均为国产,分析纯。
1.1.4 仪器与设备
超净工作台(SW–CJ–2D型,苏净集团);恒温恒湿培养箱(SPX,江苏环保仪器厂);高温灭菌锅(TXQ.DY–220,上海医用核子仪器厂);恒温干燥箱(DHG–9076A型,上海精宏实验设备公司);电子天平(Mettler AE240,梅特勒-托利多仪器有限公司);PCR扩增仪(Biomrtra,德国);微型旋涡混合仪(WH–3,上海);高速冷冻离心机(MLKR022B,德国);稳压稳流电泳仪(DYY–Ⅲ,北京)及凝胶自动成像系统(Gene Genius,英国)等。
1.2 方法
1.2.1 “金花”菌的分离与纯化
分别取供试茯砖茶样25 g,运用纯培养分离纯化技术,依据菌落大小、质地、颜色等形态学特征初步分离,经过多次纯化,得到纯种菌株。4 ℃保存。
研究开发微藻生物能源特别是生物柴油和生物油替代传统石油燃料用于交通运输,具有广阔的前景。微藻生物能源的经济性受到现有技术水平和传统化石燃料价格双重影响,大规模工业化应用的发展受到限制。综上可知,微藻生物能源发展的首要阻碍是藻种的选育,藻种的特性影响着后续的多个重要环节如培养、油脂提取和转化等。规模化培养是获得生物质的关键,目前存在的问题仍是如何实现光能的高效利用,解决油脂积累和生物量积累不匹配问题。生物能源产品多样,生产工艺仍需进一步优化以降低成本。未来,微藻生物能源的研究应集中在以下四个方面:
1.2.2 “金花”菌的形态观察
将供试茶样中分离、纯化得到的 “金花”菌常温下复苏24 h,分别转接于上述5种培养基中,25 ℃避光培养7 d,每天观察菌落的生长情况并作好记录,对照《中国真菌志》彩图和文字描述进行初步判断。
1.2.3 “金花”菌的分子鉴定
1) “金花”菌基因组DNA的提取。分别称取2.0 g冰冻菌丝,置于预先放于冰盒上的无菌研钵中,加少许石英砂,快速研碎成粉,用植物基因组试剂盒(天根)提取总DNA。
2) “金花”菌基因扩增及测序。分别采用通用引物ITS1和ITS4、Bt2a和Bt2b扩增“金花”菌的ITS区、β–微管蛋白基因序列。25 μL反应体系:2.5 μL 10×Taq Buffer, 2.5 μL dNTP (2 mmol/L),2.4 μL引物,2 μL Mg2+(25 mmol/L),模板2 μL DNA,0.1 μLTaq酶(5 U/μL),13.5 μL ddH2O。扩增程序为94 ℃预变性3 min,94 ℃变性50 s,53 ℃复性1 min,72 ℃延伸2 min,35个循环,最后72 ℃延伸10 min。扩增成功的PCR产物,用琼脂糖凝胶回收试剂盒回收,由生工生物工程(上海)股份有限公司进行测序。
1.2.4 序列比对及系统发育树构建
2 结果与分析
2.1 从供试茯砖茶样中分离获得的“金花”菌
依据“金花”菌的大小、质地、颜色等形态特征,从9个供试茯砖茶样中初步分离获得13株“金花”菌,其中从陕西产区加工的茯砖茶(FBT 1、FBT 2、FBT 3)中分离获得3株(G1、G2、G3);从湖南产区加工的茯砖茶(FBT 4、FBT 5、FBT 6)中分离获得4株(G4、G5、G6、G7),从浙江产区加工的茯砖茶(FBT 7、FBT 8、FBT 9)中分离获得6株(G8、G9、G10、G11、G12、G13),结果如图1所示。
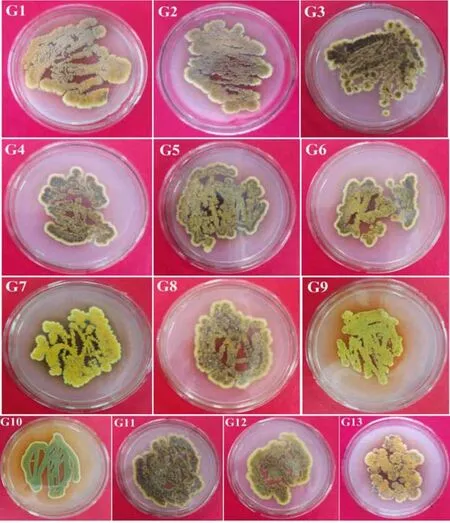
图1 从供试茯砖茶中分离、纯化的“金花”菌Fig.1 The “golden flora” fungi isolated and purified from Fu brick tea produced in different regions
2.2 13株“金花”菌在不同培养基上的形态特征
从由陕西产区加工的茯砖茶中分离的“金花”菌株G1、G2和G3,在CZ培养基上生长缓慢,直径11~14 mm,边缘呈白色至淡黄色,中央呈淡黄褐色,背面呈淡黄色至黄褐色,菌落稀疏、平伏(图2–G1–A、图2–G2–A、图2–G3–A);在CZ20培养基上生长慢,直径15~19 mm,菌落平展、疏松,背面呈淡黄色至黄色(图2–G1–B、图2–G2–B、图2–G3–B);在CYA培养基上生长略快,直径19~27 mm,边缘呈白色至淡黄色,中央呈黑褐色,闭囊壳大量、黄色,背面呈淡黄色至黄褐色,菌落致密(图2–G1–C、图2–G2–C、图2–G3–C);在MEA培养基上生长较快,直径48~65 mm,边缘呈白色至淡黄色,中央呈黄褐色至深褐色,闭囊壳大量、黄色,背面呈黄色至黄褐色,菌落致密(图2–G1–D、图2–G2–D、图2–G3–D);在M40Y培养基上生长极为迅速,其中菌株G1和G2直径为75~85 mm,几乎长满平板,边缘呈白色至淡黄色,中央呈淡黄褐色,气生菌丝发达,闭囊壳大量、黄色,背面呈橙黄色,色素扩散于培养基中(图2–G1–E、图2–G2–E、图2–G3–E)。
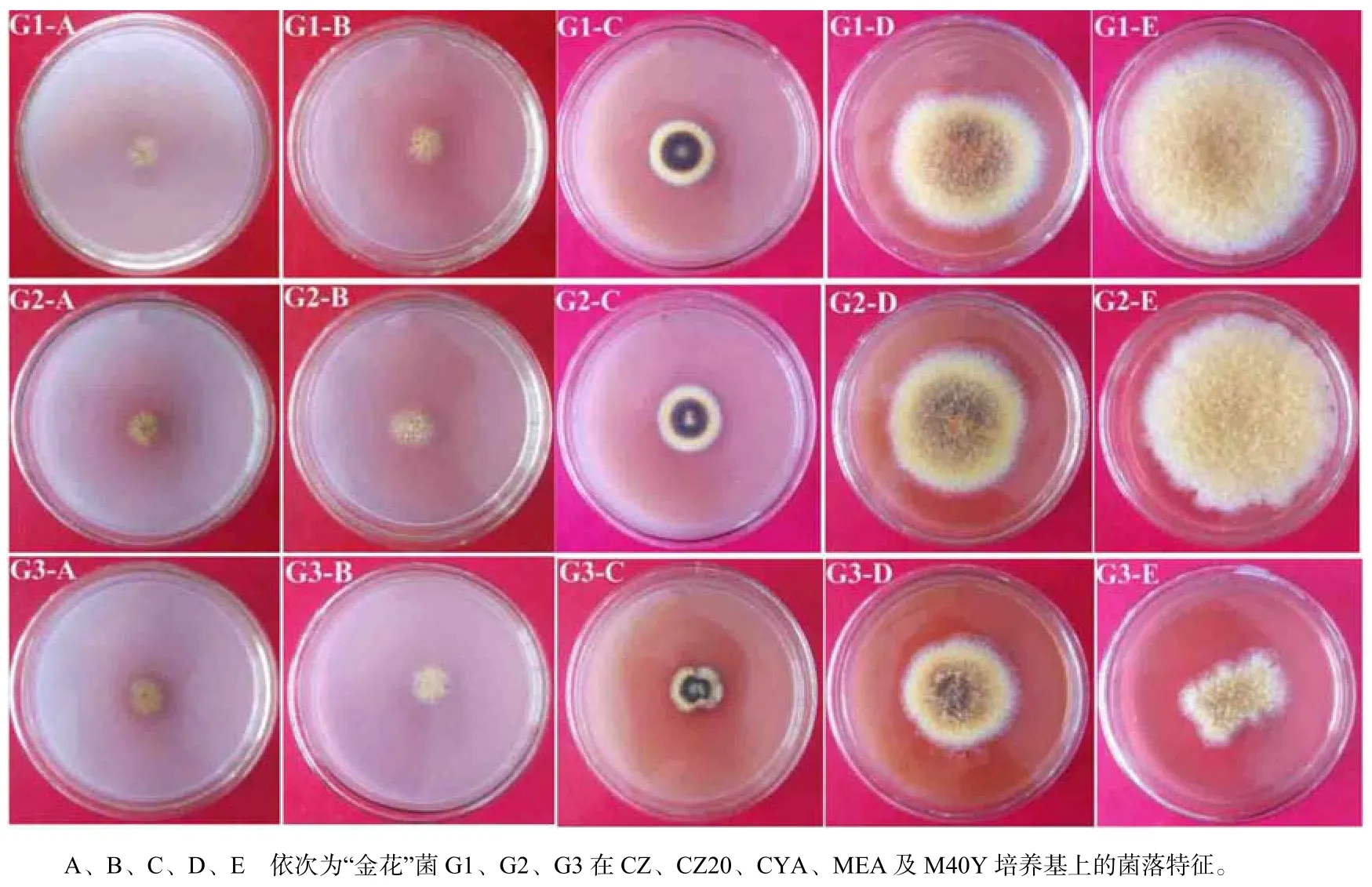
图2 从陕西产区加工的茯砖茶中分离的“金花”菌在不同培养基上的形态特征Fig.2 The morphological characteristics of “golden flora” fungi isolated from FBT produced in Shanxi region on different culture media
从湖南产区加工的茯砖茶中分离的“金花”菌株G4、G5和G6,在CZ培养基上生长缓慢,直径14~18 mm,菌落稀疏、平薄,淡黄色至橄榄褐色,背面呈淡黄至黄褐色,闭囊壳少量,少量色素扩散于培养基中(图3–G4–A、图3–G5–A、图3–G6–A);在CZ20培养上生长慢,直径16~25 mm,淡黄至蜜黄色,背面呈黄色至黄褐色,闭囊壳少量、黄色,菌落稀疏、平展(图3–G4–B、图3–G5–B、图3–G6–B);在CYA培养基上生长略快,直径26~28 mm,边缘呈白色至淡黄色,中央呈黑褐色,闭囊壳大量,背面呈淡黄至黄褐色,菌落致密(图3–G4–C、图3–G5–C、图3–G6–C);在MEA培养基上生长较快,直径36~49 mm,边缘呈白色至橙黄色,中央呈橄榄褐色,闭囊壳大量,背面呈淡黄至深褐色,菌落致密,色素扩散于培养基中,其中菌株G6有辐射状沟纹(图3–G4–D、图3–G5–D、图3–G6–D);在M40Y培养基上生长迅速,其中菌株G5和G6直径达65~67 mm,菌株G4略小,菌落直径36~38 mm;边缘呈白色至黄色,中央呈淡黄色至淡黄褐色,闭囊壳大量,气生菌丝发达,背面呈淡黄至黄褐色(图3–G4–E、图3–G5–E、图3–G6–E)。
从湖南产区加工的茯砖茶中分离的“金花”菌株G7在不同培养基上的形态与G4、G5和G6略有不同。G7在CZ培养基上生长缓慢,直径约11 mm,边缘呈黄色,中央呈黄褐色,菌落稀疏、平而薄,背面呈黄褐色,少量色素扩散于培养基中(图3–G7–A);G7在CZ20培养基上生长慢,直径15~16 mm,黄色至橙黄色,菌落稀疏,闭囊壳大量,背面呈黄褐色(图3–G7–B);G7在CYA培养基上生长缓慢,直径10~12 mm,橙黄色至黄褐色,菌落致密,中央隆起,背面呈黄褐色(图3–G7–C);G7在 MEA培养基上生长快,直径29~30 mm,边缘黄色至橙黄色,中央呈橄榄褐色,背面呈黄褐色,少量色素扩散于培养基中(图3–G7–D);G7在M40Y培养基上生长较快,直径29~36 mm,形状不规则,淡黄色至黄褐色,气生菌丝发达,闭囊壳大量,背面呈橙黄色(图3–G7–E)。

图3 从湖南产区加工的茯砖茶中分离的“金花”菌在不同培养基上的形态特征Fig.3 The morphological characteristics of “golden flora” fungiisolated from FBT produced in Hunan region on different culture media
从浙江产区加工的茯砖茶中分离的“金花”菌株G8、G11和G12,在CZ培养基上生长缓慢,直径7~18 mm,边缘呈淡黄色,中央呈黄褐色,菌落稀疏、平伏,闭囊壳少量,背面呈淡黄色(图4–G8–A、图4–G11–A、图4–G12–A);在CZ20培养基上生长略快,直径26~31 mm,黄色至淡黄褐色,闭囊壳大量,背面呈黄色至淡黄褐色,菌落致密(图4–G8–B、图4–G11–B、图4–G12–B);在CYA培养基上生长略快,直径22~32 mm,边缘呈白色至黄色,中央呈黄褐色至黑褐色,背面呈淡黄色至黄褐色,菌落致密(图4–G8–C、图4–G11–C、图4–G12–C);在MEA培养基上生长较快,直径45~68 mm,边缘呈白色至黄色,中央呈橙黄至橄榄褐色,闭囊壳大量,背面边缘呈淡黄色,中央黄褐色(图4–G8–D、图4–G11–D、图4–G12–D);在M40Y培养基上生长快,菌株G8和G11直径37~40 mm,菌株G12生长迅速,菌落直径50~58 mm,形状不规则,边缘呈白色至黄色,中央呈淡黄褐色,气生菌丝发达,背面呈橙黄色至橙红色(图4–G8–E、图4–G11–E、图4–G12–E)。
从浙江产区加工的茯砖茶中分离的“金花”菌株G9,在CZ培养基上生长缓慢,直径约16 mm,菌落平展,黄绿色,分生孢子及闭囊壳大量,背面呈黄色(图4–G9–A);G9在CZ20培养基上生长慢,直径约28 mm,菌落平坦,黄绿色,分生孢子及闭囊壳大量,背面呈黄绿色(图4–G9–B);在CYA培养基上生长慢,直径22~23 mm,菌落致密,鹅黄色,有皱褶,背面呈橙红色,有辐射状沟纹(图 4–G9–C);在MEA培养基上生长缓慢,直径15~16 mm,菌落致密,中央隆起,黄绿色, 背面呈绣红色,有辐射状沟纹(图4–G9–D);在M40Y培养基上生长较快,直径32~38 mm,形状不规则,大量气生菌丝,边缘呈灰绿色,中央有大量闭囊壳,背面深黄,兼带灰绿色(图4–G9–E)。

图4 从浙江产区加工的茯砖茶中分离的“金花”菌在不同培养基上的形态特征Fig.4 The morphological characteristics of “golden flora” fungiisolated from FBT produced in Zhejiang region on different culture media
从浙江产区加工的茯砖茶中分离的“金花”菌株G10在CZ培养基上生长慢,直径约19 mm,边缘呈淡黄色至黄色,中央呈淡黄褐色,菌落平伏,背面呈淡黄褐色(图4–G10–A);G10在CZ20培养基上生长快,直径约38 mm,边缘呈淡黄色,中央呈黄色至黄绿色,分生孢子结构和闭囊壳大量,背面呈黄褐至深褐色(图4–G10–B);G10在CYA培养基上生长慢,直径约21 mm,边缘呈淡黄色,中央呈土黄至深黄色,闭囊壳大量,菌落致密,背面呈黄褐色(图4–G10–C);G10在MEA培养基上生长快,直径31~32 mm,边缘呈绿色,中央呈黄绿色,菌落平伏,分生孢子结构和闭囊壳大量;背面呈砖红色,有辐射状沟纹(图4–G10–D);G10在M40Y培养基上生长迅速,直径57~59 mm,近圆形,黄绿色,分生孢子结构和闭囊壳大量,气生菌丝发达;背面呈橙黄色,兼带灰绿色(图4–G10–E)。
从浙江产区加工的茯砖茶中分离的“金花”菌株G13在CZ培养基上生长缓慢,直径约5 mm,淡黄色,菌落稀疏,闭囊壳少量,背面呈黄褐色(图4–G13–A);在CZ20培养基上生长慢,直径20~22 mm,黄色,菌落稀疏,闭囊壳少量,背面呈淡黄色(图4–G13–B);在CYA培养基上生长稍快,直径22~23 mm,边缘呈白色至黄色,中央呈橄榄褐色,平伏,背面呈黄褐色,色素扩散于培养基中(图4–G13–C);在MEA培养基上生长快,直径约26~31 mm,边缘呈淡黄色,中央呈橄榄褐色,气生菌丝发达,背面呈黄褐色,色素扩散于培养基中(图4–G13–D);在M40Y上生长快,直径35~38 mm,边缘呈白色,中央呈淡黄色,气生菌丝发达,背面呈淡黄色(图4–G13–E)。
对照《中国真菌志》,13株“金花”菌在不同培养基上的形态特征与中散囊菌属最为相近,且Ⅰ类菌株G1、G2、G3、G4、G5、G6、G8、G11和G12形态特征极为相近,可能为散囊菌属中的1个种;Ⅱ类菌株G7、G13与Ⅰ类菌株形态特征接近,但又不完全相同,是否与Ⅰ类同种,需要进一步研究;Ⅲ类菌株G9、G10与Ⅰ、Ⅱ类形态特征明显不同,可能为散囊菌属中的另外1个种。
2.2 供试茯砖茶中“金花”菌的分子鉴定及系统发育树构建
2.2.1 基于rDNA–ITS序列的系统发育分析
经过双向测序、拼接,最终获得菌株G1–G13的ITS共13条系列,分别提交至GenBank进行Blast同源序列搜索比对,下载与待鉴定菌株序列同源性达99%以上的已知分类地位的模式菌株,一起构建NJ系统发育树。由图5可知,与13株“金花”菌同源性最高的已知分类地位的菌株为散囊菌属和曲霉属。依据最新国际命名法规,散囊菌属已归入曲霉属曲霉组,是1个单系的类群[11],因此,由构建的整个系统发育树分析,从茯砖茶样中分离获得的13株“金花”菌均属于曲霉属曲霉组,即散囊菌属。但基于目前的研究[12–13],ITS区序列在该属种的分类鉴定上缺乏足够的分辨率,不能有效区分曲霉属曲霉组(散囊菌属)下的种类,因此,必须通过测定其他基因位点,与ITS分析结果对照,再结合形态特征,才能最终鉴定曲霉属曲霉组(散囊菌属)下的种类。

图5 13株“金花”菌基于ITS基因序列构建的NJ系统发育树Fig.5 The NJ tree based on ITS gene of 13 strains of “golden flora” fungi
2.2.2 基于β–Tubulin基因序列的系统发育分析
同样经过双向测序、拼接,最终获得菌株G1至G13的β–tubulin共13条系列,分别提交至GenBank进行Blast同源序列搜索比对,与菌株G1、G2、G3、G4、G5、G6、G7、G8、G11、G12和G13同源性较高的模式菌株仅有Eurotium sp. FZ(ACCESSION NO. HQ148162.1)和Aspergillus cristatus NRRL 4222(ACCESSION NO. EF651914.1),相似度分别为100%和99%。
与菌株G9、G10同源性在99%以上的模式菌株中,均属于Aspergillus chevalieri,且与其中的模式菌株Aspergillus chevalieri PRK9a (ACCESSION NO. KU872182.1)的相似度为100%,序列比对结果如图6、图7。
由图6、图7可知,与Ⅰ、Ⅱ类菌株高度同源的模式菌株Eurotium sp. FZ(ACCESSION NO. HQ148162.1),是Xu等[4]提交到GenBank数据的,最终鉴定该模式菌株是冠突散囊菌。高度同源的另一模式菌株Aspergillus cristatus NRRL 4222 (ACCESSION NO. EF651914.1),根据最新的分类系统,两模式菌株是属同一种。与Ⅲ类菌株G9、G10高度同源的模式菌株均属于Aspergillus chevalieri。综合形态特征及ITS和菌株的β–tubulin同源序列比对,G1、G2、G3、G4、G5、G6、G7、G8、G11、G12和G13最终鉴定为冠突曲霉(A. cristatus),异名冠突散囊菌(E. cristatus);菌株G9、G10最终鉴定为谢瓦曲霉(A. chevalieri)。

图6 Ⅰ、Ⅱ类菌株与模式菌株Eurotium sp. FZ BenA序列比较Fig.6 The BenA sequence of Ⅰ, Ⅱ strains comparison with model strains Eurotium sp. FZ

图7 Ⅲ类菌株与模式菌株Aspergillus chevali eri strain PRK9a BenA序列比较Fig.7 The BenA sequence of Ⅲstrain comparison with model strains Aspergillus chevalieri strain PRK9a
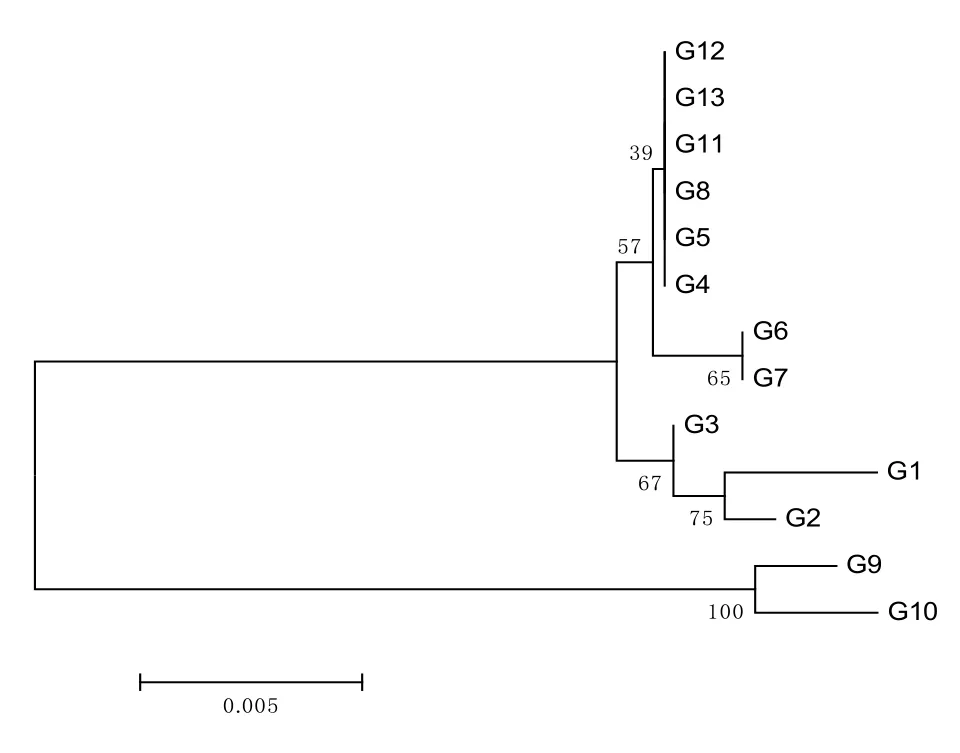
图8 13株“金花”菌基于β–tubulin基因序列构建的NJ系统发育树Fig.8 The NJ tree based on β–tubulin sequence data of 13 strains of “golden flora” fungi
由图8可知,Ⅰ、Ⅱ类菌株与Ⅲ类菌株聚为2个大的分支,再次验证了它分别是曲霉属曲霉组中的2个种。另外从陕西产区茯砖茶中分离的菌株G1、G2和G3与从湖南、浙江产区茯砖茶中分离的菌株G4、G5、G6、G7、G8、G11、G12、G13虽然最终鉴定为同种,但却聚在2个分支上。探究3个产区茯砖茶的起源与演变:一是浙江茯砖茶工艺技术传承于湖南茯砖茶,且制作茶样的两企业生产茯砖茶的历史均超过了30年,而陕西虽然是茯茶之源,但其间中断生产近60年,直至2009年才恢复生产,制作茶样的企业实际生产茯砖茶的历史并不长;二是茯砖茶生产地湖南安化和浙江武义气候相似,但与陕西泾阳差别较大。综合分析,由于受地域和环境的影响,冠突曲霉(异名冠突散囊菌)在遗传上可能呈现出了多样性。
3 讨论与小结
“金花”菌是茯砖茶品质形成的关键优势菌种,研究不同地域茯砖茶品质形成机理,“金花”菌种名的鉴定是首要解决的问题。然而,真菌的鉴定异常复杂,过去主要依靠形态学进行分类,但部分真菌的形态特征会随着环境发生一定变化,此方法并不稳定可靠。随着现代分子生物学技术的发展,核酸序列分析已被广泛地应用到真菌分类鉴定中,其中,rDNA的ITS区段因具有易扩增、稳定性高、长度短等优点,已经成为众多学者研究真菌分类鉴定及群体遗传多样性时普遍使用的一种分子标记方法。基于散囊菌属内物种高度的同源性,Peterson等[12]和Hubka等[13]均证实了ITS序列不能有效区分该属内下的种类。β–微管蛋白是微管的组成成分之一,广泛分布于真核生物中,其基因内转录间隔区受外界环境因素的影响较小,进化速度很快,因而可以提供较丰富的信息位点和变异位点,已经广泛应用于菌株的分类鉴定及生物种间的系统发育。
在本研究中,通过在不同培养基上的形态特征,结合ITS和β–tubulin基因序列同源性比较及系统发育分析,最终得出以下结论:第一,单纯地通过形态学及ITS区来鉴定曲霉属曲霉组(散囊菌属)下的物种,可能会得出错误的鉴定结果;第二,部分来源不同的“金花”菌尽管最终被鉴定为同种,但在不同的培养基中其形态特征还是存在一定差别,且以BenA基因序列构建的系统发育树聚在了不同的分支上,因而推测冠突曲霉(异名冠突散囊菌)可能存在亚型,在遗传上呈现多样性,需要采用其他技术进一步研究;第三,不同产区茯砖茶中的“金花”菌存在着种类多样性,除冠突曲霉外,还有谢瓦曲霉存在,这与王文涛等[5]、胡志远等[1]、刘石泉[14]的研究结论是一致的。
[1] 胡治远,赵运林,刘素纯,等.不同品种茯砖茶中优势微生物的分离鉴定[J].江西农业学报,2011,23(12):60–64.DOI:10.3969/j.issn.1001–8581.2011.12.018.
[2] 胡治远,刘素纯,赵运林,等.茯砖茶生产过程中微生物动态变化及优势菌鉴定[J].食品科学,2012,33(19):244–248.
[3] 赵仁亮.茯砖茶加工中微生物演变及对品质形成影响的研究[D].长沙:湖南农业大学,2012.
[4] Xu A,Wang Y,Wen J,et al.Fungal community associated with fermentation and storage of Fuzhuan brick-tea[J]. International Journal of Food Microbiology, 2011,146(1):14–22.DOI:10.1016/j.ijfoodmicro.2011.01. 024.
[5] 王文涛,赵运林,杨海君,等.基于形态学与ITS序列对冠突散囊菌多样性研究[J].中国农学通报,2014,30(24):310–315.DOI:10.11924/j.issn.1000–6850.2014–0364.
[6] 王晗,王永,纪燕玲,等.分离自黑茶的散囊菌属真菌中的NRPS基因的检测和分布[J].微生物学通报,2013,40(3):464–475.DOI:10.13344/j.microbiol.china. 2013.03.006.
[7] 阮林浩,卢秦华,谭吉慧,等.茯砖茶发花过程中冠突散囊菌的变化及差异性初报[J].食品安全质量检测学报,2015,6(4):1271–1278.
[8] 王磊,谭国慧,潘清灵,等.黑茶砖茶中两种产生“金花”的曲霉菌[J].菌物学报,2015,34(2):186–195.DOI:10.13346/j.mycosystema.130275.
[9] White T J,Bruns T,Lee S,et al.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M].NewYork:Academic Press,1990:315–322.DOI:10.1016/B978–0–12–372180–8.50042–1.
[10] Glass N L,Donaldson G C.Development of primer sets designed for use with the PCR to amplify conserved genes from filamentous ascomycetes [J].Applied & Environmental Microbiology,1995,61(4):1323–1330.
[11] Peterson S W.Phylogenetic analysis of Aspergillus species using DNA sequences from four loci [J]. Mycologia,2008,100(2):205–226.DOI:10.3852/ mycologia.100.2.205.
[12] Peterson S W.Aspergillus and Penicillium identification using DNA sequences:barcode or MLST? [J].Applied Microbiology &Biotechnology,2012,95(2):339–344. DOI:10.1007/s00253–012–4165–2.
[13] Hubka V,Kolarík M,Kubátová A,et al.Taxonomic revision of Eurotium and transfer of species to Aspergillus[J].Mycologia,2013,105(4):912–937.DOI:10.3852/12–151.
[14] 刘石泉.茯砖茶金花菌及其相关微生物多样性研究[D].长沙:湖南农业大学,2014.
责任编辑:尹小红
英文编辑:梁 和
Isolation and molecular identification of “Jinhua” fungi on the Fuzhuan tea produced in different regions
Zhao Renliang1,2, Wu Dan1,2, Jiang Yihe1,2, Zhu Qi1,2*
(1.Key laboratory of Education Ministry for Tea Science, Hunan Agricultural University, Changsha 410128, China; 2.National Research Center of Engineering Technology for Utilization of Botanical Functional Ingredients, Changsha 410128, China)
In order to study the differences of the “Jinhua” fungi from the fuzhuan tea (FZT)produced in different regions, 9 FZT samples, which were processed with the same standard of raw dark teas from Shanxi, Hunan, Zhejiang at the same season, were used as materials. The “Jinhua” fungi obtained from the FZT samples were cultured with different mediums. The species of the tested fungi were identified by the morphology of colony observed with microscope and DNA sequencing. The results revealed that 13 strains of “Jinhua” fungi were obtained from the 9 FZT samples. All the fungi had similar morphological characteristics to the Eurotium sp., while the strains of G9 and G10 were obviously different from the other “golden flora” fungi. By amplifying and sequencing the specific segments sequences of the ITS and β–tubulinand, comparing the homology sequence, analyzing phylogenetic trees, and referring to Hubka’s latest classification system of Aspergillus, the dominant fungi obtained from the FZT produced in different regions were identified as A. cristatus and the non-dominant fungi strains of G9, G10 were identified as A. chevalieri.
Fuzhuan tea; “Jinhua” fungi; molecular identification; taxonomy
TS272.5+4
A
1007-1032(2016)06-0592-09
2016–08–30
2016–10–15
国家自然科学基金项目(31571802);湖南省教育厅重点项目(14A066)
赵仁亮(1983—),男,河南周口人,博士研究生,主要从事茶叶加工及功能成分研究,584194216@qq.com;*通信作者,朱旗,教授,主要从事茶叶加工及功能成分研究,1965994459@qq.com

