百药煎质量标准研究
肖芳,黄勤挽,易佳佳
·炮制制剂·
百药煎质量标准研究
肖芳,黄勤挽*,易佳佳
目的:建立百药煎的质量标准。方法:以没食子酸为对照品进行百药煎的薄层鉴别; 采用HPLC法测定百药煎中没食子酸的含量。对百药煎水分、总灰分、酸不溶性灰分、黄曲霉毒素及显微特征进行检测。结果:百药煎的显微特征性强;薄层色谱分离度好,斑点清晰。根据7批百药煎样品测定结果,建议百药煎水分不得超过11.0%,总灰分不得超过4.0%,酸不溶性灰分不得超过1.0%;没食子酸的进样量在0.24~0.64 μg(r=0.9999)其峰面积积分值与进样量有良好的线性关系,平均回收率为99.43%,RSD为0.79%,没食子酸含量不得低于33.0%。结论:所建方法操作简单,准确可靠,可用于评价百药煎的质量。
百药煎;质量标准;薄层鉴别;含量测定;没食子酸
百药煎为五倍子、茶叶、酒糟经发酵而制成的干燥曲块,每五倍子100 kg,用茶叶6.2 kg,酒糟25 kg[1]。因其具有清热化痰,生津止渴等功效,临床上可用于肺热咳嗽,风火牙痛,口舌糜烂,久痢脱肛。方中要药五倍子主要成分为可水解鞣质,水解后的产物主要为没食子酸[2],因此通过测定没食子酸的含量,可以建立一种百药煎的含量控制方法。目前百药煎在《浙江省炮制规范》2005版有收载,但尚未见其质量标准研究的相关文献报道。为控制百药煎质量,确保其临床用药的安全有效,本实验对百药煎的显微特征、薄层鉴别、检查( 水分、总灰分、酸不溶性灰分、黄曲霉毒素) 及没食子酸含量测定进行研究,旨在为系统评价百药煎质量提供科学依据。
1 材料
1.1 仪器
岛津LC-20A高效液相色谱仪(二元梯度泵、柱温箱、PDA检测器、自动进样器、Labsolution工作站);Alltech 426高效液相色谱仪;岛津RF-20A荧光检测器;PriboFast柱后衍生仪;四合一酶联免疫亲和柱(北京泰乐祺科技有限公司)。BSA224S分析天平(德国Sartorius系列); SRIX-4-13箱式电阻炉(北京中兴仪器伟业有限公司);UPH-I-10T优普超纯水器(成都超纯科技有限公司);ZF-90多功能暗箱式紫外透射仪(上海宝山顾村电光仪器厂),LeicaDM2000生物显微镜(Leica Microsystems CMSGmbH)。
1.2 试药与样品
没食子酸对照品,(批号:110831-201204),由中国食品药品检定研究院提供,五倍子对照药材,(批号:121078-200402),由中国药品生物制品检定所提供。色谱级甲醇,水为超纯水;盐酸,磷酸,甲醇等试剂均为分析纯。8批百药煎样品,经过成都中医药大学标本中心卢先明教授鉴定,7批为五倍子、茶叶、酒糟经发酵而制成的干燥曲块,其中一批为缺五倍子阴性样品。详见表1。
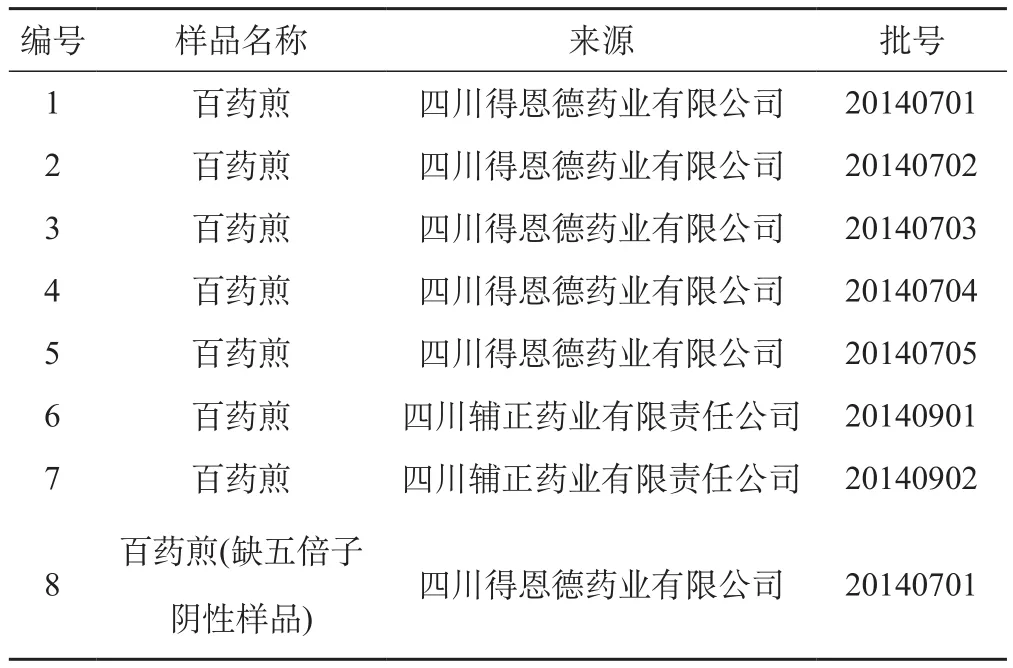
表1 百药煎样品来源表
2 方法与结果
2.1 显微鉴别
粉末淡灰褐色,非腺毛长70~140 μm,有时长达350 μm。薄壁细胞类圆形,内含淀粉粒,淀粉粒多糊化。见图1、2。
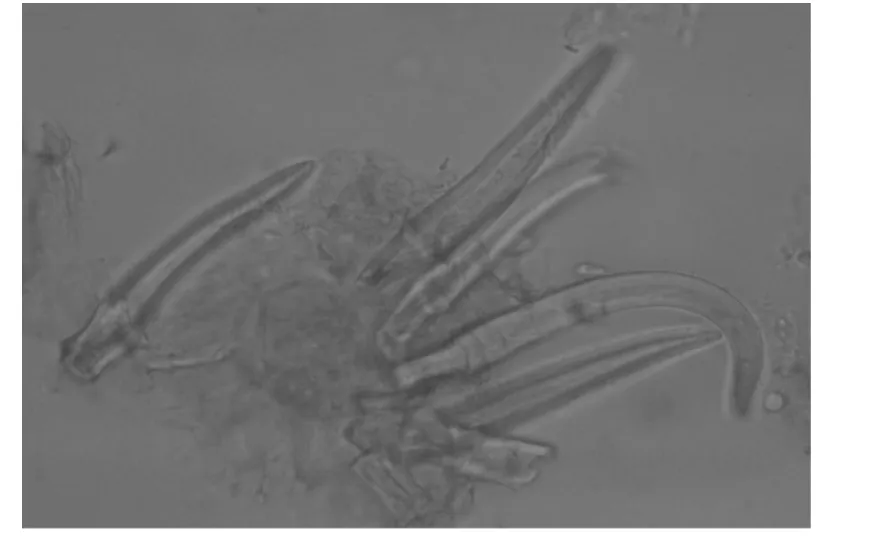
图1
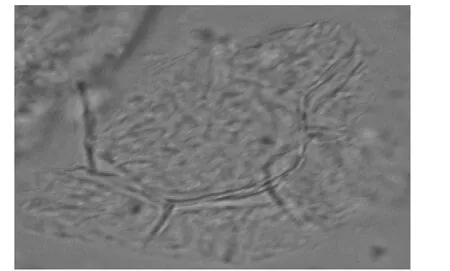
图2
2.2 TLC 鉴别
2.2.1 供试品溶液、对照药材溶液和对照品溶液的制备 取百药煎样品粉末0.5 g,加甲醇5 mL,超声处理15 min,滤过,滤液作为供试品溶液。另取五倍子对照药材0.5 g,同法制成对照药材溶液。再取没食子酸对照品,加甲醇制成每1 mL含1 mg的溶液,作为对照品溶液。
2.2.2 TLC试验 照薄层色谱法(《中国药典》2010年版一部附录ⅥB)试验,吸取供试品溶液、对照药材溶液和对照品溶液各2 µL,分别点于同一硅胶GF254薄层板上,以三氯甲烷-甲酸乙酯-甲酸(5:5:1)为展开剂,展开,取出,晾干,置紫外光灯(254 nm)下检视。供试品色谱中,在与对照药材和对照品色谱相应的位置上,显相同颜色的斑点。本方法分离效果好,斑点清晰,重复性好。见图3。
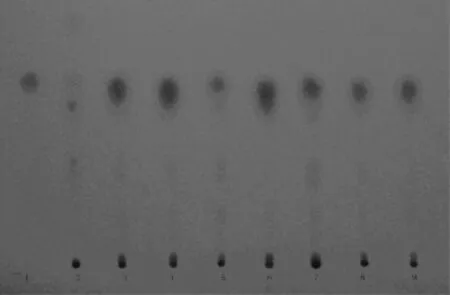
图3 百药煎样品TLC1.没食子酸对照品 2.五倍子对照药材3~9.分别为7批百药煎样品(详见表1)
2.3 水分、总灰分和酸不溶性灰分检查
水分、总灰分和酸不溶性灰分测定分别参考《中国药典》2010版一部附录ⅨH 水分测定法第一法、ⅨK 灰分测定法,结果见表2。根据测定结果,建议规定百药煎水分不得超过11.0%,总灰分不得超过4.0%,酸不溶性灰分不得超过1.0%。
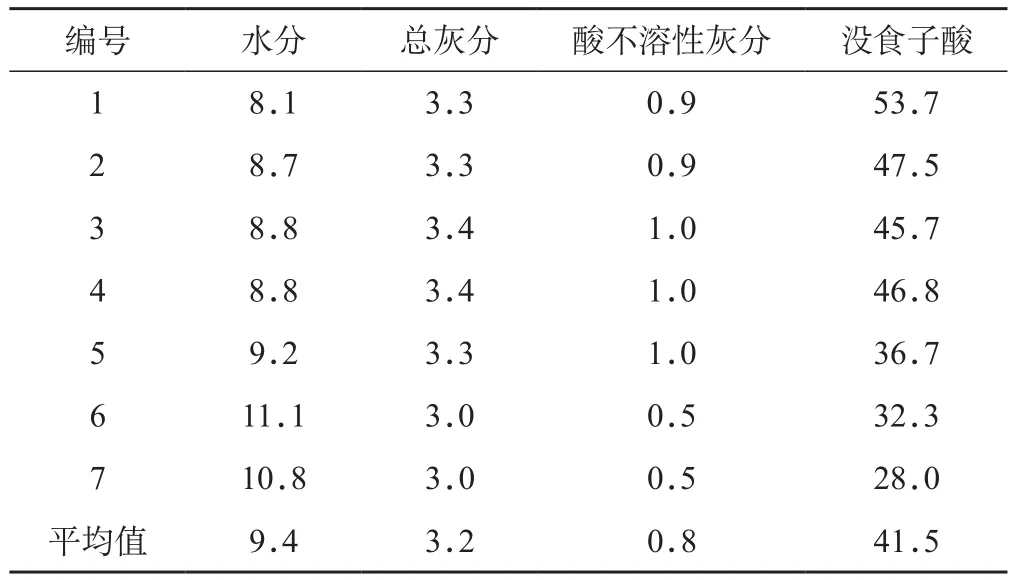
表2 百药煎样品水分、总灰分、酸不溶性灰分及没食子酸含量测定结果 %
2.4 黄曲霉毒素检查
2.4.1 色谱条件与系统适用性试验 以十八烷基硅烷键合硅胶为填充剂,以甲醇-乙腈-水(30∶10∶60)为流动相;采用光化学衍生法:光化学衍生器(254 nm);以荧光检测器检测,激发波长λex=360 nm,发射波长λem=450 nm。两个相邻色谱峰的分离度应大于1.5。结果见图4。
2.4.2 混合对照品溶液的制备 精密量取黄曲霉毒素混合标准品(黄曲霉毒素B1、黄曲霉毒素B2、黄曲霉毒素G1和黄曲霉毒素G2标示浓度分别为1.0 μg.mL-1、0.3 μg.mL-1、1.0 μg.mL-1、0.3 μg.mL-1)1 mL,置10 mL量瓶中,用甲醇稀释至刻度,作为储备液。精密量取储备液1 mL,置100 mL量瓶中,用甲醇稀释至刻度,既得。
2.4.3 供试品溶液制备 取百药煎样品粉末约15 g(过二号筛),精密称定,加入氯化钠3 g,置于均质瓶中,精密加入70%的甲醇溶液75 mL,高速搅拌2 min(搅拌速度大于11000 r.min-1),离心5 min(离心转速2500 r.min-1),精密量取上清液15 mL,置50 mL量瓶中,用水稀释至刻度,摇匀,用微孔滤膜(0.45 μm)滤过,量取续滤液20 mL,通过免疫亲和柱,流速每分钟3 mL,反复2次,用水20 mL洗脱,洗脱液弃去,使空气进入柱子,将水挤出柱子,再用适量甲醇洗脱,收集洗脱液,置2 mL量瓶中,并用甲醇稀释至刻度,摇匀,即得。
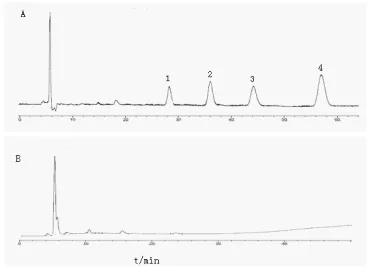
图4 百药煎中黄曲霉毒素HPLCA.黄曲霉毒素混合对照品;B.百药煎样品;1.黄曲霉毒素G2;2.黄曲霉毒素G1;3.黄曲霉毒素B2;4.黄曲霉毒素B1
2.4.4 测定法 分别吸取上述混合对照溶液5,10,15,20,25 μL,注入液相色谱仪,测定峰面积,以峰面积为纵坐标,进样量为横坐标,绘制标准曲线。另精密吸取上述供试品溶液20~25 μL,注入液相色谱仪,测定峰面积,从标准曲线上读出供试品中相当于黄曲霉毒素B1、黄曲霉毒素B2、黄曲霉毒素G1和黄曲霉毒素G2的量,计算,即得。
2.4.5 黄曲霉毒素含量测定 取各百药煎样品粉末,按“2.5.3”项下方法制备供试品溶液,按“2.5.1”项下色谱条件以及“2.4.4”项下供试品溶液测定法测定,根据测定结果,建议规定百药煎中不得检出黄曲霉毒素B1、黄曲霉毒素B2、黄曲霉毒素G1、黄曲霉毒素G2。
2.5 含量测定
2.5.1 色谱条件 以十八烷基硅烷键合硅胶为填充剂;以甲醇-0.1%磷酸溶液(15:85)为流动相;流速: 1.0 mL.min-1; 检测波长: 273 nm; 进样量: 10 μL; 柱温: 25℃。理论板数按没食子酸峰计算应不低于3000,结果见图5。
图5 百药煎中没食子酸HPLCA.没食子酸对照品;B.百药煎样品;C.缺阴性对照溶液;1.没食子酸
2.5.2 对照品溶液的制备及线性关系考察 精密称取没食子酸对照品适量,加50%甲醇制成每1 mL含40 µg的溶液,即得没食子酸对照品溶液。精密吸取没食子酸对照品溶液(40 μg.mL-1)6,8,10,12,14,16 μL,在上述色谱条件下,依次进样,以没食子酸浓度(X)为横坐标,色谱峰面积积分值(Y)为纵坐标,绘制标准曲线,并计算线性回归方程为y=5000000x-6601.1,R=0.9999,结果表明没食子酸在0.24~0.64 μg范围内,其峰面积与进样量有良好的线性关系。
2.5.3 供试品溶液的制备 取百药煎样品粉末(过四号筛)约0.5 g,精密称定,精密加入4 mol.L-1盐酸溶液50mL,水浴中加热水解3.5 h ,放冷,滤过。精密量取续滤液1 mL,置100 mL量瓶中,加50%甲醇至刻度,摇匀,即得。
2.5.4 精密度试验 取40 μg.mL-1的没食子酸对照品溶液连续进6次,测定峰面积,结果峰面积值的RSD为0.22%。结果表明仪器的精密度良好。
2.5.5 重复性试验 取6份同一批次样品(批号:20140701)各约0.5 g,精密称定,按“2.5.3”项下方法制备供试品溶液,结果测得没食子酸含量的RSD为3.2%。结果表明方法的重复性良好。
2.5.6 加样回收率试验 称取已知含量的样品(批号:20140701)约0.25 g,精密称定,共6份。分别加入没食子酸对照品溶液(2.5 mg.mL-1)10 mL,依次测定,计算含量,并计算回收率,没食子酸平均回收率为99.43%,RSD为0.79%。结果表明该方法回收率良好,符合HPLC 含量测定要求,见表3。
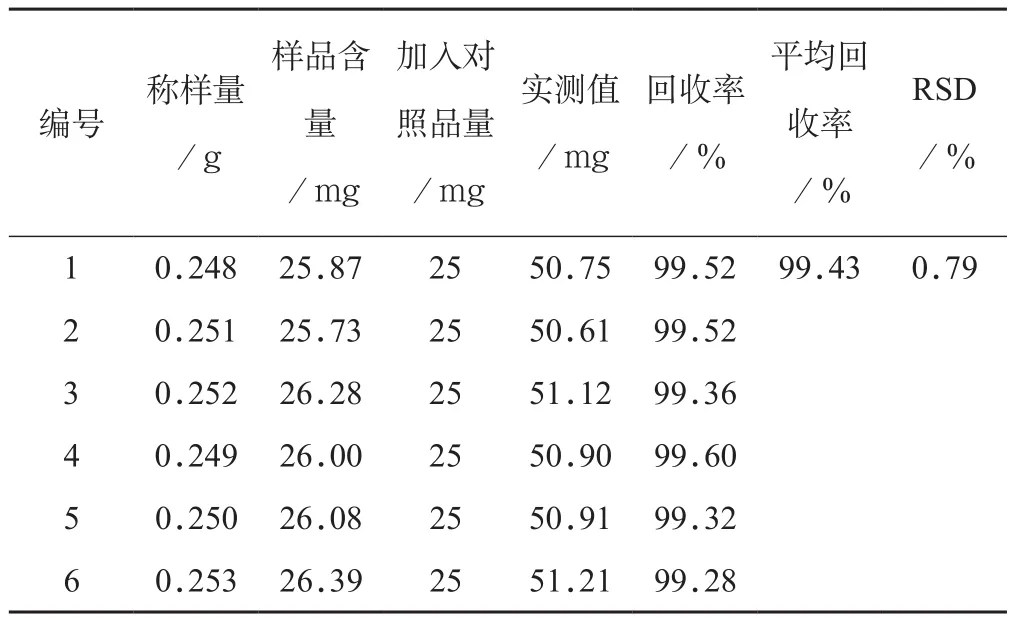
表3 加样回收率试验
2.5.7 稳定性试验 取百药煎(批号20140702)供试品溶液,分别在0,2,4,6,8,12,24 h,进样10 μl测定峰面积,计算得RSD为1.2%。结果表明供试品溶液在24 h 内稳定性良好。
2.5.8 含量测定 取各百药煎样品粉末0.5 g,按“2.5.3”项下方法制备供试品溶液,按“2.5.1”项下色谱条件测定,外标一点法计算百分含量,没食子酸含量测定结果见表2,平均含量( 按干燥品计算) 为41.5%。根据测定结果,建议规定百药煎中没食子酸含量不得低于33.0%。
3 讨论
首先本文对百药煎样品水解时间进行考察,结果显示,样品在3.5 h 时没食子酸含量最高,说明已水解完全。其次百药煎中五倍子与茶叶中均含有没食子酸,且五倍子为百药煎主要成分,含量占近80%,而茶叶含量仅占不足5%。许多研究表明[3~5],茶叶中没食子酸含量不超过1%。因此,茶叶中存在的少量没食子酸不会对实验造成干扰,故为了保证百药煎质量及疗效,通过测定没食子酸的含量,可有效的定量控制百药煎的质量。另外本文采用高效液相色谱法对百药煎中没食子酸的含量测定进行了研究,建立了百药煎中没食子酸含量的HPLC测定法,本测定方法取样量少,所用溶剂毒性小,方法简便易操作,可重复性良好,结果准确,可作为质量控制分析方法,为百药煎中没食子酸的含量测定提供了一种可借鉴的、准确有效的方法。
[1] 郑尚金,陈时飞,陆光照,等.浙江省中药炮制规范:2005年版[M].杭州: 浙江科学技术出版社,2005:539.
[2] 刘起中,张可可.HPLC测定五倍子中没食子酸的含量[J].中草药,2002,33(5):427.
[3] 熊凤麟,袁吕江,吴光权等.高效液相色谱法同时测定茶叶中维生素C、没食子酸和咖啡碱的含量[J].色谱,1993,11(6):366-368.
[4] 邹盛勤,姜琼.RP—HPLC测定茶叶中没食子酸、儿茶素和表儿茶素的含量[J].江苏农业科学,2014,42(7):322-324.
[5] 李银花,李娟,龚雪等. 高效液相色谱法同时测定茶叶中8种儿茶素、3种嘌呤碱和没食子酸[J].食品科学,2011,32(18):214-217.
(责任编辑:傅舒)
Study on quality standard of Baiyaojian/
XIAO Fang, HUANG Qin-wan, YI Jia-jia// (Chengdu University of Traditional Chinese Medicine, Chengdu 611137, Sichuan)
Objective: To establish the quality standard of Baiyaojian. Method: With gallic acid as reference, TLC was used to detect Baiyaojian. HPLC was adopted to determine the content of gallic acid. Moisture, total ash, acid insoluble ash and aflatoxin were determined. And the microscopic identification was also carried out. Result: Baiyaojian had obvious microscopic characteristics. The TLC identification had a good resolution with clear spots.According to the measurement results, moisture in Baiyaojian should be no more than 11.0 %, the content of total ash no more than 4.0 %,and the content of acid-insoluble ash no more than 1.0%.The peak area of gallic acid was in a good linear relationshipin the range of 0.24~0.64 μg (r=0.9999). The average recovery was 99.43% with RSD of 0.79 %. The content of gallic acid should be above 33.0%. Conclusion: The established standard is acceptable for quality evaluation of Baiyaojian.
Baiyaojian; quality standard; TLC identification; content determination; gallic acid
R283.3
A
1674-926X(2016)04-006-04
四川省科技厅支撑计划(编号:2012FZ0017),
成都市科技局课题(编号:12DXYB310JH),
四川省教育厅青年基金(编号:10ZC051)。
成都中医药大学,四川 成都 611137
肖 芳,在读硕士,主要从事中药炮制学研究。
Tel:18482177688 Email:329065965@qq.com
黄勤挽,博士,副教授,主要从事中药炮制学研究。Tel:13982199974 Email:36190587@qq.com
2015.08.24

