顶空毛细管气相色谱法测定伊曲康唑颗粒中乙醇和二氯甲烷残留量
王 发,李 继,王 莉
(陕西省食品药品检验所,陕西 西安 710061)
顶空毛细管气相色谱法测定伊曲康唑颗粒中乙醇和二氯甲烷残留量
王发,李继,王莉
(陕西省食品药品检验所,陕西 西安710061)
目的 建立测定伊曲康唑颗粒中乙醇和二氯甲烷残留量的顶空毛细管气相色谱法。方法 使用Agilent DB-1301毛细管色谱柱(30 m×0.32 mm,0.25 μm)及氢火焰离子检测器(FID),进样口温度为220℃,检测器温度为250℃;程序升温,初始温度为60℃,保持6 min,然后以20℃/min的速率升至220℃,保持2 min;顶空进样,平衡温度为85℃,平衡时间为40 min。结果 乙醇和二氯甲烷分离度良好,线性关系良好(r=0.996 7),平均回收率分别为98.94%和96.29%,RSD分别为0.98%和1.47%(n=6)。结论 该方法简便、准确,适用于伊曲康唑颗粒中乙醇和二氯甲烷残留量的测定。
伊曲康唑颗粒;乙醇;二氯甲烷;顶空进样法;毛细管气相色谱法
伊曲康唑是人工合成的三氮唑类广谱抗真菌药物,对深部真菌感染疗效好,具有较高的选择性,良好的抗真菌活性,以及在皮肤黏膜的高蓄积性,临床广泛用于治疗外阴阴道念珠菌病、花斑癣、皮肤真菌病、真菌性角膜炎和口腔念珠菌病、皮肤癣菌和甲真菌病、系统性真菌感染[1-3]。目前,市售常释剂型有胶囊、分散片和颗粒,胶囊和分散片剂型标准中均对二氯甲烷残留量进行了检测[4-5],而颗粒剂标准[6]中未对二氯甲烷残留量进行控制,相关测定方法尚未见报道。本研究中结合颗粒剂的制剂工艺特点,参考文献[7-10],建立了伊曲康唑颗粒中乙醇和二氯甲烷的毛细管气相色谱测定法,并进行了方法学验证,可用于其质量控制。
1 仪器与试药
1.1仪器
6890N型气相色谱仪,氢火焰离子检测器(FID),G1888型自动顶空进样器(安捷伦公司);BBS-224S型电子分析天平(赛多利斯公司)。
1.2试药
6批伊曲康唑颗粒均由A公司提供,根据其批号不同分别记作S1~S6;二氯甲烷;无水乙醇为分析纯,水为高纯水。
2 方法与结果
2.1色谱条件
色谱柱:AgilentDB-1301毛细管柱(30m×0.32mm,0.25μm);检测器:FID检测器;程序升温:初始温度60℃,保持6 min,然后以20℃/min的速率升至220℃,保持2 min;进样口温度:220℃;检测器温度:250℃;顶空进样:平衡温度85℃,平衡时间40 min,进样时间1 min。
2.2溶液制备
对照品溶液:精密称取乙醇101.7 mg、二氯甲烷13.10 mg,同置100 mL容量瓶中,用水溶解并稀释至刻度,作为对照品贮备液。精密量取对照品贮备液10 mL,置100 mL容量瓶中,用水稀释至刻度,制成含乙醇和二氯甲烷质量浓度分别为0.101 7,0.013 10 g/L的溶液,即得对照品溶液。
供试品溶液:取伊曲康唑颗粒0.10 g,精密称定,置顶空瓶中,精密加入5 mL水,密封,即得。
2.3方法学考察
系统适用性试验:取2.2项下对照品溶液和空白溶剂,按拟订色谱条件进样测定,记录色谱图(见图1)。可见,各组分分离度均在2.0以上,空白溶剂对测定无干扰。
线性关系考察:精密量取对照品贮备液适量,用水稀释成含乙醇0.050 85,0.076 28,0.101 7,0.127 1,0.1525g/L和二氯甲烷0.006550,0.009825,0.01310,0.016 38,0.019 65 g/L的溶液,取上述溶液各5 mL,置顶空瓶中,密封,85℃保持40 min,顶空进样,记录色谱图。以峰面积(Y)为纵坐标、质量浓度(X)为横坐标进行线性回归,得乙醇、二氯甲烷的回归方程及线性范围,见表1。
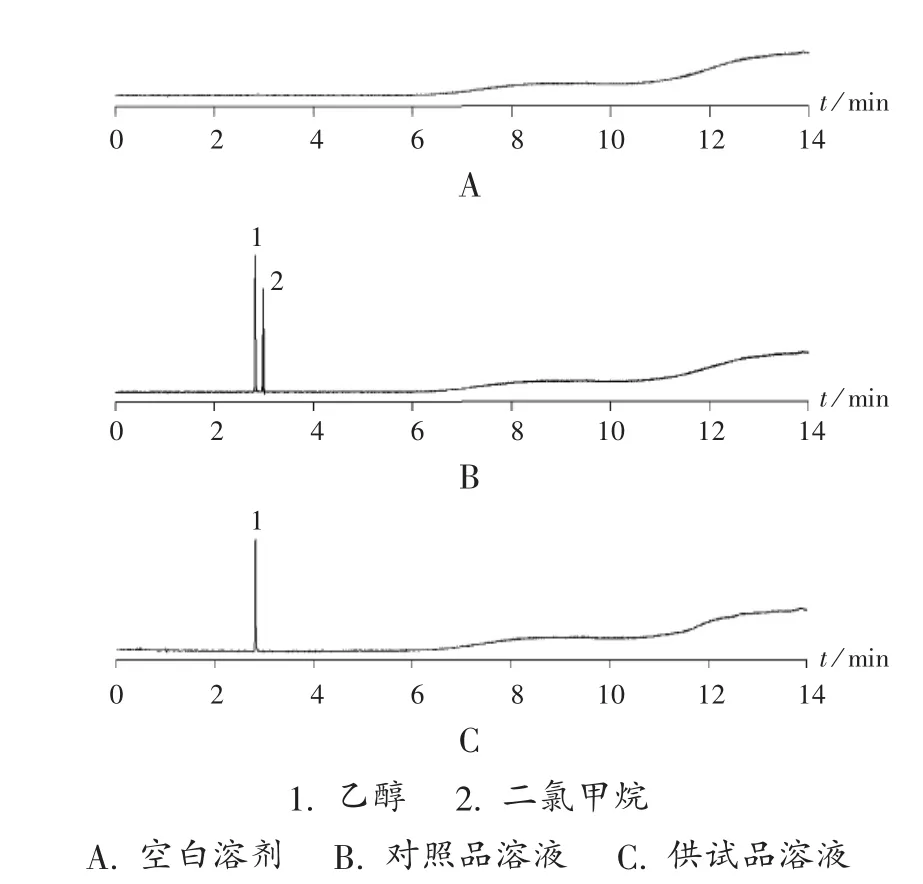
图1 高效液相色谱图

表1 标准曲线的回归方程及线性范围(n=5)
精密度试验:精密量取对照品溶液5 mL,共6份,置顶空瓶中,密封,顶空进样,记录色谱图,测量乙醇和二氯甲烷峰面积。结果乙醇、二氯甲烷峰面积的 RSD分别为1.20%和1.81%(n=6),表明仪器精密度良好。
重复性试验:取编号为S4的样品6份,各0.10 g,置顶空瓶中,精密加入5 mL水,密封,顶空进样测定。结果本品中乙醇的含量为0.24%,RSD为1.63%(n=6),二氯甲烷未检出。
定量限和检测限试验:取对照品溶液适量,用水逐步稀释,按拟订色谱条件进样测定,记录色谱图。以信噪比为10∶1时的对照品质量浓度为定量限,乙醇、二氯甲烷的质量浓度分别为0.017,0.002 2 g/L。以信噪比为3∶1时的对照品质量浓度为检测限,乙醇、二氯甲烷的质量浓度分别为0.008 5和0.001 1 g/L。
耐用性试验:尝试了Agilent DB-1301柱(30 m× 0.32 mm,0.25 μm)和 DB-624柱(30 m×0.32 mm,1.8 μm),采用同样的色谱条件进行试验。结果,各色谱峰分离度均可达到要求。
加样回收试验:精密称取已测得乙醇、二氯甲烷残留量的编号为S4的样品6份,各0.10 g,分别置顶空瓶中,各精密加入对照品溶液5 mL,密封,顶空进样,测定,记录色谱图,计算回收率,结果见表2。
2.4样品含量测定
按2.2项下方法,分别制备对照品溶液和供试品溶液,按拟订色谱条件进行测定,按外标法计算供试品中乙醇和二氯甲烷的含量。结果见表3。
3 讨论
3.1顶空平衡温度选择
在相同质量浓度和其他条件不变的情况下,考察了80,85,90℃ 3个顶空温度对测定的影响。结果乙醇的峰面积随顶空温度的升高而逐渐增大,但二氯甲烷的峰面积在90℃时开始减小,为保证乙醇和二氯甲烷均有较高的检出限,选择85℃作为顶空平衡温度。
3.2色谱柱选择
在试验中,比较了不同极性的色谱柱,如中等极性的DB-1301色谱柱和极性的DB-WAX色谱柱。在相同初始温度条件下,二氯甲烷和乙醇在DB-1301色谱柱上的分离度比DB-WAX色谱柱上高,因此选择DB-1301色谱柱。
3.3检测结果说明
由检测结果可见,6批样品均检出了乙醇,且有1批样品已超出了限度,故有必要对其进行控制,以确保药品质量的稳定可控。

表2 加样回收试验结果(n=6)

表3 伊曲康唑颗粒中乙醇和二氯甲烷含量测定结果(%)
[1]邱承培.氟康唑与伊曲康唑治疗甲真菌病的疗效对比[J].临床合理用药,2015,8(6C):60-61.
[2]李静华,张志明.伊曲康唑对灰指甲的治疗效果临床观察[J].中医临床研究,2014,6(32):139.
[3]郑文亮.伊曲康唑治疗糠秕孢子菌性毛囊炎100例临床观察[J].中国医药工程,2015,23(5):80-83.
[4]国家药典委员会.中华人民共和国药典(二部)[M].北京:
中国医药科技出版社,2010:275.
[5]YBH04232009,国家食品药品监督管理局标准[S].
[6]YBH03922009,国家食品药品监督管理局标准[S].
[7]张宇佳,郑稳生,方夏琴.气相色谱法测定伊曲康唑传递体有机溶剂残留量[J].医药导报,2013,32(8):1 075-1 077.
[8]王发,徐春燕,王嫦鹤.顶空气相色谱法测定聚桂醇中环氧乙烷和二氧六环的含量[J].安徽医药,2013,17(1):33-34.
[9]冯明霞,王雪芹,刘杰.顶空气相色谱法测定伊曲康唑薄膜衣片中二氯甲烷及乙醇残留量[J].药物分析杂志,2006,26(6):862-864.
[10]魏莉,姜建国,宋更申.顶空毛细管气相色谱法测定马来酸桂哌齐特中的残留溶剂[J].中国药业,2010,19(8):44-45.
Content Determination of Ethanol and Dichloromethanein Itraconazole Granulesby Headspace Capillary GC
Wang Fa,Li Ji,Wang Li
(Shaanxi Province Institute for Food and Drug Control,Xi′an,Shaanxi,China710061)
ObjectiveTo establish an Headspace Capillary GC method for the content determination of ethanol and dichloromethane in itraconazole granules.MethodsAgilent DB-1301 capillary column(30 m×0.32 mm,0.25 μm)was used.The inlet temperature was 220℃and the FID detector temperature was 250℃.The oven temperature was initially held at 60℃for 6 min and was then programmed to 220℃ at 20℃/min andheld for 2 min.The head-space sampling was used at heated temperature 85℃ for 40 min.ResultsThe separation for ethanol and dichloromethane was good,with the linear correlation coefficients of 0.996 7.The average recovery rate were 98.94%and 96.29%,RSD=0.98%,1.47%(n=6).ConclusionThemethod is simple,accurate,and is suitable for the contentdetermination of ethanol and dichloromethane in itraconazole granules.
itraconazole granules;ethanol;dichloromethane;head-space injecting method;capillary GC
R927.12;R978.5
A
1006-4931(2016)20-0047-03
(2015-10-14;
2016-05-26)

