守恒思想在氧化还原反应中的应用
山西省太谷中学校(030800)
李永转●
守恒思想在氧化还原反应中的应用
山西省太谷中学校(030800)
李永转●
高中化学中涉及氧化还原的问题很多,多个氧化还原反应连续反应或者同时发生时,涉及的过程相对复杂,这时若按部就班地分析判断,很是麻烦,也很容易出错.氧化还原反应的实质是电子转移,因此只要抓住元素在反应物中的初态和在生成物中的终态,根据氧化还原反应中氧化剂得到的电子总数和还原剂失去的电子总数相等,即得失电子守恒,即可快速解题.下面我将结合例题谈谈守恒思想在氧化还原反应题中的具体应用.
1.应用于确定化合价
电子守恒思想经常用于确定元素的化合价,运用这种方法的优势在于不需要写出整个化学方程式,只需要确定氧化剂和还原剂,氧化产物和还原产物.根据电子得失总数相等,就可以确定某一元素的化合价.
例1 24mL浓度为0.05mol/L的Na2SO3溶液,恰好与20mL浓度为0.02mol/L的K2Cr2O7溶液完全反应,则Cr元素在还原产物中的化合价为( ).
A.+6 B.+3 C.+2 D.0
解析 Na2SO3和K2Cr2O7的反应并不是学生熟悉的反应,不容易写出化学方程式,可以利用电子守恒来解.题中问Cr元素在还原产物中的化合价,可见Cr元素在反应中被还原,得电子,属于氧化物.那么K2Cr2O7是氧化剂,Na2SO3是还原剂,S元素失去电子,被氧化,S元素由+4价升高,只能变为+6价.假设Cr元素在还原产物中的化合价为x,根据氧化剂电子总数和还原剂失电子总数相等,即电子守恒,可以得到;(6-x)×2×0.02×20×10-3=(6-4)×0.05×24×10-3,解得x=3.正确答案为B.
点拨 解决这类问题,确定氧化剂和还原剂是关键.另外得记住一些常见元素的常见化合价,如本题中的S元素由+4价升高,只能变为+6价.只有弄清楚元素化合价的变化,才能确定得失电子总数,运用电子守恒解题.
二、应用于判断离子方程式正误
判断离子方程式的正误是高中化学经常出现的选择题型,综合性较高.考查学生对知识的综合运用的能力,解答这类题时,一定要注意看清题目要求,结合守恒定律判断所给离子方程式正误.
例2 下列反应的离子方程式书写正确的是( ).
B.NaHSO4溶液与Ba(OH)2溶液混合后显酸性:

点拨 解决这类问题主要是依据电子守恒,首先看离子方程式等号两边的总电荷是否相等.如果相等再根据电子得失情况找出氧化剂和还原剂,看氧化剂得电子总数和还原剂失电子总数是否相等.
三、应用于综合计算
守恒定律也经常应用于综合计算题,这类题一般要综合运用电子得失守恒、电荷守恒、质量守恒才能求解.解题时应当注意从多个角度考虑,寻找等量关系,列出符合题意的方程进行求解.
例3 将ag铁镁合金溶解在一定量的稀HNO3中,当合金完全溶解后,收集到bL NO气体(标况),再向反应后的溶液中加入足量的NaOH溶液,求得到的沉淀的质量.
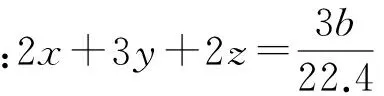
点拨 从本题的解答可以看出,用守恒定律解答涉及多过程多反应的综合题有很大的优势,因为不需要弄清每个过程的具体反应.运用得当,解题时往往会有事半功倍的效果.
守恒法的运用有助于提高学生多角度分析问题、解决问题的能力.学生应当在熟练掌握基本知识和概念的情况下,多加练习,总结经验技巧.之后解氧化还原反应配平、计算题时就会得心应手.
G632
B
1008-0333(2016)31-0087-01

