肠道菌群特征与胰岛素抵抗的相关性研究
熊 青,杨学军,任 汐,林 慧
(海南省海口市人民医院内分泌科 570208)
肠道菌群特征与胰岛素抵抗的相关性研究
熊 青,杨学军,任 汐,林 慧
(海南省海口市人民医院内分泌科 570208)
目的 探讨糖尿病前期人群肠道菌群的改变与胰岛素抵抗的相关关系及肠道菌群在糖尿病前期人群糖尿病发生、发展中的作用。方法 选取该院糖尿病前期人群250例,分为A组(前期干预组)和B组(前期无处理组),糖尿病人群50例为C组(阳性对照组),采用队列研究随访干预2年,分别测定不同时期的肠道菌群情况及血液生化指标,计算胰岛素抵抗指数。结果 干预前,A、B组总菌数显著高于C组;C组肠球菌属显著高于A、B组;A、B组变形杆菌、乳酸杆菌含量高于C组,差异无统计学意义;C组双歧杆菌属高于A、B组。干预后,A组细菌总量显著高于B 、C组,B、C两组无差异;C组肠球菌属显著高于A、B组,干预后A组肠球菌属降低,B组升高,差异有统计学意义;A、B组变形杆菌、乳酸杆菌含量高于C组,差异不明显;C组双歧杆菌属高于A、B组,且干预后B组数量升高,差异有统计学意义。处理前,A、B组胰岛素抵抗差异无统计学意义,C组胰岛素抵抗高于A、B组,干预后,A组胰岛素抵抗降低,差异有统计学意义。总菌数、肠球菌属、双歧杆菌属与胰岛素抵抗之间呈正相关,拟杆菌属、变形杆菌、乳酸杆菌与胰岛素抵抗的相关不显著。结论 肠道菌群与胰岛素抵抗存在相关关系,可作为糖尿病前期发展的标志,通过益生菌调节,结合量化有氧肌肉运动,可实现对胰岛素敏感性的调整,改善糖尿病前期人群糖尿病的发展。
糖尿病前期;胰岛素抵抗;肠道菌群;发生发展
我国糖尿病发病率为10%左右,成年人群中约有50.1%为糖尿病前期,如不进行有效干预,一旦进入发病阶段,将对我国社会、经济发展造成灾难性影响[1-2]。近期研究表明,糖尿病前期当血糖水平出现增高时血管损害已经发生。因此,寻找血糖变化前期的生物学标志物,是更新目前糖尿病诊断指标的一个热点[3]。肠道菌群组成直接影响代谢、肠道食物吸收、体内营养组分结构,在2型糖尿病发生、发展特别是胰岛素抵抗的形成中起重要作用[4-5]。胰岛素抵抗是糖尿病发生发展的关键病理生理变化,其具体成因仍不详[6]。前期研究发现,有效运动可使糖尿病前期的胰岛素抵抗和葡萄糖耐量曲线逆转至正常[7]。本研究拟探讨肠道菌群的组成、动态变化特点以及与胰岛素抵抗形成和发展的关系;通过益生菌对肠道菌群的改善情况,探讨肠道菌群特征与胰岛素抵抗的相关关系,糖尿病前期的生物学指标和干预靶点,对实现糖尿病前期有效控制和监测具有重要的科学意义和极大的社会价值。
1 资料与方法
1.1 一般资料 选取本院就诊的糖尿病前期人群250例,分为A组(糖尿病前期综合干预组)200例;B组(糖尿病前期无特殊处理组)50例(只进行第1年的对照试验,后转入干预组或糖尿病组);确诊为糖尿病患者50例,病程5年以上,记为C组(阳性对照组),采用队列研究,随访干预2年。糖尿病前期纳入标准:(1)空腹血糖受损(IFG)空腹血糖6.1~7.0 mmol/L;(2)糖耐量异常(IGT)OGTT试验2 h后血糖7.8~11.1 mmol/L。2型糖尿病的诊断:根据1999年的WHO的诊断标准(1)空腹血糖大于7.0 mmol/L;(2)糖尿病症状加随机静脉血浆葡萄糖大于或等于11.1 mmol/L;(3)OGTT试验2 h血糖大于或等于11.1 mmol/L。
排除标准:(1)1型糖尿病、特殊类型糖尿病和妊娠;(2)患有肿瘤及肝、肾等脏器严重损害;(3)有甲状腺等其他内分泌疾病;(4)近月内服用抗生素及微生态制剂;(5)近周内患腹泻病或其他胃肠道疾病;(6)既往胃肠道手术史。
1.2 方法
1.2.1 随访 干预组集中培训2 d。加强干预3个月(每周培训1次);随访2年,每3个月1次;督导每天至少运动30 min。运动处方:肌肉抵抗训练上下肢、腹部、背部肌肉,有氧变速跑动等。对照组为糖尿病前期无特殊处理组(只进行第1年的对照试验,后转入干预组)和糖尿病组。根据干预组的时间点采集血和大便标本。各组每天记录:空腹和餐后2 h血糖,每2周记录体质量,每年进行1次葡萄糖钳夹试验。
1.2.2 样本收集和检测 试验开始前、培训2周后、每3个月采集1次粪便和血液标本。粪便标本于排便后2 h内收集在密闭的粪便储存盒内,于-80℃冰箱中迅速储存,用于肠道细菌DNA的提取;血液标本于空腹采集,-80℃保存,用于血液生化的测定,并计算胰岛素敏感性指数,衡量胰岛素抵抗程度。
1.2.3 肠道细菌DNA的提取步骤 (1)称取粪便样本至离心管中,并将离心管置于冰上。向样本中加入缓冲液,间歇振荡1 min至样本混匀,70 ℃孵育5 min。(2)涡旋15 s,13 000 r/min离心1 min。转移上清液1.2 mL至新的2 mL离心管。(3)加入一个抑制剂吸附片,振荡至吸附片彻底打开重悬。室温孵育1 min,使吸附片能充分作用。13 000 r/min离心3 min。(4)将上一步所得上清液转移至新的离心管,重复以上步骤。(5)转移所得上清液至新的离心管,加入蛋白酶,加入缓冲液GB,涡旋15 s,70 ℃孵育10 min。(6)加入200 μL无水乙醇,涡旋混匀,将上一步所得溶液加入到一个吸附柱中(吸附柱放入收集管中)。(7)离心30 s后倒掉废液,将吸附柱放入收集管中。(8)将吸附柱放回收集管中,离心2 min后倒掉废液。(9)将吸附柱置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液。(10)将吸附柱转入一个干净的离心管中,向吸附膜的中间部位悬空滴加洗脱缓冲液,室温放置5 min,12 000 r/min离心2 min。(11)将溶液收集到离心管中。(12)为增加基因组DNA的获得率,将离心得到的溶液再加入吸附柱中,室温放置2 min,12 000 r/min离心2 min。

2 结 果
2.1 3组人群细菌数量的比较 A、B组与C组比较肠道细菌总量存在差异,A、B组显著高于C两组(P<0.05);拟杆菌属各组差异无统计学意义;C组肠球菌属显著高于A、B组(P<0.05);A、B组变形杆菌、乳酸杆菌属含量高于C组,但是差异无统计学意义;双歧杆菌属C组高于A、B组,差异具有统计学意义(P<0.05),见表1。

表1 干预前3组人群肠道菌群数量的比较±s)
2.2 干预后3组人群肠道菌群数量比较 A组与B、C组比较肠道细菌总量差异有统计学意义,A组显著高于B 、C两组(P<0.05),B、C两组差异没有统计学意义;拟杆菌属各组差异无统计学意义;C组肠球菌属显著高于A、B组,干预后A组肠球菌属数量降低,B组升高,差异具有统计学意义(P<0.05);变形杆菌、乳酸杆菌属含量A、B组高于C组,但是差异无统计学意义(P>0.05);双歧杆菌属C组高于A、B组,且干预后B组数量升高,差异具有统计学意义(P<0.05),见表2。

表2 干预后3组人群肠道菌群数量比较±s)
*:P<0.05,与其他两组比较。
2.3 各组人群干预前后胰岛素抵抗(HOMA-IR)水平比较 处理前,A、B两组胰岛素抵抗水平差异无统计学意义,C组胰岛素抵抗水平高于糖尿病前期人群组,干预后,A组胰岛素抵抗水平降低,差异具有统计学意义,而B组未进行处理,其胰岛素抵抗平均水平升高,有向糖尿病发展的趋势,而糖尿病患者组进行合理的处理后,其胰岛素抵抗水平呈下降趋势,差异有统计学意义(P<0.05),见表3。

表3 各组胰岛素抵抗程度的比较±s)
2.4 肠道菌群与胰岛素抵抗的相关关系 总菌数、肠球菌属、双歧杆菌属与胰岛素抵抗水平之间呈正相关,而拟杆菌属、变形杆菌、乳酸杆菌与胰岛素抵抗水平的相关关系不显著,见表4。
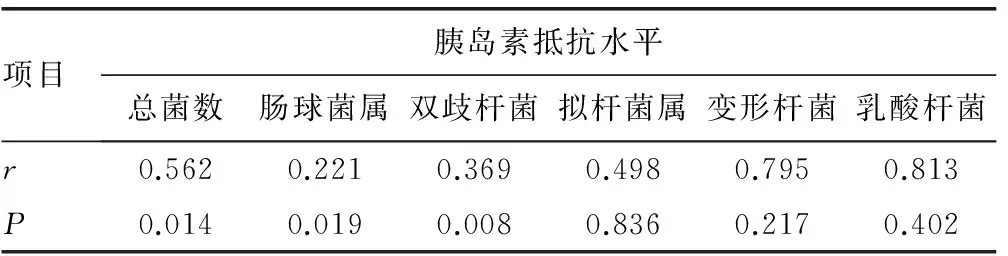
表4 肠道菌群与胰岛素抵抗的相关关系
3 讨 论
2004年首次通过肠道粪便替换实验发现,抵抗高脂饮食致肥胖和胰岛素抵抗的无菌小鼠接受普通小鼠粪便后14 d形成胰岛素抵抗[8]。TLR5基因缺失代谢综合征小鼠的粪便使野生型小鼠发生类似表现。 胰岛素抵抗形成同时与细菌引起的炎症有关[9]。Cani等[9]使用氨苄西林和新霉素,减少肠道内毒素吸收入血,成功阻止糖尿病前期的发展。这些证据充分表明,调整肠道菌群既能减轻炎症,亦能提高胰岛素敏感性[10]。另外,高脂饮食能使肠道细菌进入血液和组织分布,造成胰岛素抵抗[11]。肠道菌群作为生物学标志物,可以预测糖尿病发生和心血管疾病的风险,大量研究(主要在动物模型中)表明肠道菌群可能通过系统性炎性反应、调节宿主能量代谢。调节肠源性激素如肠源性肽、胰高血糖素样肽的分泌等多种机制参与肥胖、糖尿病的发生、发展[12]。随后证实其作为新的靶点,可成为预防和治疗糖尿病的希望,本研究选取的研究对象为存在胰岛素抵抗,血糖水平正常或血糖水平异常但却还达不到糖尿病诊断标准的人群,即糖尿病前期人群。对人群进行为期2年的随访,监测胰岛素抵抗逐渐从糖尿病前期到典型糖尿病演化的整个过程,同时对相关代谢和肠道细菌集落的组成改变进行观察和动态检测。结合以空腹、餐后血糖,糖化血红蛋白水平和胰岛素抵抗为指标,对该人群与典型糖尿病人群肠道细菌和血代谢组学进行对比观察,筛选对糖尿病前期发展趋势和演变规律有重大影响,并可作为预测预后、提示干预靶点的生物学标志意义突出,并充分体现个体化、动态化特点。
本研究结果表明,(1)糖尿病人群与糖尿病前期人群肠道菌群差异有统计学意义;(2)进行干预后,糖尿病前期人群肠道菌群会有所改善;(3)符合糖尿病前期诊断标准的人群,任由其发展,具有发生发展为糖尿病的趋势;其肠道菌群特征与糖尿病患者类似;(4)糖尿病前期人群某些肠道菌群与胰岛素抵抗水平之间存在正相关关系,某些菌属在糖尿病患者与糖尿病前期人群中差异并无统计学意义,也可为临床糖尿病患者肠道菌群调节提供依据。然而,目前糖尿病前期判断主要取决于空腹和餐后血糖异常,以胰岛素抵抗和胰岛素分泌亢进为主要表现。肠道菌群能够改变肠道糖异生、糖对门静脉壁的刺激,通过肠脑调节环路改变胰岛素的敏感性[13],亦有文献报道C梭形芽孢杆菌通过与相应宿主遗传性变异增加糖尿病易感性[14]。
综上所述,本研究通过糖尿病前期人群的随访,并对人群样本进行临床试验,对肠道细菌进行DNA测序,分析基因组数据,获取肠道细菌集落组成和动态变化特点等信息。探讨了肠道菌群变化与胰岛素抵抗水平的关系,使其作为糖尿病前期的生物学标志和干预靶点,实现糖尿病前期有效控制和监测。同时,通过精确指导下的益生菌调节,实现了对糖尿病前期胰岛素敏感性的调整,对临床治疗和干预提供理论依据。
[1]Nitzan O,Elias M,Chazan B,et al.Urinary tract infections in patients with type 2 diabetes mellitus:review of prevalence,diagnosis,and management[J].Diabetes Metab Syndr Obes,2015,8(1):129-136.
[2]Sun H,Yi L,Wu P,et al.Prevalence of gastroesophageal reflux disease in type Ⅱ diabetes mellitus[J].Gastroenterol Res Pract,2014(4):571-601.
[3]Anderson SG,Dunn WB,Banerjee M,et al.Evidence that multiple defects in lipid regulation occur before hyperglycemia during the prodrome of type-2 diabetes[J].PLoS One,2014,9(9):203-217.
[4]Flier JS,Mekalanos JJ.Gut check:testing a role for the intestinal microbiome in human obesity[J].Sci Transl Med,2009,1(6):6-7.
[5]Bockhed F,Ding H,Wang T,et al.The gut microbiota as an environmental factor that regulates fat storage[J].Proc Natl Acad Sci U S A,2004,101(44):15718-15723.
[6]Qin J,Li Y,Cai Z,et al.A metagenome-wide association study of gut microbiota in type 2 diabetes[J].Nature,2012,490(7418):55-60.
[7]Mobbs CV,Isoda F,Makimura H,et al.Impaired glucose signaling as a cause of obesity and the metabolic syndrome:the glucoadipostatic hypothesis[J].Physiol Behav,2005,85(1):3-23.
[8]Vijay-Kumar M,Aitken JD,Carvalho FA,et al.Metabolic syndrome and altered gut microbiota in mice lacking Toll-like receptor 5[J].Science,2010,328(5975):228-231.
[9]Cani PD,Bibiloni R,Knauf C,et al.Changes in gut microbiota control metabolic endotoxemia-induced inflammation in high-fat diet-induced obesity and diabetes in mice[J].Diabetes,2008,57(6):1470-1481.
[10]Esteve E,Ricart W,Fernández-Real JM.Gut microbiota interactions with obesity,insulin resistance and type 2 diabetes:did gut microbiote co-evolve with insulin resistance?[J].Curr Opin Clin Nutr Metab Care,2011,14(5):483-490.
[11]Amar J,Serino M,Lange C,et al.Involvement of tissue bacteria in the onset of diabetes in humans:evidence for a concept[J].Diabetologia,2011,54(12):3055-3061.
[12]Amar J,Lange C,Payros G,et al.Blood microbiota dysbiosis is associated with the onset of cardiovascular events in a large general population:the D.E.S.I.R.study[J].PLoS One,2013,8(1):e54461.
[13]De Vadder F,Kovatcheva-Datchary P,Goncalves D,et al.Microbiota-generated metabolites promote metabolic benefits via gut-brain neural circuits[J].Cell,2014,156(1/2):84-96.
[14]Larsen N,Vogensen FK,Van Den Berg FW,et al.Gut microbiota in human adults with type 2 diabetes differs from non-diabetic adults[J].PLoS One,2010,5(2):e9085.
Study on correlation between intestinal flora characteristic and insulin resistance
XiongQing,YangXuejun,RenXi,LinHui
(DepartmentofEndocrinology,HailouMunicipalPeople′sHospital,Haikou,Hainan570208,China)
Objective To explore the correlation between the change of intestinal flora and insulin resistance in pre-diabetes population,and the role of intestinal flora in the occurrence and development in the pre-diabetes population.Methods two hundreds and fifty cases of pre-diabetes in our hospital were selected and divided into the group A(pre-diabetes intervention group)and B(pre-diabetes non-treatment group).Fifty cases of diabetes(positive control group)served as the group C.The cohort study was adopted.The follow-up intervention lasted for two years.The intestinal flora and blood biochemical indicators were detected in different groups and at different time periods.The insulin resistance index was calculated.Results The total bacterial count before intervention in the group A and B was significantly higher than that in the group C;Enterococcus genus in the group C was significantly higher than that in the group A and B;the proteus and lactobacillus content in the group A and B was higher than that in the group C,but the difference was not significant;Bifidobacterium genus in the group C was higher than that in the group A and B.After intervention,the total bacterial amount in the group A was significantly higher than the group B and C,but there was no statistical difference between the group B and C;enterococcus genus in the group C was significantly higher than that in the group A and B,enterococcus genus after intervention in the group A was reduced and which in the group B was increased,the difference had statistical significance;the proteus and lactobacillus content in the group A and B was higher than that in the group C,but the difference was not significant;bifidobacterium genus in the group C was higher than that in the group A and B,moreover which after intervention in the group B was increased,the difference was statistically significant.The insulin resistance before processing had no statistical difference between the groups A and B,which in the group C was higher than the group A and B,the insulin resistance after intervention in the group A was decreased,the difference was statistically significant.The total bacterial count,enterococcus and bifidobacterium were positively correlated with insulin resistance,and bacteroides,proteus and lactobacillus had no significant correlation with insulin resistance.Conclusion Intestinal flora has correlation with insulin resistance,and serves as a marker of pre-diabetes development,implementing the probiotics adjustment combined the quantization aerobic muscular movement can realize the adjustment of insulin sensitivity and improves the diabetic development in the prediabetic population.
pre-diabetes;insulin resistance;intestinal flora;occurrence and development
熊青(1983-),硕士,主治医师,主要从事早期糖尿病的胰岛素功能及肠道菌群研究。
��·临床研究
10.3969/j.issn.1671-8348.2016.33.016
R587
A
1671-8348(2016)33-4658-03
2016-04-06
2016-06-19)

