Apelin对葡萄糖的毒性作用及对胰岛细胞PDX-1表达的影响*
黄炫赓,黎英荣 ,郑晓菲,潘海林,苏宏业,夏 宁,肖常青
(广西医科大学第一附属医院内分泌代谢病科,南宁 530007)
Apelin对葡萄糖的毒性作用及对胰岛细胞PDX-1表达的影响*
黄炫赓,黎英荣△,郑晓菲,潘海林,苏宏业,夏 宁,肖常青
(广西医科大学第一附属医院内分泌代谢病科,南宁 530007)
目的 探讨Apelin对葡萄糖毒性作用及对胰岛细胞胰十二指肠同源盒蛋白-1(PDX-1)表达的影响。方法 在不同葡萄糖浓度下(正糖组5.6 mmol/L,高糖组16.7 mmol/L,极高糖组33.3 mmol/L),+/- Apelin-36培养胰岛β细胞株NIT-1细胞3 d,然后测定基础和葡萄糖刺激后胰岛细胞胰岛素分泌量,测定细胞内胰岛素含量和PDX-1蛋白及mRNA表达。结果 与正糖组比较,高糖组和极高糖组的基础和葡萄糖刺激后胰岛素分泌、细胞内胰岛素均明显减少,PDX-1蛋白表达下降(P<0.05);与未加Apelin组比较,加Apelin高糖组和极高糖组的基础和葡萄糖刺激后胰岛素分泌、细胞内胰岛素明显减少,PDX-1蛋白表达下降(P<0.05);6组胰岛细胞的胰岛素水平与PDX-1蛋白表达呈正相关,与PDX-1 mRNA表达无关。结论 Apelin可能通过降低PDX-1蛋白表达参与葡萄糖毒性作用,引起胰岛素分泌减少,从而在糖尿病的发病机制中发挥作用。
Apelin;胰十二指肠同源盒蛋白-1;葡萄糖毒性
Apelin是一种孤儿G蛋白耦联受体——血管紧张素受体AT1相关的受体蛋白的天然配体,由Tatemoto等[1]使用反向药理学的方法从牛胃分泌物中提取得到。近年来Apelin成为糖尿病领域的新热点,多个研究发现糖尿病患者血Apelin升高[2-4]。Apelin参与糖尿病的发病机制,与胰岛素抵抗关系密切[4-6],但具体机制尚未阐明。本课题组的临床研究[7]发现肥胖引起血清Apelin升高,糖尿病可以导致肥胖患者的Apelin进一步升高。本课题组的动物实验[8]观察到Apelin-36静脉注射进入大鼠体内后可以降低大鼠高血糖时的胰岛素水平,提示Apelin可能与葡萄糖毒性作用有关。肖常青等[9]的研究发现高浓度葡萄糖通过降低胰十二指肠同源盒蛋白-1(pancreatic duodenal homeobox-1,PDX-1)的蛋白表达而抑制胰岛素的分泌,认为高浓度葡萄糖对PDX-1蛋白表达的抑制是葡萄糖毒性作用的机制之一。Apelin是否通过抑制PDX-1蛋白表达,参与葡萄糖毒性机制而在糖尿病的发病中发挥作用呢?本课题组拟通过培养小鼠NIT-1细胞,将Apelin-36和不同浓度的葡萄糖加入培养液,检测基础和葡萄糖刺激的胰岛素释放、细胞内胰岛素含量、PDX-1蛋白及mRNA的表达,现报道如下。
1 材料与方法
1.1 材料 本试验选用胰岛β细胞株NIT-1细胞为试验对象,按培养液所含葡萄糖浓度的不同及是否加用Apelin分为6组:(1)未加Apelin正糖组(葡萄糖浓度为5.6 mmol/L);(2)加Apelin正糖组(葡萄糖浓度为5.6 mmol/L);(3)未加Apelin高糖组(葡萄糖浓度为16.7 mmol/L);(4)加Apelin高糖组(葡萄糖浓度为16.7 mmol/L);(5)未加Apelin极高糖组(葡萄糖浓度为33.3 mmol/L);(6)加Apelin极高糖组(葡萄糖浓度为33.3 mmol/L)。Apelin-36和胰岛素酶联免疫吸附试验(ELISA)试剂盒购自美国TSZ公司, PDX -1多克隆抗体、S-P免疫组化试剂盒、PDX-1原位杂交试剂盒购自上海诺渊生物科技有限公司。
1.2 方法
1.2.1 基础和葡萄糖刺激的胰岛素释放试验 分别收集各组胰岛细胞至1 mL离心管(每管1×106个细胞),分批预孵育于HBSS液,37 ℃孵育60 min,PBS洗涤2次后,在含5.6 mmol/L葡萄糖的HBSS缓冲液中37 ℃ 预孵育1 h,弃去缓冲液,然后将细胞置于含5.6 mmol/L葡萄糖(基础)和16.7 mmol/L葡萄糖(葡萄糖刺激)的HBSS缓冲液1 mL中37 ℃孵育1 h,收集反应液,然后用ELISA法测定胰岛素含量。
1.2.2 细胞内胰岛素含量测定 收集各组培养的小鼠NIT-1细胞至1 mL离心管(每管1×106个细胞),进行反复的冷冻、溶解、破碎然后以酸化乙醇溶液进行抽提,4 ℃ 孵育16~24 h,用ELISA法测定胰岛素含量。
1.2.3 PDX-1蛋白的表达 收集各组NIT-1细胞进行涂片,用4%的多聚甲醛溶液固定20 min,用PBS冲洗3次,每次3 min,按照S/P免疫组化试剂盒的说明书进行操作。在显微镜下计算各组细胞的阳性率。
1.2.4 PDX-1 mRNA的表达 取各组新鲜的小鼠NIT细胞涂片,用4%多聚甲醛/0.1%DEPC/0.1 mmol/L PBS(pH 7.2~7.6)固定20~30 min,按照PDX-1原位杂交试剂盒的说明书进行操作,在显微镜下计算各组细胞的阳性率。

2 结 果
2.1 各组胰岛细胞基础和葡萄糖刺激后胰岛素分泌、细胞内胰岛素的比较 (1)与正糖组比较,高糖组和极高糖组的基础和葡萄糖刺激后胰岛素、细胞内胰岛素分泌均明显减少(P<0.05);(2)与未加Apelin组相比,加Apelin的高糖组和极高糖组的胰岛β细胞内胰岛素在基础和葡萄糖刺激后分泌明显下降(P<0.05),见表1。

表1 各组胰岛素分泌的比较±s)
☆:P<0.05,与未加Apelin正糖组相比。★:P<0.05,与加Apelin 正糖组相比;▲:P<0.05,与未加Apelin高糖组相比。△:P<0.05,与未加Apelin极高糖组相比。
2.2 各组PDX-1蛋白及PDX-1 mRNA表达 (1)与正糖组比较,高糖组和极高糖组的PDX-1蛋白表达下降(P<0.05);(2)与未加Apelin组相比,加Apelin的高糖组和极高糖组的PDX-1蛋白表达明显下降(P<0.05);(3)各组间PDX-1 mRNA差异无统计学意义(P>0.05),见表2。
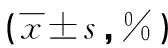
表2 各组PDX-1蛋白及PDX-1 mRNA表达比较
☆:P<0.05,与未加Apelin正糖组相比。★:P<0.05,与加Apelin正糖组相比;▲:P<0.05,与未加Apelin高糖组相比。△:P<0.05,与未加Apelin极高糖组相比。
6组细胞均出自同一批胰岛β细胞株NIT-1细胞,相同的培养条件,经Spearman分析发现:胰岛β细胞的胰岛素分泌量及细胞内含量均与PDX-1蛋白水平呈显著正相关,但与PDX-1 mRNA无相关性,见表3。
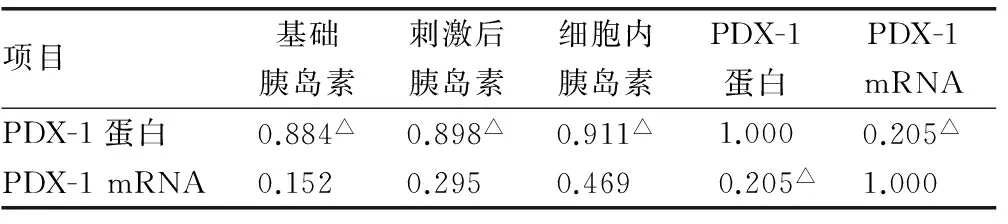
表3 PDX-1与胰岛素的相关分析
△:P<0.05。
3 讨 论
目前全世界糖尿病患病率越来越高[10-11],但糖尿病发病和进行性加重的原因远未阐明。张艳玲等[12]发现高糖对胰岛β细胞有慢性毒性作用。Lombardi等[13]的研究则证实,高糖培养后胰岛β细胞发生内质网应激,导致PDX-1、葡萄糖传运子-2 mRNA水平下降,结果胰岛β细胞的葡萄糖刺激的胰岛素分泌减退。Harmon等[14]的动物实验发现ZDF糖尿病鼠长期高血糖可以显著抑制PDX-1基因及胰岛素基因的表达,进而抑制与胰岛素基因启动子结合的PDX-1蛋白的表达,引起胰岛素释放减少,提示葡萄糖毒性作用的发生与长期高血糖所致的PDX-1蛋白表达下降有关。肖常青等[9]的研究结果也发现高浓度葡萄糖通过降低PDX-1的蛋白表达而抑制胰岛素的分泌。本研究发现:胰岛β细胞的胰岛素分泌量及细胞内含量均与PDX-1蛋白水平呈显著正相关;与正糖组比较,高糖组和极高糖组的PDX-1蛋白表达均明显下降,其基础和刺激后胰岛素分泌、细胞内胰岛素含量也明显减少。上述体内外试验均提示葡萄糖毒性作用的发生机制可能为:高血糖降低PDX-1蛋白表达,减少胰岛素的释放,从而进一步加重高血糖,引起恶性循环。
多项研究提示Apelin能抑制胰岛素的释放。Sörhede等[15]观察到Apelin-36可以使肥胖C57BL/6J大鼠模型静脉葡萄糖耐量试验快速相(1~5 min)的胰岛素释放减低35%。本课题组的研究[8]通过高脂饮食及STZ腹腔注射建立肥胖糖尿病大鼠的模型,然后进行静脉葡萄糖耐量试验,发现肥胖糖尿病组大鼠注射Apelin-36后,胰岛素曲线下面积减少38.1%。上述动物实验提示Apelin在高糖的条件下可以抑制胰岛素的分泌,进而参与葡萄糖毒性作用。本研究发现加Apelin的高糖组和极高糖组的基础和葡萄糖刺激后胰岛素分泌、细胞内胰岛素含量较未加Apelin组明显下降,而在正糖组加与未加Apelin上述指标无明显差异,证实Apelin在高糖条件下抑制胰岛素的分泌,参与了葡萄糖毒性作用,这与Sörhede等[15]的研究结果相似:Apelin抑制葡萄糖浓度为16.7 mmol/L的胰岛素释放,而葡萄糖浓度为2.8或8.3 mmol/L时,Apelin对胰岛素释放无影响。综合上述动物实验及细胞学研究的结果,说明Apelin在高糖条件下可以抑制胰岛素的释放,可能参与葡萄糖毒性作用。
Apelin参与葡萄糖毒性作用是否通过PDX-1的蛋白表达减低这一途径呢?本课题研究结果为:加Apelin的正糖组与未加Apelin正糖组相比,PDX-1蛋白表达无明显差异,血糖正常时Apelin对PDX-1蛋白表达无影响;与未加Apelin组相比,加Apelin的高糖组和极高糖组的PDX-1蛋白表达明显下降,提示Apelin参与葡萄糖毒性作用可能通过PDX-1的蛋白表达减低这一途径。
综上所述,Apelin可能通过降低PDX-1蛋白表达,参与葡萄糖毒性作用,引起胰岛素分泌减少,对其进行更深入的研究将为揭示糖尿病的发病机制提供更多的依据。
[1]Tatemoto K,Hosoya M,Habata Y,et al.Isolation and characterization of a novel endogenous peptide ligand for the human APJ receptor[J].Biochem Biophys Res Commun,1998,251(2):471-476.
[2]Habchi M,Duvillard L,Cottet V,et al.Circulating apelin is increased in patients with type 1 or type 2 diabetes and is associated with better glycaemic control[J].Clin Endocrinol(Oxf),2014,81(5):696-701.
[3]Alexiadou K,Kokkinos A,Liatis SA,et al.Differences in plasma apelin and visfatin levels between patients with type 1 diabetes mellitus and healthy subjects and response after acute hyperglycemia and insulin administration[J].Hormones,2012,11(4):444-450.
[4]谭丽艳,齐亚灵,李洪源,等.初诊老年肥胖2型糖尿病患者血清nesfatin-1及apelin水平与胰岛素抵抗的关系[J].中国老年学杂志,2014,34(8):2034-2035.
[5]Zhu S,Sun F,Li W,et al.Apelin stimulates glucose uptake through the PI3K/Akt pathway and improves insulin resistance in 3T3-L1 adipocytes[J].Mol Cell Biochem,2011,353(1/2):305-313.
[6]Yu S,Zhang Y,Li MZ,et al.Chemerin and apelin are positively correlated with inflammation in obese type 2 diabetic patients[J].Chin Med J(Engl),2012,125(19):3440-3444.
[7]黎英荣,连莲,苏宏业,等.2型糖尿病和肥胖患者血清Apelin与胰岛素抵抗的关系研究[J].重庆医学,2010,39(10):1322-1323.
[8]郑晓菲,黎英荣,陈伟,等.Apelin对肥胖糖尿病大鼠胰岛功能的影响[J].广西医科大学学报,2014,31(4):546-548.
[9]肖常青,邓宏明,黄媛.高浓度葡萄糖对PDX-1表达和胰岛素分泌功能的影响[J].中国糖尿病杂志,2006,14(4):281-283.
[10]Chen L,Magliano DJ,Zimmet PZ.The worldwide epidemiology of type 2 diabetes mellitus--present and future perspectives[J].Nat Rev Endocrinol,2012,8(4):228-236.
[11]Yang WY,Lu JM,Weng JP,et al.Prevalence of diabetes among men and women in China[J].N Engl J Med,2010,362(12):1090-1101.
[12]张艳玲,邹本良.高糖对小鼠胰岛和胰岛β细胞株INS-IE的长期作用[J].中华老年多器官疾病杂志,2012,11(3):222-225.
[13]Lombardi A,Ulianich L,Treglia AS,et al.Increased hexosamine biosynthetic pathway flux dedifferentiates INS-1E cells and murine islets by an extracellular signal-regulated kinase(ERK)1/2-mediated signal transmission pathway[J].Diabetologia,2012,55(1):141-153.
[14]Harmon JS,Gleason CE,Tanaka Y,et al.In vivo prevention of hyperglycemia also prevents glucotoxic effects on PDX-1 and insulin gene expression[J].Diabetes,1999,48(10):1995-2000.
[15]Sörhede Winzell M,Magnusson C,Ahrén B.The apj receptor is expressed in pancreatic islets and its ligand,apelin,inhibits insulin secretion in mice[J].Regul Pept,2005,131(1/3):12-17.
Effects of Apelin on glucose toxicity and islet cells PDX-1 expression*
HuangXuangeng,LiYingrong△,ZhengXiaofei,PanHailin,SuHongye,XiaNing,XiaoChangqing
(DepartmentofEndocrinologyandMetabolismDiseases,FirstAffiliatedHospital,GuangxiMedicalUniversity,Nanning,Guangxi530007,China)
Objective To study the effects of Apelin on glucose toxicity and islet cells PDX-1 protein expression.Methods The islet β cell line NIT-1 cells were incubated in the medium containing different glucose concentrations(normal glucose concentration group 5.6 mmol/L,high glucose concentration group 16.7 mmol/L,extremely high glucose concentration group 33.3 mmol/L)and +/- Apelin-36 respectively for 3 d.Then the basic insulin secretion amount of islet cells and their secretion amount after glucose stimulation were detected.The intracellular insulin content and the PDX-1 protein and mRNA expression were detected.Results Compared with the normal glucose group,the basic insulin secretion,secretion after stimulation and intracellular insulin in the high glucose group and extremely high glucose group were significantly decreased and PDX-1 protein expression was declined(P<0.05);compared with non-adding Apelin group,the basic insulin secretion,secretion after stimulation and intracellular insulin in the adding Apelin high glucose group and extremely high glucose group were significantly decreased and PDX-1 protein expression was decreased(P<0.05);the insulin level in islet cells of 6 groups was positively correlated with PDX-1 protein expression and had no correlation with PDX-1 mRNA expression.Conclusion Apelin may participate in the glucose toxic effect by decreasing PDX-1 protein expression,causes the decrease of insulin secretion,thus plays a role in the pathogenesis of diabetes.
Apelin;pancreatic duodenal homeobox-1;glucose toxicity
��·基础研究
10.3969/j.issn.1671-8348.2016.33.008
广西壮族自治区卫生厅重点课题(桂卫重2010024)。 作者简介:黄炫赓(1980-),本科,主治医师,主要从事糖尿病及其并发症的研究工作。△
R587.1
A
1671-8348(2016)33-4633-03
2016-02-23
2016-06-11)

