响应面法优化鱼籽多肽酶解液脱色工艺
胡庆苹,魏鉴腾,裴 栋,王宁丽,刘晔玮,邸多隆
(1.兰州大学 公共卫生学院营养与食品卫生学研究所,甘肃兰州 730000;2.中国科学院兰州化学物理研究所中科院西北特色植物资源化学重点实验室和甘肃省天然药物重点实验室,甘肃兰州 730000;3.青岛市资源化学与新材料研究中心,山东青岛 266100)
响应面法优化鱼籽多肽酶解液脱色工艺
胡庆苹1,2,3,魏鉴腾2,3,裴 栋2,3,王宁丽2,3,刘晔玮1,*,邸多隆2,3
(1.兰州大学 公共卫生学院营养与食品卫生学研究所,甘肃兰州 730000;2.中国科学院兰州化学物理研究所中科院西北特色植物资源化学重点实验室和甘肃省天然药物重点实验室,甘肃兰州 730000;3.青岛市资源化学与新材料研究中心,山东青岛 266100)
采用活性炭对鱼籽多肽酶解液进行脱色,以脱色率和多肽回收率为评价指标,分别考察活性炭用量、时间、温度、pH对脱色效果的影响,在单因素实验的基础上,采用响应面法优化鱼籽多肽酶解液的脱色工艺。结果表明:鱼籽多肽最佳脱色工艺条件为10.5%(m/m)、时间41 min、温度55 ℃、pH2.8,在此条件下,脱色率77.51%±1.49%、多肽回收率82.26%±2.82%,与理论值差异不显著。该脱色工艺简单可靠,脱色效果好,多肽回收率高,为鱼籽多肽产品后期研发提供依据。
鱼籽多肽,脱色,响应面法,脱色率,多肽回收率
鱼籽是水产品加工中一种重要的副产物,富含蛋白质、多不饱和脂肪酸、钙、铁、维生素、胆固醇等营养物质,目前鱼籽主要用于食品加工,鱼子酱是其主要的食品成品,具有很高的营养价值,在欧洲国家有很大的需求[1-2]。鱼籽多肽是由鱼籽蛋白经酶解后得到的,以分子量小于3000 u的小分子肽为主的多肽混合物[3]。鱼籽酶解多肽具有良好的溶解性、乳化性能、脂肪吸附容量及起泡性能[4]。鱼籽多肽是一种生物活性肽,具有降血压、抗氧化、抗菌、提高免疫力等作用[5-6]。
鱼籽多肽酶解液呈棕黄色或褐色,易引起产品感官不适,不利于产品的深度研发。目前常用的脱色剂有活性炭、大孔树脂、复合吸附剂、强碱性阴离子树脂等[7]。活性炭是一种无序微孔结构,因其价格低廉,化学性质稳定,耐高温、耐酸碱,良好的吸附性能,比表面积大等优点在脱色工艺中广泛使用[8-9]。
本文采用实验室前期制备的鱼籽多肽酶解液样品,以活性炭为脱色剂,脱色率、多肽回收率为评价指标,考察影响活性炭对鱼籽多肽脱色效果的因素,并运用响应面法进行脱色工艺优化[10],以期为鱼籽多肽产品研发提供依据。
1 材料与方法
1.1 材料与仪器
鱼籽多肽酶解液 实验室自制[11];粉末活性炭;无水硫酸铜、浓硫酸、氢氧化钠、37%甲醛、乙酰丙酮、硫酸铵、对硝基苯酚、乙酸钠、乙酸等 国药集团化学试剂有限公司;去离子水 实验室自制。
TU-1810型紫外分光光度计 北京普析通用仪器有限责任公司;台式低速离心机 湖南湘仪离心机仪器有限公司;红外智能消化炉 上海沛欧分析仪器有限公司;HWS26型电热恒温水浴锅 上海一恒科学仪器有限公司;Sartorius PB-10 pH计 赛多利斯科学仪器有限公司;Sartorius BSA224S电子天平 赛多利斯科学仪器有限公司;电热鼓风干燥箱 上海一恒科学仪器有限公司等。
1.2 实验方法
1.2.1 工艺流程 鱼籽多肽酶解液→脱色→离心(4000 r/min,5 min)→0.45 μm微孔滤膜过滤→检测上清液。
1.2.2 脱色率 将鱼籽多肽酶解液在可见-紫外光谱200~900 nm进行全波长扫描,结果显示可见光区无吸收峰,但在380~760 nm范围内,吸光度逐渐减小。根据脱色前后多肽溶液均为橙黄色,故从溶液的互补色考虑[12-14],选择450 nm作为检测波长,在此波长下测定多肽溶液脱色前后吸光度值,并按下式计算溶液脱色率:
脱色率(%)=(A脱色前-A脱色后)/A脱色前×100
式(1)
1.2.3 多肽回收率 采用GB 5009.5-2010分光光度法检测脱色前后多肽溶液中多肽含量,按下式计算多肽回收率:
多肽回收率(%)=m脱色后/m脱色前×100
式(2)
1.2.4 单因素实验设计 分别考察活性炭用量、时间、温度、pH四个因素对鱼籽多肽酶解液脱色率、多肽回收率的影响,其水平见表1。通过查阅文献[15],结合实际生产成本等因素,将脱色初始温度设为50 ℃;在生产中,时间越短,成本越低,结合文献脱色时间[16],将脱色初始时间设为30 min;本实验中多肽酶解液初始pH为5.55,呈弱酸性,而活性炭在酸性条件下,脱色效果佳[17],结合降低生产成本等因素,故将脱色初始pH设为5.55。因此固定温度50 ℃,时间30 min,pH5.55,考察活性炭用量对脱色效果的影响;固定活性炭用量10%(m/m),温度50 ℃,pH5.55,考察时间对脱色效果的影响;固定活性炭用量10%(m/m),时间30 min,pH5.55,考察温度对脱色效果的影响;固定活性炭用量10%(m/m),温度50 ℃,时间30 min,考察pH对脱色效果的影响。
1.2.5 响应面法优化实验设计 根据单因素实验结果,采用Box-Behnken实验设计方法对鱼籽多肽溶液脱色进行4因素3水平设计[18-19],见表2,并采用Design Expert 8.0.6软件对实验数据进行分析处理。

表1 单因素实验因素及水平Table 1 Factors and levels of the single factor experiment
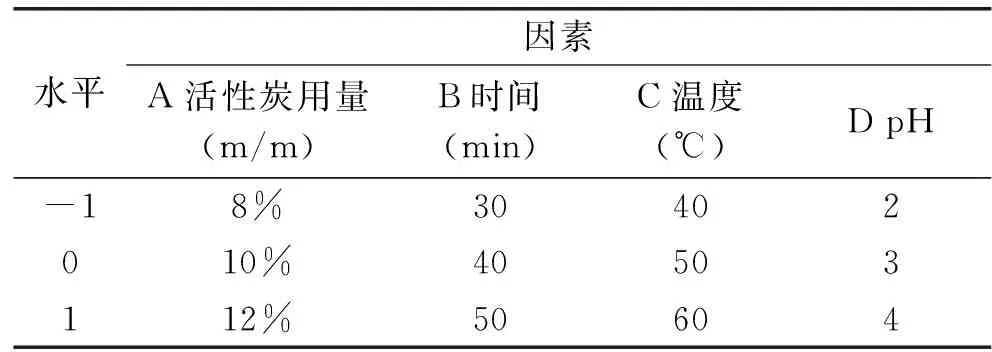
表2 响应面因素设计水平表Table 2 Factors and level value of response surface methodology
1.2.6 数据处理 采用SigmaPlot 12.5软件作图,Design-Expert 8.0.6软件进行方差分析。
2 结果与讨论
2.1 单因素实验结果
2.1.1 活性炭用量对脱色效果的影响 由图1可知,活性炭用量对鱼籽多肽样品的脱色效果影响显著。活性炭脱色属于物理脱色,其颗粒表面的空隙,可强烈吸附色素分子[20]。随着活性炭用量的增加,脱色率整体呈增加趋势,但当活性炭用量增加到12%时,脱色率减小,在8%~12%用量的范围内,脱色效果较好,结合多肽回收率,综合考虑选择10%活性炭用量。

图1 活性炭用量对脱色效果的影响Fig.1 Influence of activated carbon concentration on decoloring effect
2.1.2 脱色时间对脱色效果的影响 活性炭与色素分子接触需要一定的时间,但由于本实验中考察脱色时间因素时,温度定为50 ℃较高,分子运动加剧,由图2可知,作用时间超过20 min后,活性炭吸附可能发生解析[21]。但结合多肽回收率指标,40 min时脱色效果较好,脱色率68.97%、多肽回收率90.11%,因此选择脱色时间为40 min,这与戴丽君[22]等在正交实验优化大豆多肽脱色工艺中活性炭脱色时间40 min相同。

图2 脱色时间对脱色效果的影响Fig.2 Influence of time on decoloring effect
2.1.3 脱色温度对脱色率和肽回收率的影响 由图3可知,20~40 ℃内,脱色率缓慢升高,这是由于温度升高,分子运动加剧,色素分子更易于扩散到活性炭的空隙结构中,有利于吸附。当温度升高到50 ℃时,脱色率达62.56%,此时多肽回收率89.66%也相对较高,因此选择50 ℃作为最佳脱色温度,这与徐曼[15]等粉末活性炭脱色豆粕蛋白酶解液的条件优化中粉末活性炭脱色温度50 ℃相同。当温度达到50 ℃以上,脱色率先基本不变后反而降低,可能原因为温度过高,导致活性炭吸附发生解析,已吸附的色素分子又被释放出来。
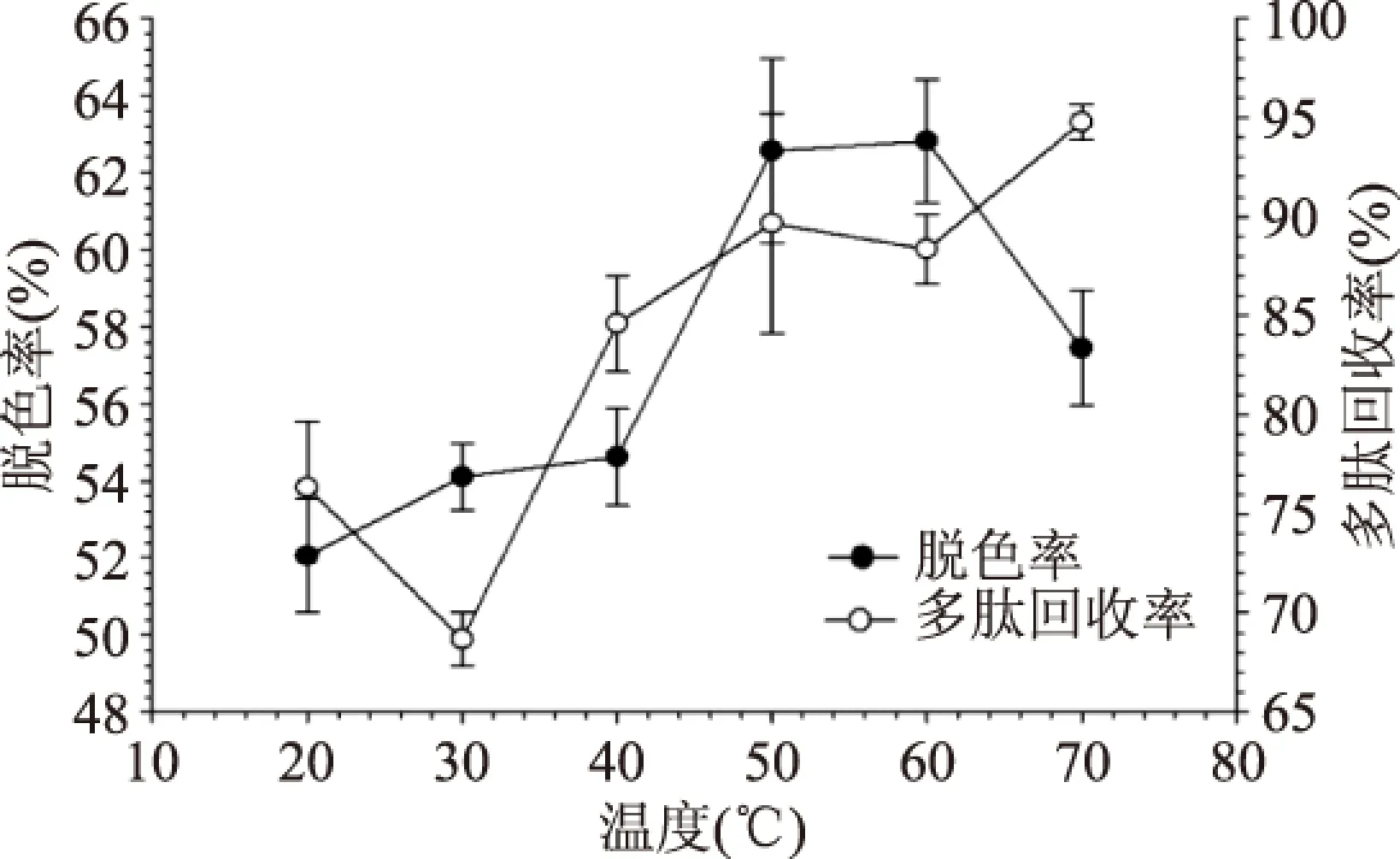
图3 脱色温度对脱色效果的影响Fig.3 Influence of temperature on decoloring effect
2.1.4 pH对脱色率和肽回收率的影响 活性炭吸附色素的过程需要H+的参与,适当提高样品中H+的浓度,可以提高脱色率[17]。由图4可知,pH对脱色效果影响较大,随着pH的增大,脱色率整体呈逐渐减小的趋势,在pH为2时脱色效果最佳,脱色率达78.97%,但此时多肽回收率85.08%,均较pH为3时(多肽回收率90.81%)低,综合脱色率、多肽回收率二因素考虑选择pH为3为最佳脱色pH,这与吕振雷[23]等在活性炭对紫贻贝蛋白酶解液脱色效果的影响中脱色pH为3相同。
2.2 响应面法优化鱼籽多肽脱色工艺
2.2.1 响应面优化实验结果 响应面优化实验结果见表3,方差分析结果见表4。由表4可知,以活性炭用量、时间、温度、pH为考察因素,以脱色率、多肽回收率为指标的响应面优化模型中,Y1、Y2差异极显著(p<0.01),其决定系数R2分别为0.9115、0.8254,且模型失拟项均无显著性差异(p>0.01),表明鱼籽多肽酶解液的脱色效果的实验值与拟合值之间的拟合度较好,Y1、Y2的二次模型合适。
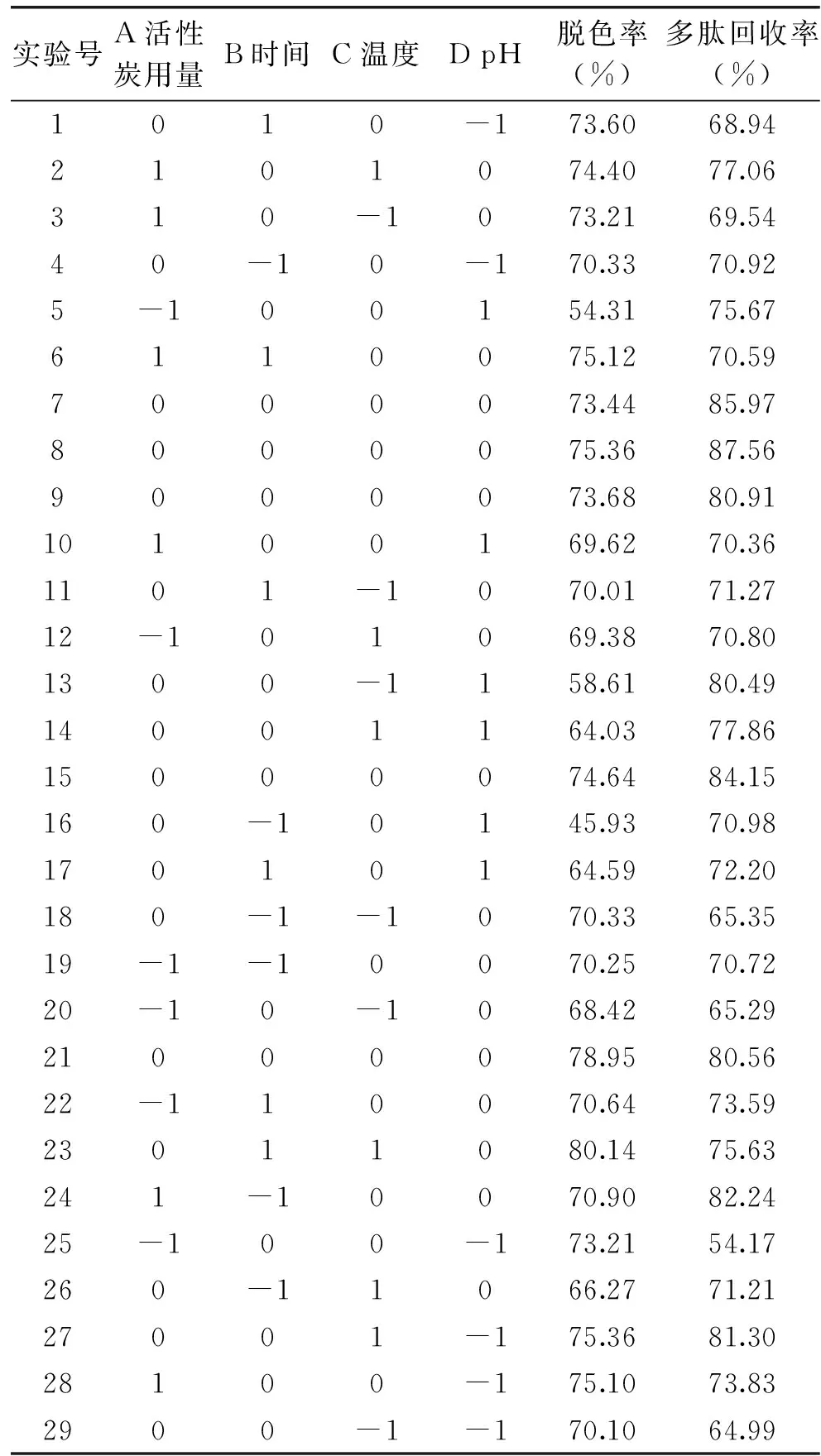
表3 响应面优化实验结果Table 3 Results of response surface experiments
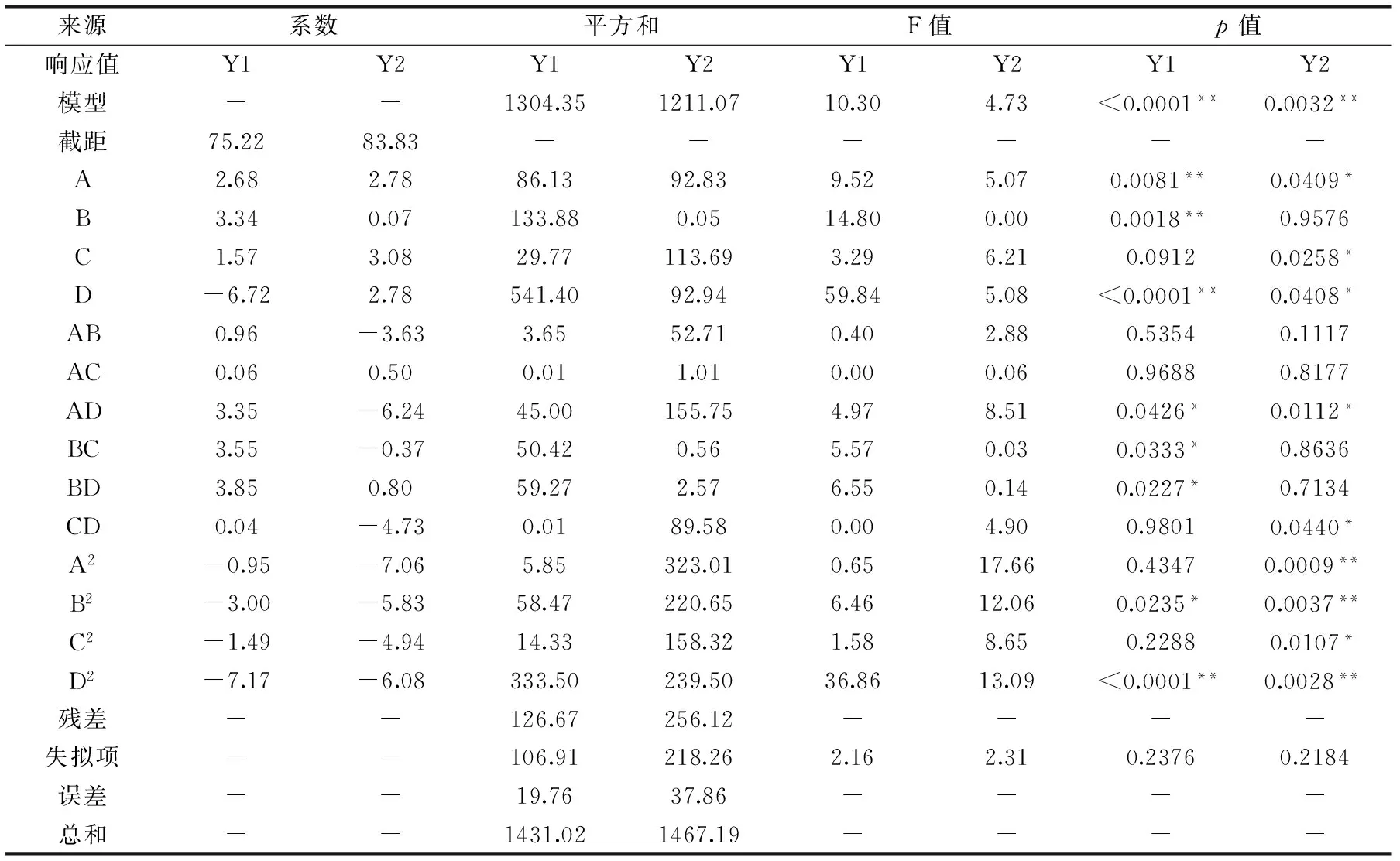
表4 回归模型的方差Table 4 Variance analysis of regression model
注:**:差异极显著(p<0.01);*:差异显著(p<0.05);Y1:脱色率;Y2:多肽回收率。 由方差分析结果(表4)可知,Y1的A、B、D、AD、BC、BD、B2、D2对鱼籽多肽酶解液的脱色率影响显著,其中一次项中对脱色率影响显著的顺序为D>B>A;Y2的A、C、D、AD、CD、A2、B2、C2、D2对鱼籽多肽酶解液的多肽回收率影响显著,其中一次项中对多肽回收率影响显著的顺序为C>D>A。
拟合后,可以建立关于活性炭用量、时间、温度以及pH的二次多项式回归模型,分别为:
Y1(%)=75.22+2.68A+3.34B+1.57C-6.72D+0.96AB+0.060AC+3.35AD+3.55BC+3.85BD+0.038CD-0.95A2-3.00B2-1.49C2-7.17D2
Y2(%)=83.83+2.78A+0.07B+3.08C+2.78D-3.63AB+0.50AC-6.24AD-0.37BC+0.80BD-4.73CD-7.06A2-5.83B2-4.94C2-6.08D2
2.2.2 双因素间交互作用影响 由表4可知,活性炭用量与pH、时间与温度、时间与pH之间的交互作用对脱色率的影响显著,分别见图5a及5b、5c及5d、5e及5f。由图5a和5b可知,当时间与温度处于最佳水平时,固定pH,随着活性炭用量的增加,脱色率缓慢增加,但增幅不是很明显;固定活性炭用量,随着pH的增加,脱色率呈减小趋势,降幅明显。由图5c和5d可知,当活性炭用量和pH处于最佳水平时,固定其中一个因素,随着各一个因素的增加,脱色率均呈增加趋势,但增幅不是很明显。由图5e和5f可知,当活性炭用量和温度处于最佳水平时,固定脱色时间,随着pH的增大,脱色率逐渐减小;固定pH,随着脱色时间的增加,脱色率呈增加趋势,但增幅不明显。
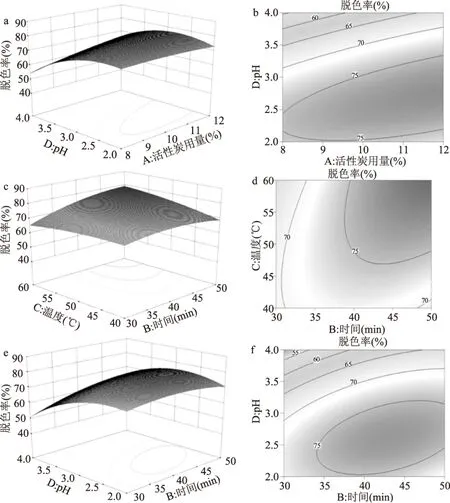
图5 脱色率响应曲面图和等高线图Fig.5 The response surface and contour plots of the decoloring rate
由表4可知,活性炭用量与pH,温度与pH之间的交互作用对多肽回收率的影响显著,分别见图6a和6b、6c和6d。由图6a和6b可知,当时间与温度处于最佳水平时,固定活性炭用量,随着pH的增加,多肽回收率呈增加趋势,整体呈先大幅增加,后趋于平缓;固定pH时,随着活性炭用量的增加,多肽回收率先增加,后趋于平缓。由图6c和6d可知,当活性炭用量和时间处于最佳水平时,固定温度,随着pH的增加,多肽回收率呈逐渐增加趋势,后趋于平缓;固定pH,随着温度的增加,多肽回收率呈增加趋势,后趋于平缓。

图6 多肽回收率响应曲面图和等高线图Fig.6 The response surface and contour plots of the peptide retention rate
2.2.3 鱼籽多肽酶解液脱色条件的确定及优化工艺条件验证 经Box-Behnken实验设计,Design Expert 8.0.6对实验数据进行分析处理后,得到鱼籽多肽溶液脱色的最优工艺条件为:活性炭用量10.75%、时间41.47 min、温度55.02 ℃、pH2.75,此条件下,脱色率为78.02%、多肽回收率为84.01%。为方便实际操作,将最佳脱色条件调整为活性炭用量10.5%、时间41 min、温度55 ℃、pH2.8,在此最优条件下进行三次平行验证实验,结果为脱色率为77.51%±1.49%、多肽回收率为82.26%±2.82%,可以证明模型可靠。
3 结论
采用响应面法优化鱼籽多肽脱色工艺,以鱼籽多肽酶解液为原液,以脱色率、多肽回收率为检测指标,考察活性炭用量、时间、温度、pH对鱼籽多肽酶解液脱色效果的影响,以得到鱼籽多肽最佳脱色工艺。在单因素实验的基础上,采用Box-Behnken实验设计方法对鱼籽多肽溶液脱色进行4因素3水平设计,并采用Design Expert 8.0.6对实验数据进行分析处理。实验结果表明,活性炭用量、pH对脱色率、多肽回收率均具有显著影响,脱色时间对脱色率具有显著影响,脱色温度对多肽回收率具有显著影响;活性炭用量与pH之间的交互作用对两者均具有显著影响,脱色时间与温度、脱色时间与pH之间的交互作用对脱色率具有显著影响,温度与pH之间的交互作用对多肽回收率具有显著影响。响应面法优化脱色工艺最有条件为活性炭用量10.5%、时间41 min、温度55 ℃、pH2.8,此条件下,脱色率、多肽回收率理论值分别为78.02%、84.01%。三次平行验证实验结果为脱色率77.51%±1.49%、多肽回收率82.26%±2.82%,与理论值接近,模型可靠。该脱色工艺简单可靠,脱色效果好,多肽回收率高,为鱼籽多肽产品后期研发提供依据。
[1]Ovissipour M,Al-Qadiri H M,Lu X,et al. The effect of white sturgeon(Acipenser transmontanus)ovarian fat deposition on caviar yield and nutritional quality:introducing image processing method for sturgeon ovary fat determination[J]. International Aquatic Research. 2015,7(4):263-272.
[2]Sepalika J,Thushari G,NPP L. Production of simulated caviar using Bigeye Tuna(Thunnus obesus)roe:Pilot scale study to promote fish roe based value addition sector in Sri Lanka[J]. International Journal of Scientific and Research Publications. 2015,5(3):1-6.
[3]Intarasirisawat R,Benjakul S,Visessanguan W,et al. Antioxidative and functional properties of protein hydrolysate from defatted skipjack(Katsuwonous pelamis)roe[J]. Food Chem.2012,135(4):3039-48.
[4]Intarasirisawat R,Benjakul S,Visessanguan W. Chemical compositions of the roes from skipjack,tongol and bonito[J]. Food Chemistry.2011,124(4):1328-1334.
[5]王导,朱翠凤. 海洋生物活性肽的生理活性研究进展[J]. 医学综述. 2011,17(05):661-663.
[6]张岩,吴燕燕,李来好,等. 酶法制备海洋活性肽及其功能活性研究进展[J]. 生物技术通报. 2012,(03):42-48.
[7]李锦,许伟,邵荣,等. 响应面法优化灰兜巴多肽脱色工艺[J]. 食品工业科技. 2015,36(13):199-204+208.
[8]张毅,华欲飞,孔祥珍,等. 活性炭对大豆多肽脱色效果的
研究[J]. 粮食与饲料工业. 2010,(08):31-33.
[9]Alslaibi T,Abustan I,Ahmad M,et al. A review:production of activated carbon from agricultural byproducts via conventional and microwave heating[J]. Journal of Chemical Technology & Biotechnology. 2013,88(7):1183-1190.
[10]张崟,王卫,张佳敏,等. 响应面法和正交实验对骨素酶解工艺优化的比较[J]. 食品研究与开发. 2012,33(07):53-56.
[11]魏鉴腾,刘永峰,刘毅,等. 酶解法制备鱼籽多肽的工艺研究[J]. 食品工业. 2015,36(01):71-74.
[12]陈宝,张立颖,沈芳,等. 迷迭香多糖活性炭脱色工艺研究[J]. 应用化工. 2012,41(07):1208-1210.
[13]孟江,周毅生,廖华卫. 鱼腥草多糖活性炭脱色工艺研究[J]. 食品与发酵工业. 2009,35(02):112-115.
[14]罗玺,唐庆九,张劲松,等. 灵芝多糖树脂法脱色工艺优化[J]. 食品科学. 2011,32(16):5-10.
[15]徐曼,马寒冰,李铮,等. 粉末活性炭脱色豆粕蛋白酶解液的条件优化[J]. 食品工业科技. 2013,34(11):263-266.
[16]李江萍,庞谢辉. 正交实验优化白芷多糖的活性炭脱色工艺研究[J]. 现代药物与临床. 2012,27(4):366-369.
[17]魏连会,阮长青. 响应面法优化酱油中多肽的脱色工艺[J]. 食品工业科技. 2013,34(10):235-238+242.
[18]白雪,李丹凤,王婷婷,等. 发酵法制备生物活性肽及其产物的初步分析[J]. 食品工业科技. 2013,(23):201-205,210.
[19]赵强,索有瑞,李天才,等. 响应面法优化苦荞皮中总黄酮超声波提取工艺[J]. 食品科学. 2014,35(16):64-70.
[20]张丽红,谢三都,徐芳,等. 紫苏叶多糖活性炭脱色工艺优化[J]. 食品与机械. 2015,31(03):224-230+241.
[21]单春乔,赵红岩,崔丽,等. 生物活性肽生理作用及功能研究[J]. 粮食与油脂. 2011,(04):15-17.
[22]戴丽君,梁运祥. 正交实验优化大豆多肽脱色工艺[J]. 食品科学. 2013,34(12):90-94.
[23]吕振磊,王雨生,修方珑,等. 活性炭对紫贻贝蛋白酶解液脱色效果的影响[J]. 食品与机械. 2012,28(03):32-35,44.
Optimization of decoloring process of enzymatic hydrolysate of fish roes peptide by response surface methodology
HU Qing-ping1,2,3,WEI Jian-teng2,3,PEI Dong2,3,WANG Ning-li2,3,LIU Ye-wei1,*,DI Duo-long2,3
(1.Institute of Nutrition and Food Hygiene,faculty of Public Health,Lanzhou University,Lanzhou 730000,China;2.Key Laboratory of Chemistry of Northwestern Plant Resources and Key Laboratory for Natural Medicine of Gansu Province,Lanzhou Institute of Chemical Physics,Chinese Academy of Sciences,Lanzhou 730000,China;3.Center of Resource Chemical & New Material,Qingdao,Qingdao 266100,China)
Enzymatichydrolysateoffishroespeptidewasdecoloredbyactivatedcarbon.Theeffectofthedoseofactivatedcarbon,time,temperatureandpHonthedecoloringwasinvestigatedbydecoloringrateandpeptideretentionratedetected.Basedontheresultsofsinglefactorexperiments,thedecoloringprocesswasoptimizedbyresponsesurfacemethodology.Theresultsshowedthattheoptimalconditionswereasfollows:theamountofactivatedcarbon10.5%(m/m),time41min,temperature55 ℃,pH2.8.Underthisoptimalconditions,thedecoloringratewas77.51%±1.49%,thepeptideretentionratewas82.26%±2.82%whichwasnotsignificantwiththetheoreticalvalue.Thedecoloringprocesswassimple,reliable,highpeptideretentionrateandhighdecoloringrate.Theresultswouldprovideatheoreticalfoundationforthedevelopmentoffishroespeptide.
fishroespeptide;decoloring;responsesurfacemethodology;thedecoloringrate;thepeptideretentionrate
2016-05-30
胡庆苹(1989-),女,硕士研究生,研究方向:天然产物研究与开发,E-mail:huqp14@lzu.edu.cn。
*通讯作者:刘晔玮(1962-),女,硕士,教授,研究方向:天然产物研究与开发,E-mail:liuyw@lzu.edu.cn。
国家高技术研究发展计划(863计划)(2014AA022203);国家自然科学基金(21505143);青岛市民生计划(15-8-2-6-hy)。
TS254.9
B
1002-0306(2016)21-0189-06
10.13386/j.issn1002-0306.2016.21.028

