褐飞虱在不同水稻品系上繁殖能力及相关解毒酶系基因表达变化分析
俞姗姗, 刘 雅, 杨萌萌, 沈祺达, 谢国强, 王世贵, 唐 斌
(杭州师范大学生命与环境科学学院,浙江 杭州 310036)
褐飞虱在不同水稻品系上繁殖能力及相关解毒酶系基因表达变化分析
俞姗姗, 刘 雅, 杨萌萌, 沈祺达, 谢国强, 王世贵, 唐 斌
(杭州师范大学生命与环境科学学院,浙江 杭州 310036)
采用水稻敏感品系TN1和抗性品系中浙优、IR56饲养褐飞虱,研究褐飞虱产卵量等繁殖情况,测定解毒酶系中酯酶、细胞色素P450和谷胱甘肽转移酶(GST)及卵黄原蛋白(Vg)等基因在mRNA上的表达变化.结果显示褐飞虱在抗性水稻上产卵量减少,Vg2的表达量极显著下降,表明水稻抗性对褐飞虱的产卵量有抑制作用且Vg2调控产卵.酯酶和P450中的部分基因均在取食抗性水稻的褐飞虱体内表达量较高,存在极显著差异.
褐飞虱;抗性;解毒酶系;生化反应
褐飞虱Nilaparvatalugens,属同翅目,飞虱科,广泛分布于南亚、东南亚、太平洋岛屿等地区,中国各稻区均有分布[1].褐飞虱是一种为害水稻茎鞘的单食性害虫,通过口针刺吸稻株韧皮部的汁液对水稻造成直接危害[2-3].该虫具有繁殖速度快、生命周期短、内禀增长率高、环境适应性强等特点,在外界环境适宜时极易引发灾害,造成水稻的巨大损失[4].由于化学防治会产生成本高、农产品农药残留量超标、农田环境污染以及违背自然规律等副作用,科学家将目光转向对水稻抗虫性的研究.大量实践表明利用抗性品系是防治褐飞虱最经济、有效和安全的手段.本实验选用TN1(感虫系)、中浙优(测试系)和IR56(抗虫系)3种水稻品系研究不同水稻对褐飞虱的抗性,探索褐飞虱的反防御作用.通过分析褐飞虱在不同抗性水稻上的生化指标变化,研究褐飞虱对不同水稻品系的作用,从而为培育新抗逆品系的水稻奠定基础.
1 材料与方法
1.1 实验材料
1.1.1 供试水稻
敏感品系TN1、抗性品系中浙优及IR56种子由中国水稻研究所提供.水稻苗在人工气候箱中培育,温度(25±1) ℃、相对湿度(70±5)%、光强10 000 lux、光周期14 L∶10 D.
1.1.2 供试昆虫
褐飞虱来自本实验室长期饲养种群.饲养方法为:取TN1水稻大苗,修剪枝叶,保留水稻秆,用湿棉花包扎根部,将其放入透明玻璃管(深度×管口直径为250 mm×30 mm)内.将褐飞虱接到水稻苗上,放入人工气候箱内,设置温度(25±1) ℃、相对湿度(70±5)%、光强 10 000 lux、光周期14 L∶10 D.
1.2 实验方法
1.2.1 不同水稻品系上褐飞虱的产卵量
将供试稻苗根部用脱脂棉包裹,浸水稻培养液,置于透明玻璃管(深度×管口直径为250 mm×30 mm)中,接入处于孕期的褐飞虱(羽化后3 d),每管5头.用纱布封口,以防止试虫逃逸,将试管置于人工气候箱内,条件同1.1.2.每天按时更换新鲜水稻苗,并在解剖镜下观察产卵痕,记录落卵量.移出的成虫接入到试管内相应的新水稻苗上,饲养至死亡,每天记录产卵量.
1.2.2 褐飞虱总RNA的抽提(Trizol法)
取9管1.5 mL离心管,分别取取食TN1、中浙优、IR56水稻7 d的褐飞虱各3管,每管5~10头;将离心管置于冰上,每管加入100 μL Trizol,电动匀浆器充分研磨;补足Trizol至1 mL,用力振荡3 min,室温静置8 min;4 ℃,12 000 r/min离心15 min;转移上清至新的1.5 mL离心管,加入500 μL异丙醇,上下颠倒混匀,室温静置20 min;4 ℃,12 000 r/min离心10 min;轻轻倒去上清液,加入1 mL 75%的乙醇,将沉淀吹离管壁,洗涤沉淀;4 ℃,7 500 r/min离心5 min;轻轻倒去上清液,将离心管倒置在超净台3~5 min,用移液器吸出多余液体,加入30~50 μL DEPC处理水溶解沉淀,吹倒混匀;各取1 μL RNA分别用于超微量核酸蛋白测定仪浓度检测和电泳检测.
1.2.3 褐飞虱抗性基因的筛选
参考相关文献,并根据本实验室前期测定的转录组数据,筛选出合适的CYP6、CYP4等P450基因家族[5-8]、酯酶基因家族、卵黄原蛋白[9-10]等基因作为mRNA水平检测的备选靶标基因.
1.2.4 褐飞虱抗性基因的引物设计与合成
选择actin作为内参基因,根据抗性基因的筛选,确定NLGST、NLAChE1、NLAChE2、CYP6CW1、CYP417A1、NLVg2、NLVg1这7个基因为褐飞虱抗性基因,利用DNA Star和PrimerPrimer5软件设计定量引物,引物除遵循普通引物的设计原则外,3’端还需避开T及需要在整个基因序列中检索它的特异性,具体见表1.扩增片段长度均在100~250 bp间,引物由上海Invitrogen公司合成.

表1 褐飞虱7个基因和actin的引物序列
1.2.5 cDNA第一链的合成
首先利用NanoDropTM2000测定抽提的总RNA浓度,根据PrimeScript®RT reagent Kit With gDNA Eraser 反应体系计算需加入的RNA 体积,然后根据PrimeScript®RT reagent Kit With gDNA Eraser反转录试剂盒说明进行cDNA 第一链的反转录.
1.2.6 实时荧光定量PCR及数据分析
实验前先对引物(表1)进行特异性、浓度和退火温度的摸索,得到最适温度和最适量.每管cDNA做3个定量重复孔.实验反应程序为95 ℃预变性3 min;95 ℃变性5 s,然后55~60 ℃退火延伸25 s(循环40次,不同引物最适Tm值不同);最后绘制65~95 ℃溶解曲线.通过定量PCR测定出6个基因的CT值,每管样品的3个重复孔取平均值用于计算.每次样品有3组数值,即最后得到的数据为平均值±标准误.再通过2-△△CT法进行计算,公式为:2-△△CT= 2-[(CT对照组-CT对照actin)- (CT待测组-CT待测组actin)](对照组为TN1水稻上褐飞虱的CT值).
1.2.7 数据分析
Excel整理数据,利用SPSS13.0进行方差分析并用Ducan法进行多重比较,最后用SigmaPlot10.0作图.
2 结果与分析
2.1 不同水稻品系上褐飞虱的产卵量
3种不同水稻品系中,褐飞虱在TN1上每天产卵多且比较均匀,而在中浙优上显示为先下降后上升的趋势,IR56品系上褐飞虱的产卵量呈下降趋势(图1A).统计总产卵量显示IR56水稻上褐飞虱总产卵量极显著低于中浙优和TN1水稻(P<0.01)(图1B).
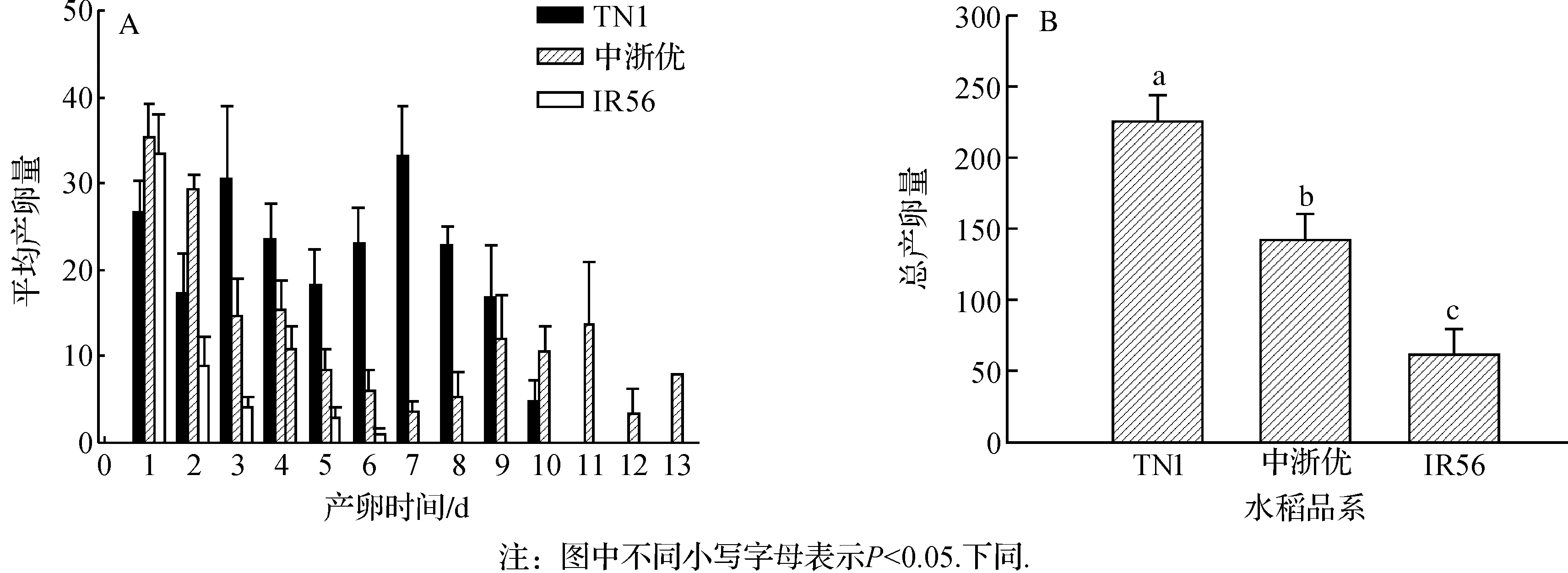
图1 不同水稻品系上褐飞虱的产卵量Fig. 1 The fecundity of Nilaparvata lugens in different rice lines
2.2 褐飞虱体内Vg蛋白的表达分析
卵黄原蛋白是雌虫特有的蛋白,以取食TN1水稻的褐飞虱体内Vg1的表达量为基准,取食中浙优、IR56的褐飞虱体内Vg1的表达量分别为在TN1上取食的1.91、6.88倍,IR56上的表达量显著高于中浙优(图2).但取食中浙优和IR56的褐飞虱体内Vg2的表达量仅占取食TN1的褐飞虱的27.40%和2.10%.
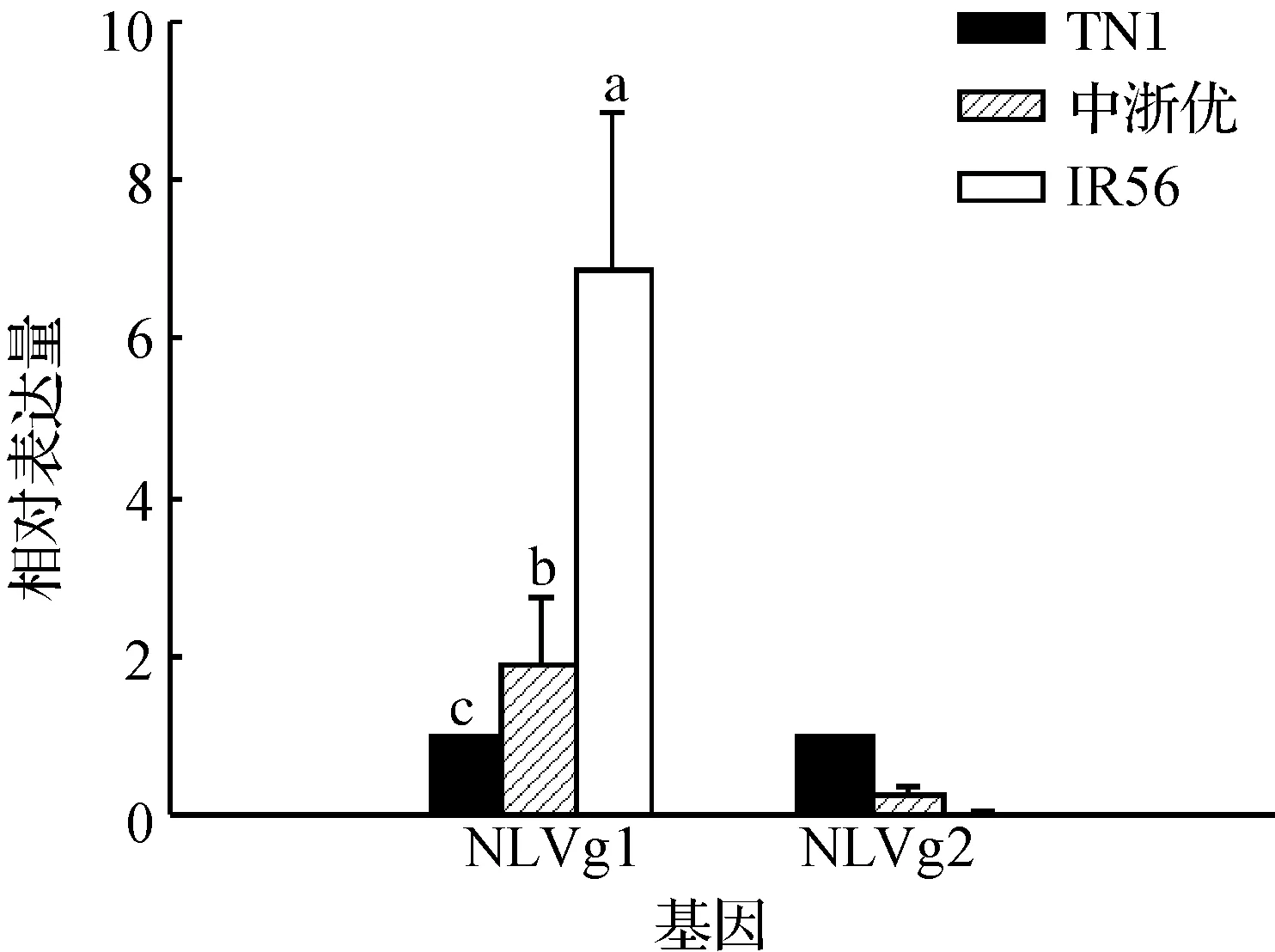
图2 褐飞虱体内Vg蛋白的表达量Fig. 2 The expression quantity of Vg proteins in Nilaparvata lugens
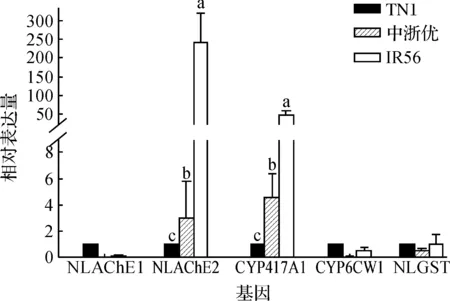
图3 褐飞虱体内酯酶、P450和GST的表达量Fig. 3 The expression quantity of esterase,P450 and GST in Nilaparvata lugens
2.3 褐飞虱体内酯酶、P450和GST表达分析
不同的水稻品系能够影响褐飞虱体内的代谢酶系和海藻糖代谢酶系在mRNA水平上的表达.以取食TN1褐飞虱体内的相关基因表达量为基准,研究结果表明褐飞虱取食IR56抗性品系后NLAChE2、CYP417A1的表达量极显著高于取食中浙优水稻后的表达量(P<0.01),且取食中浙优水稻的褐飞虱体内的表达量分别为取食TN1水稻的褐飞虱的243.12和47.78倍(图3).取食IR56和中浙优水稻的褐飞虱NLAChE1、CYP6CW1和NLGST表达量均低于取食TN1水稻的表达量.取食IR56的褐飞虱体内NLAChE1、CYP6CW1和NLGST表达量仅占取食TN1的褐飞虱的10.10%、52.33%和97.20%.
3 讨 论
根据已有研究,不同品系的水稻体内存在的物质有一定的差距[5,11],对褐飞虱繁殖产生的影响也不相同[12-14].本实验中褐飞虱在IR56水稻上的产卵量总体上最少,中浙优次之,水稻品系抗性与其上褐飞虱的产卵量呈负相关,这与罗海平[15]的研究结果一致,表明水稻抗性对褐飞虱的产卵量有抑制作用.
为研究褐飞虱在不同抗性水稻中的基因表达差异,笔者以TN1水稻为对照组,通过荧光定量PCR检测卵黄原蛋白、乙酰胆碱酯酶、细胞色素P450和GST的表达量.卵黄原蛋白是雌虫特有的蛋白,主要在脂肪体中合成,而后运输到生长的卵母细胞中[16-17].卵黄原蛋白不是一种单一形式的蛋白,而是由若干基因编码的相关蛋白组成的一个家族.它不仅可为正在发育的胚胎提供氨基酸、脂肪、糖水化合物、磷和硫等营养和功能性物质,还能促进培养中的动物卵母细胞的生长和分化[18].本实验中,取食抗性水稻中浙优和IR56的褐飞虱体内NLVg1的表达量显著上升,推测可能是褐飞虱对抗性水稻适应的结果;而取食中浙优和IR56的褐飞虱体内NLVg2的表达量下降,结合褐飞虱产卵量研究,说明NLVg2对褐飞虱的产卵量有调控作用.酯酶是能水解内源和外源酯类化合物的所有酶的通称,是一类能催化裂解酯键的水解酶, 主要作用是解毒、分解外源有毒有害物质.实验结果显示在取食两种抗性品系水稻的褐飞虱体内NLAChE1表达显著低于敏感品系,而NLAChE2表达量却极显著高于敏感品系.这表明,不同酯酶基因在褐飞虱适应不同水稻品种过程中可能有着不同的作用,即褐飞虱酯酶对水稻寄主的适应是不同酯酶基因综合作用的结果,这与郭燕[19]的研究结果一致.酯酶类型多样,抗性品系对其产生的影响可能有所不同[20].细胞色素单氧化酶P450为一类亚铁血红素一硫醇盐蛋白的超家族,它参与内源物质和外源性物质的代谢,与昆虫的发育相关.相关文献表明P450酶系介导的外源解毒是由相应的P450基因表达增强造成的.昆虫可以利用P450对植物毒素进行代谢解毒,以植物代谢中间物为原料合成自身活性物质.相关研究表明,用抗性水稻饲养褐飞虱后,CYP6AX1、CYP6AY1、CYP6CW1和CYP6CS1基因在褐飞虱中肠表达明显上调,表明这些基因在褐飞虱抵抗抗性水稻中发挥了重要作用[21].本研究结果显示P450酶系中的CYP417A1在取食中浙优与IR56的褐飞虱体内表达量极显著上升,且存在极显著差异(图3),由此说明CYP417A1在褐飞虱抵抗抗性水稻中有重要的作用.而另一个P450基因CYP6CW1的表达在抗性品系中降低,中浙优与TN1比较存在极显著差异,这可能与检测时褐飞虱取食后的时间太长有关.谷胱甘肽转移酶(GST)是一类分布于生物体的多功能酶系,通过运输或代谢外源和内源的化合物如激素、植物次生化合物、杀虫剂等,对机体的解毒、激素调控、抗氧化等具有重要的作用[22-24].实验结果表明取食敏感品系与抗性品系水稻的褐飞虱,其体内GST的表达无显著差异,说明水稻抗性对褐飞虱体内GST的影响不大,其机制有待进一步的研究.
综上,本实验发现褐飞虱在抗性水稻上的产卵量和Vg2的表达量相对于敏感品系明显减少,水稻抗性抑制褐飞虱的产卵并且Vg2调控褐飞虱产卵.取食抗性水稻的褐飞虱体内Vg1的表达量显著上升,推测可能是褐飞虱对抗性水稻适应的结果.取食抗性水稻的褐飞虱其体内的NLAChE1表达量显著低于敏感品系,而NLAChE2表达量显著高于敏感品系,表明褐飞虱乙酰胆碱酯酶对水稻寄主的适应是不同酯酶基因综合作用的结果.细胞色素P450中CYP417A1在取食抗性水稻的褐飞虱体内表达量极显著上升,表明其在褐飞虱抵抗抗性水稻中发挥了重要作用.谷胱甘肽转移酶在褐飞虱抗性上也有一定的作用,但其机制有待研究.这些研究结果为探究褐飞虱抵抗不同抗性水稻品系的生理和分子机理提供了理论依据,也为培育良好的抗性水稻抵抗褐飞虱危害奠定基础.
[1] 余德涛.褐飞虱的生物学特征及鉴别[J].农技服务,2007,24(2):45-46.
[2] 赵颖,黄凤宽,童晓立,等.水稻品种对褐飞虱不同生物型抗性的HPLC分析[J].华南农业大学学报,2005,26(2):52-55.
[3] WANG Y C, TANG M, HAO P Y, et al. Penetration into rice tissues by brown planthopper and fine structure of the salivary sheaths[J]. Entomologia Experimentalis et Applicata,2008,129(3):295-307.
[4] 丁识伯,曾铮,闫凤鸣,等.褐飞虱在九个水稻品种上的生长发育和生命表参数[J].植物保护学报,2012,39(4):334-340.
[5] YANG Z, ZHANG Y, LIU X, et al. Two novel cytochrome P450 genes CYP6CS1 and CYP6CW1 fromNilaparvatalugens(Hemiptera: Delphacidae): cDNA cloning and induction by host resistant rice[J]. Bulletin of Entomological Research,2011,101(1):73-80.
[6] PRIDGEON J W, ZHANG L, LIU N N. Overexpression of CYP4G19 associated with a pyrethroid-resistant strain of the German cockroach,Blattellagermanica[J].Gene,2003,314:157-163.
[7] 杨之帆.褐飞虱对水稻品种抗性的分子反应和相关cDNA的克隆[D].武汉:武汉大学,2005.
[8] YANG Z F,YANG H Y,HE G C. Cloning and characterization of two cytochrome P450 CYP6AX1, CYP6AY1 cDNAs fromNilaparvatalugens(Stål)(Homoptera:Delphacidae)[J]. Archives of Insect Biochemistry and Physiology,2007,64(2):88-99.
[9] TUFAIL M, TAKEDA M. Insect vitellogenin/lipophorin receptors: molecular structures, role in oogenesis, and regulatory mechanisms[J]. Journal of Insect Physiology,2009,55(2):87-103.
[10] CHENG D J, HOU R F. Determination and distribution of a female-specific protein in the brown planthopper,NilaparvatalugensStål (Homoptera: Delphacidae)[J]. Tissue and Cell,2005,37(1):37-45.
[11] 董红霞,王敬淑,刘光华,等.植物次生化合物在害虫防治中的作用[J].仲恺农业技术学院学报,2005,18(2):65-71.
[12] 李洁.抗虫水稻对褐飞虱抗性研究及褐飞虱apterousA基因的功能研究[D].武汉:华中农业大学,2013.
[13] 陈建明.水稻品种对褐飞虱为害的耐性及其生理机制研究[D].杭州:浙江大学,2004.
[14] 商科科.水稻新材料对褐飞虱的抗性及褐飞虱适应性变化[D].武汉:华中农业大学,2012.
[15] 罗海平.不同水稻品种对褐飞虱的抗性反应及生理生化机理研究[D].长沙:湖南农业大学,2008.
[16] 汪明明,黄家兴,吴杰,等.昆虫卵黄原蛋白受体的研究进展[J].昆虫知识,2010,47(4):626-632.
[17] ZHAI Y F, ZHANG J Q, SUN Z X, et al. Proteomic and transcriptomic analyses of fecundity in the brown planthopperNilaparvatalugens(Stål)[J]. Journal of Proteome Research,2013,12(11):5199-5212.
[18] 张年国,张颖,孙大江,等.卵黄蛋白原的发生、结构及功能研究现状[J].水产学杂志,2007,20(1):97-106.
[19] 郭燕.褐飞虱酯酶基因在对环境适应中的差异表达研究[D].杭州:浙江大学,2012.
[20] 周亦红,韩召军,张小敏,等.水稻品种对褐飞虱代谢酶的影响[J].南京农业大学学报,2003,26(2):24-28.
[21] 赵东.褐飞虱细胞色素单氧化酶P450和羧酸酯基因家族的进化及功能分析[D].杭州:浙江大学,2013.
[22] 蔡群芳,邬强.谷胱甘肽转移酶的研究进展[J].海南医学院学报,2011,17(12):1735-1738.
[23] ENAYATI A A, RANSON H, HEMINGWAY J. Insect glutathione transferases and insecticide resistance[J]. Insect Molecular Biology,2005,14(1):3-8.
[24] LI X C, SCHULER M A, BERENBAUM M R. Molecular mechanisms of metabolic resistance to synthetic and natural xenobiotics[J]. Annual Review of Entomology,2007,52:231-253.
On the Fertility and Related Detoxification Enzyme Systems Gene Expression ofNilaparvatalugensFeeding on Different Rice Varieties
YU Shanshan, LIU Ya, YANG Mengmeng, SHEN Qida, XIE Guoqiang, WANG Shigui, TANG Bin
(College of Life and Environmental Sciences, Hangzhou Normal University, Hangzhou 310036, China)
This experiment adopts the TN1 sensitive rice varieties and other different levels of resistance rice cultivars, such as Zhongzheyou and IR56, to breedN.lugens, and then use a part of thoseN.lugensto studyN.lugensspawning and other breeding situations, and determines the expression changes of esterase, cytochrome P450, Glutathione transferase(GST), vitellogenin(Vg) on mRNA. The results show that the fecundity ofN.lugensreduces on resistance rice, and the expression of Vg2 decreases significantly, which indicates resistance rice has inhibitory effect onN.lugensfecundity and Vg2 regulate the spawning. Part genes of esterase and P450 have high expression in the resistance riceN.lugensbody, which have significant differences.
Nilaparvatalugens; resistance; detoxification enzymes; biochemical responses
2016-04-12
国家自然科学基金项目(31371996);杭州市科技局计划项目(20140432B01);浙江省大学生科技创新活动计划暨新苗人才计划项目(2015R423043);杭州师范大学“本科生创新能力提升工程”计划项目(CX2014088).
唐 斌(1980—),男,副研究员,博士,主要从事昆虫生理生化与分子生物学及植物害虫生物防治研究.E-mail:tbzm611@163.com
10.3969/j.issn.1674-232X.2016.06.007
S435.112+.3
A
1674-232X(2016)06-0595-05

