静脉药物配置中心配置过程中5-氟尿嘧啶残留污染监测
周利琼,吴 艳,白 浩,万 莉,罗叶昕,黄 也
(重庆市肿瘤医院 药学部静脉配置中心,重庆400030)
静脉药物配置中心配置过程中5-氟尿嘧啶残留污染监测
周利琼,吴 艳,白 浩,万 莉,罗叶昕,黄 也
(重庆市肿瘤医院 药学部静脉配置中心,重庆400030)
目的建立适合静脉配置中心监测配置5-氟尿嘧啶过程中药物残留的检测方法,为制定细胞毒药物集中配置的有效个人防护措施提供参考依据。方法本实验选取了手套(内层和外层)、口罩(内层和外层)、腹前纱布和配置环境空气,采用甲醇-水混合溶剂洗涤吸收,通过旋转蒸馏法提取浓缩,高效液相色谱法检测。色谱柱为symmetry C18柱(150 mm×3.9 mm,5 μm)。检测波长为265 nm,流动相为甲醇-水(体积比10:90),流速为1.0 mL/min。结果5-氟尿嘧啶的最低检测限为0.1 μg/mL,峰面积与样品浓度呈线性关系(R2=0.999),样本回收率为97.88%。外层手套和口罩上5-氟尿嘧啶的残留量随配置的注射液支数的增加有增多趋势,配置1 h(240支注射液)后,外层手套和口罩上的残留量分别为3112 μg/双和0.6781 μg/只,而内层口罩、手套,腹前纱布和空气中残留浓度均低于检测下限。结论本法稳定性好、灵敏度高、干扰小;细胞毒药物在静脉配置中心集中配置能够达到有效个人防护的目的,提示配置时间超过1 h需更换外层手套及口罩。
高效液相色谱法;旋转蒸馏;5-氟尿嘧啶残留量
5-氟尿嘧啶(5-FU)是常用抗肿瘤药物之一。其活性成分在杀灭或抑制肿瘤细胞的同时,也对机体正常组织细胞有杀伤作用,直接威胁着相关医务人员的身体健康。对类似药物进行集中配置是有效的职业防护手段[1],随着静脉用药调配中心(pharmacy intravenousadmixture service,PIVAS) 在我国医院的逐步开展,提供建立健全相关的管理制度的支撑数据迫在眉睫。目前,国家药品标准用薄层色谱法测定氟尿嘧啶的含量,费时、灵敏度低,重现性差[2]。为此,本研究采用旋转蒸馏浓缩、高效液相色谱,对静脉用药调配中心配置人员的医务防护用品上的5-氟尿嘧啶残留量进行测定,以期为制定细胞毒药物集中配置的有效个人防护措施提供参考依据。
1 仪器与试剂
仪器:HPLC1100高效液相色谱仪(德国Agilent公司);RE 52AA旋转蒸发器 (上海亚荣生化仪器厂);雷磁PHS-2F pH计(上海精科有限公司);气泡吸收管(北京华瑞博远科技有限公司);微量移取器DGAGONMED 20-200 μl(上海大龙医疗设备有限公司);气体采样器DDY-5(盐城鑫宝科技有限公司)。
试剂:5-氟尿嘧啶对照品(含量>99.5%,上海国药集团化学试剂有限公司);氟尿嘧啶注射液(规格为10 mL:0.25 g/支,批号1412011,天津金耀氨基酸有限公司生产);甲醇为色谱纯(天津科密欧化学试剂有限公司);水为超纯水(自制);醋酸、醋酸钠为分析纯(成都市科龙化工试剂厂)。
2 方法与结果
2.1 色谱条件 根据法定药品说明书、中国药典(2010年版)[3],确定色谱条件如下。 色谱柱:symmetry C18 柱(150 mm×3.9 mm,5 μm);流动相:甲醇-水:(10:90);检测波长:265 nm;流速:1.0 mL/min;柱温:25℃;进样量:10 μL。
2.2 最低检测限 精密称取5-氟尿嘧啶对照品2.5 mg,加水制成10 μg/mL的溶液,摇匀,作为储备液。临用前精密量取500 μL置50 mL容量瓶中,加流动相稀释至刻度、摇匀。进样10 μL,记录谱图(见图1),在保留时间为2.8 min处有明显谱峰,积分面积为3,满足积分要求。因此,最低检测限为0.1 μg/mL,可满足本试验检测要求。

图1 最低检测限色谱图

图2 空白手套色谱图
2.3 线性关系的考察 根据氟尿嘧啶注射液配置过程中手套、口罩等医务用品上的残留量,并参考有关文献[4-5],需检测到0.1 μg/mL。精密量取5-氟尿嘧啶对照品 10 μg/mL 储备液 25 mL、5 mL、2.5 mL、500 μL,分别置50 mL容量瓶中,加流动相稀释至刻度、超声摇匀,按上述色谱条件,取10 μL注入液相色谱仪测定。保留时间在2.80 min,以积分峰面积Y为纵坐标、5-氟尿嘧啶浓度X为横坐标绘制标准曲线,得回归方程:Y=26.32X+0.994(R2=0.999),表明5-氟尿嘧啶在0.1~10 μg/mL浓度内线性关系良好。
2.4 干扰实验 为评估手套、口罩医用物品本身含有成分对5-氟尿嘧啶浓度测定的干扰,将一双未使用的手套排气扎口,置烧杯中,加0.2 mol/L、pH=8.00醋酸-醋酸钠缓冲溶液至没过手套,超声30 min,将溶液倒入蒸发瓶,相同方法洗涤手套2次后,溶液一起并入蒸发瓶。旋蒸浓缩至4 mL左右。按上述色谱条件,测得色谱图(见图2),在5-氟尿嘧啶的保留时间处无谱峰出现,表明空白医用物品对实验结果无干扰。
2.5 回收率试验 精密取200 μL氟尿嘧啶注射液至50 mL容量瓶,逐级稀释配置5 FU为40 μg/mL的标准溶液。用注射器量取5 mL,仔细涂抹在1双未使用的手套上,自然晾干。采用与2.4节中的回收残留5-氟尿嘧啶相同的方法,测得1双手套上5-氟尿嘧啶的含量为195.76 μg,回收率为97.88%。
2.6 手套上5-氟尿嘧啶残留量测试
2.6.1 配置不同数量单位注射液 为了考察配置不同数量单位注射液对手套药品残留量的影响,收集分别配置不同数量的静脉注射液后密封保存的手套, 配置注射液数量分别为 13、20、30、50、60、70、80、160、240支。采用2.4节中同样的方法处理上述手套。按设定的色谱条件,测定峰面积,计算5-氟尿嘧啶残留量结果如表1所示。在60支前,残留量与配置药物数量呈线性相关,之后出现正相关。

表1 配置不同数量单位注射液外层手套上5-氟尿嘧啶残留量
2.6.2 内层手套对比实验 对配置了不同支数的内层手套采用与2.4节中相同的方法进行5-氟尿嘧啶残留量的测试,结果显示包括配置了240支注射液(图3)在内的内层手套,在保留时间为2.8 min附近未有吸收峰,表明内层手套上5-氟尿嘧啶的残留量未达到检测限。
2.7 口罩上5-氟尿嘧啶残留量测试
2.7.1 配置不同数量单位注射液 考虑到口罩上5-氟尿嘧啶的残留量较少,本研究仅测试配置80支、160支和240支注射液口罩外层上的残留量。将使用过的外层口罩用剪刀剪碎于烧杯中,采用与2.4中相同的方法进行氟尿嘧啶残留量的浓缩和测试。测试结果见表2。
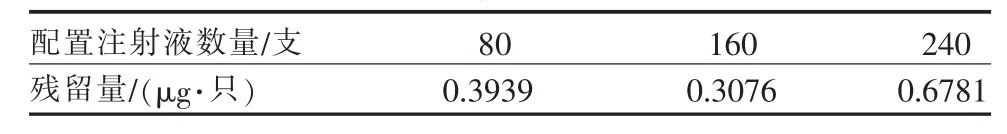
表2 配置不同数量单位注射液外层口罩上5-氟尿嘧啶残留量
2.7.2 内层手套对比实验 对配置了不同支数的内层口罩采用与2.4节相同的方法进行5-氟尿嘧啶残留量的测试,结果显示:包括配置了240支注射液在内的内层口罩提取浓缩液,未出现特征吸收峰。见图4。
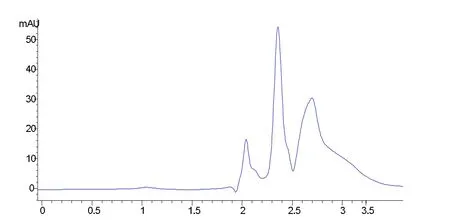
图3 配置240支注射液内层手套色谱图

图4 配置240支注射液内层口罩色谱图
2.8 腹前5-氟尿嘧啶残留量测试 考虑到在配置中心工作时,配置医护人员的腹部最靠近生物安全柜,此处5-氟尿嘧啶含量最高[6]。因此,本研究在医护人员防护服内层腹部位置贴20 cm×30 cm医用纱布作为监测点,探究配置240支注射液的残留量。回收和浓缩方法同2.4,测得液相色谱图见图5。在保留时间为2.80 min左右无明显吸收峰,表明腹前的5-氟尿嘧啶含量极少,达不到检测限。
2.9 空气中5-氟尿嘧啶残留量测试 本研究采用气体采样器进行现场采样,取10 mL的0.2 mol/L、pH=8.00醋酸-醋酸钠缓冲溶液至气泡吸收管,根据说明书进行调试和标定。采样时首先开启生物安全柜通风30 min。然后以1.2 L/min的流速采集配置1 h(配置240支注射液)过程中的空气,为保证采样的有效性,在采样期间选择配置医护人员周围5个采样点循环采样。收集吸收液直接进行测定,5-氟尿嘧啶残留量未达到检测限。结果见图6。
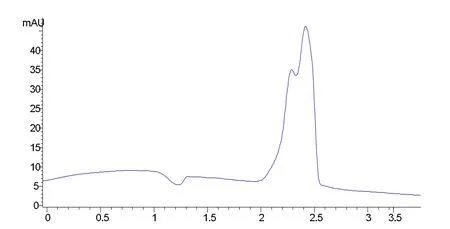
图5 配置240支注射液腹部残留量色谱图

图6 配置240支注射液空气色谱图
3 讨论
3.1 测试方法的适用性 通过对该方法的线性关系、最低检测限、回收率考察,结果表明本实验所建立的HPLC可用于测定氟尿嘧啶注射液配置过程药物残留量的检测。同时所建立的方法运行成本低、方便准确,干扰小,线性关系良好,重现性好,回收率高,满足对药品残留量的监控。
3.2 残留量结果分析 实验结果显示,连续配置注射液 240支(1 h)后,外层口罩残留量为 0.7 μg/只,而内层口罩、防护服内层腹部及空气中5-氟尿嘧啶提取浓缩液的色谱图无明显特征峰,表明其残留量均达不到检测限。外层手套随配置的注射液支数的增加有增多趋势,但线性关系不明显。分析原因是由于外层手套上残留量直接来自于配置过程中注射液溅出,并且存在较大的偶然性,因此结果线性较差。连续配置达240支时,残留量达3 mg/mL,而标准注射液为25 mg/mL,溅出量符合常理。因此要求配置人员熟练操作,配置过程中尽量减少药液溅出,出现药液溅出或配置时间超过1 h及时更换外层手套及口罩。研究表明,5-氟尿嘧啶中毒量与治疗量相接近[7],实验测得的残留量结果,远低于中毒量,且在外层防护用品上的残留,不会与人体直接接触,因此提示在生物安全柜内带双层无粉橡胶手套及双层普通口罩,穿防渗透防护服能有效避免配置人员的职业接触[8]。同时医疗机构要加强医务人员细胞毒药物职业暴露和规范配置操作的培训,配置人员严格按规范着装,严格遵守操作规范,管理人员合理安排人力资源,尽量减少配置时间,同时定期监测生物安全柜各项指标,确保运行正常。
[1]龚 婷,郭 韧,吴翠芳,等.静脉用药调配中心的建设与收费标准探讨[J].药品评价,2012,64(10):38-40.
[2]郭洪茹,杨金凤.高效液相色谱法测定5-氟胞嘧啶片中氟尿嘧啶的含量[J].河北化工,2008,31(5):76-77.
[3]国家药典委员会.中华人民共和国药典(二部)[S].2010:540-542.
[4]Micoli G,Turci R,Arpellini M,et al.Determination of 5-fluorouracil in Environmental Samples By Solid-Phase Extraction And High-Performance Liquid Chromatography With Ultraviolet Detection[J].Journal of Chromatography B:Biomedical Sciences and Applications,2001,750(1):25-32.
[5]Viegas S,Pádua M,Veiga A C,et al.Antineoplastic Drugs Contamination of Workplace Surfaces in Two Portuguese Hospitals[J].Environmental Monitoring and Assessment,2014,186(11):7807-7818.
[6]陈倩超,黄红兵,刘 韬,等.抗肿瘤药物集中配置模式下工作区间空气质量因素的评价分析[J].中国医院药学杂志,2010,30(13):1114-1117.
[7]刘永辉,李公春,崔娇娇.5-氟尿嘧啶类抗肿瘤药物的研究进展[J].河北化工,2008,31(9):9-11.
[8]Cristina Sottania,Benedetta Porroa,et al.Occupational Exposure to Antineoplastic Drugs in Four Italian Health Care Settings[J].Toxicol Lett,2012,213(1):107-115.
R47
B
10.16460/j.issn1008-9969.2016.14.045
2016-03-13
周利琼(1968-),女,重庆人,本科学历,主管护师。
陈伶俐]

