清藓饮调控Th1、Th2型细胞因子治疗口腔扁平苔藓的作用机制研究
杨续艳,王玲姝,谢梁振,张润桐,刘树民
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.黑龙江中医药大学附属第一医院,
清藓饮调控Th1、Th2型细胞因子治疗口腔扁平苔藓的作用机制研究
杨续艳1,2,王玲姝2,谢梁振2,张润桐1,刘树民3*
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.黑龙江中医药大学附属第一医院,
黑龙江 哈尔滨 150040;3.黑龙江中医药大学药物安全评价中心,黑龙江 哈尔滨 150040)
目的:评价“清藓饮”对口腔扁平苔藓患者外周血中Th1、Th2型细胞因子表达的影响。方法:40例符合纳入标准的OLP患者口服清藓饮,每日1剂,早、晚餐后各1次,连续8周。空白对照组40例为健康志愿者,不服药。采用空白对照方法,使用ELISA法检测空白对照组与治疗组治疗前后外周血中Th1型细胞因子IL-2、TNF-α和Th2型细胞因子IL-4、IL-6的表达情况,并观察评定“清藓饮”临床疗效。结果:患者经过8周的治疗后,显效28例,有效8例,无效4例,总有效率为90℅。患者治疗前外周血中TNF-α、IL-4和IL-6表达水平,TNF-α/IL-4比值均有明显变化,差异具有统计学意义(P<0.01)。结论:清藓饮治疗口腔扁平苔藓有良好的临床疗效,其作用机制可能调整患者体内Thl/Th2漂移,从而起到对机体的免疫调节作用。
清藓饮;口腔扁平苔藓;Th1型细胞因子;Th2型细胞因子
口腔扁平苔藓(orallichenplanus,OLP)是一种口腔黏膜慢性非感染性炎症性疾病,以口腔黏膜灰白色角化的丘疹交织呈珠光色条纹或斑块网状、环状、树枝状花纹样损害为特点,有时病损中央可见糜烂、色素沉着,可累及双颊、舌及附着龈等位置的黏膜。由于其有“癌前状态”及缠绵难愈的特点,在临床上成为研究热点[1]。以细胞因子IL-2、TNF-α和IL-4、IL-6比例为表征的辅助性 T 细胞 1(helper T cell,Th1)与辅助性 T 细胞 2(helper T cell,Th2)比例失衡,存在于OLP患者的血清、唾液和病损局部,提示有可能OLP的发病机制与CD4+的Th细胞分化失衡有关[2-5]。其中IL-2、TNF-α为Th1细胞因子,IL-4、IL-6为Th2细胞因子。目前对于OLP患者外周血中Th1、Th2细胞平衡状态的研究结果存在差异[2,6-7]。
本研究通过对OLP患者口服“清藓饮”治疗前后与健康正常人外周血中Th1、Th2细胞因子的表达变化水平进行检测,揭示黑龙江地区OLP患者外周血Th1、Th2细胞比例变化情况。同时,探索中药复方清藓饮治疗OLP的临床疗效、及其细胞因子水平的作用机制,为中药复方治疗OLP提供理论依据。
1 材料和方法
1.1 研究对象
选取于2014年8月—2016年1月我院口腔科黏膜病诊室收治的40例经临床及病理检查确诊为OLP患者为研究对象。其中男23例,女17例,年龄37~67岁,平均年龄(43.19±14.57)岁,病程3~54个月,平均病程(10.51±7.61)个月。发病部位以颊部和舌背为主。临床表现为黏膜网状、条索状的白色病损,可伴见糜烂、水疱等,颊部病损多左右对称,随着病程延长,病损程度加重时,患者可出现舌舔黏膜粗涩,进食烧灼感[8]。
1.2 纳入标准
1)对照组患者符合健康人的诊断标准;2)治疗组患者临床症状及病理检查符合OLP表现;3)自愿签署知情同意书者。
1.3 排除标准
1)不符合上述健康人诊断标准者;2)病理示上皮异常增生者;3)近期内(周内)有各种感染者;4)妊娠或哺乳期妇女,对中药复方过敏者;5)患者伴有全身系统性疾病(包括糖尿病、心血管疾病、肝炎等);6)未签署知情同意书者;7)研究人员认为其他原因不适合临床试验者;8)有家族遗传性疾病者;9)既往有免疫系统性疾病,如SLE、类风湿等;10)近期全身使用过糖皮质激素、免疫抑制剂或疫苗等药物;11)恶性肿瘤病史。
1.4 治疗方法
治疗组:40例OLP患者,给予服用中药复方“清藓饮”(组方:白藓皮、僵蚕、皂角刺、连翘、白芍等),每日1剂,开水冲服(天江中药免煎颗粒剂),早、晚餐后30 min口服,每周复诊1次记录症状变化情况,8周后完成治疗,并进行临床症状记录及疗效评价。
空白对照组:选取健康志愿者40例。年龄和性别与治疗组匹配,“齐性试验”(P>0.05)。研究对象均签署知情同意书。
1.5 临床疗效评价标准
采用中华口腔医学会口腔扁平苔藓(萎缩糜烂型)疗效评价标准(试行)[9]。
显效:充血糜烂完全消失,白色条纹无或轻微,患者无自觉症状,疼痛完全消失;有效:充血糜烂的面积缩小,白色条纹减少;自觉症状不明显,疼痛减轻。无效:充血糜烂面无变化或增加,白色条纹无变化或增加,自觉症状明显,疼痛无减轻或加重。
总有效率(%)=(显效+有效)/总例数×100%
1.6 观察指标
1.6.1 标本采集及处理
80名治疗组患者及空白对照组志愿者,分别于清晨空腹使用红色空白采血管采集外周静脉血约5 ml,高速冷冻离心,转速3000 r/min、温度4℃。离心时间为10 min,取上层血清,移液枪分装贮存于-80℃超低温冰箱。
1.6.2 Th1、Th2型细胞因子检测
使用免疫吸附试验(ELISA)双抗体夹心法对两组研究对象外周静脉血中Th1细胞因子TNF-α、IL-2和Th2细胞因子IL-4、IL-6的表达情况进行检测。严格按照TNF-α、IL-2和IL-4、IL-6试剂盒(BD,美国)说明书中的实验步骤进行操作,测定外周血清中TNF-α、IL-2和IL-4、IL-6的表达水平。
1.7 统计学分析
使用SPSS19.0软件对得到的数据进行分析处理,各组外周血中TNF-α、IL-2和IL-4、IL-6含量检测结果以均数±标准差表示。各组间比较使用t检验,计数资料使用卡方检验;P<0.05,P<0.01为差异具统计学意义。
2 结果
2.1 临床疗效评价
治疗组40例OLP患者口服清藓饮8周后,仅有4例患者症状变化不著,其余36例均有不同程度改善。其中显效28例(70%),有效8例(20%),总有效率为90%。
2.2 外周血中TNF-α、IL-2和IL-4、IL-6的表达水平比较
患者治疗前外周血中TNF-α、IL-4、IL-6表达水平明显高于正常对照(P<0.01),IL-2表达水平与正常对照组相较,变化不著(P>0.05);治疗后TNF-α、IL-4、IL-6较治疗前有明显下降(P<0.01),IL-2较治疗前变化不著(P>0.05),与正常对照组比较无明显差异(P>0.05),见表1。
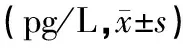
表1 两组患者外周血中Th1型细胞因子TNF-α、IL-2和Th2型细胞因子IL-4、IL-6的表达水平比较
注:与对照组比较,*P<0.05,☆P<0.01,※P>0.05;与本组治疗前比较,#P<0.01,△P>0.05。
3 讨论
OLP发病病因不明确,治疗过程中反复发作迁延难愈的特点,很多相关研究认为该病归属于自身免疫性疾病[10-11]。OLP病损黏膜局部上皮不全角化,基底细胞液化变性,固有层密集淋巴细胞带状浸润的病理变化是一个细胞免疫介导的免疫应答过程[12]。在细胞免疫应答过程中,细胞因子的产生和迁移对淋巴细胞吸附、浸润、分化、滞留具有重要的调节作用。
TNF-α是一种促炎性细胞因子,能促进 Th 细胞向Th1 细胞分化,其过量释放可能会引起T 淋巴细胞的趋化聚集在上皮细胞固有层引起上皮损伤及萎缩[13]。Khan等[14]研究发现,OLP患者固有层内淋巴细胞TNF-α表达较正常人明显增强,Rhodus等[15-16]通过对OLP患者唾液及病损组织滤液中TNF-α水平的检测,发现在这些体液中TNF-α的表达水平较正常人群高。Khan等[17]发现,OLP病损黏膜上皮内角质形成细胞表达TNF-α,说明OLP患者全身TNF-α的变化可能与OLP的发病具有相关性。本研究中OLP患者治疗前血清中TNF-α表达水平显著高于正常对照组,在服用中药复方清藓饮治疗后TNF-α水平降低,研究结果提示TNF-α可以作为OLP的诊断及评价药物疗效的一个有效指标。
一旦有外来抗原集聚于口腔黏膜局部或者自身组织抗原在某些因素作用下发生异常变化。这些异动信息即会被黏膜上皮内的树突状细胞、巨噬细胞提呈给T细胞并使其活化,被活化的CD4+T细胞增殖活化为Th0细胞,Th0细胞进而分化为Th1和Th2细胞亚群。其中Th1细胞分泌细胞因子IL-2升高又可促进CD4+T细胞、Th1的活化、分化和增殖。IL-2可激活Th1分泌IL-2,二者升高均可,放大T细胞活性诱导免疫应答[18]。Th1细胞介导的细胞免疫可以在Th1细胞分泌的细胞因子INF-γ的参与下激活巨噬细胞,促进溶酶体与吞噬体融合,合成释放各种抗菌肽和蛋白酶。活化后的巨噬细胞释放的IL-12,有可促进Th1的分化;促使INF-γ和IL-2同时增加,进而可以促进CD8+T细胞转化成CTL;活化中性粒细胞,促进其杀伤靶细胞或抗原。同时IL-2能诱导NK细胞增殖,增强NK细胞的生物活性,提高单核巨噬胞产生更多的致炎细胞起到杀伤肿瘤细胞的作用[19]。本研究的结果表明,OLP组患者血清中IL-2的含量较正常组变化不著(P>0.05)。
IL-4、IL-6均为由Th2细胞产生的细胞因子。IL-4可促进T,B淋巴细胞的发育、活化体液免疫和抗体。同时IL-4又可促进Th2细胞的活化,抑制Th1细胞增殖及其免疫应答[20]。IL-6可刺激T细胞增殖参与炎症反应。卢锐等研究发现[21],OLP局部病损的角质形成细胞和单核细胞内IL-6阳性表达,病损局部的单核细胞较OLP患者PBMC分泌更多的IL-6,提示IL-6可能在角质形成细胞的增殖、上皮增生过程中发挥重要作用。本研究使用ELISA法检测血清中的IL-4、IL-6水平,结果显示OLP患者治疗前组均明显高于正常对照组,且OLP治疗前后IL-4、IL-6水平变化也非常明显。同时以TNF-α/IL-4比值为代表的Th1/Th2在OLP患者治疗前和正常空白对照组也有明显的下调,并且服用清藓饮治疗后Th1/Th2的比值有所回调。
正常状态下,Th1/Th2处于相对平衡状态时,T 细胞亚群之间保持一种动态平衡,机体的免疫效应和免疫抑制处保持精细而复杂的平衡状态。一旦Th1/Th2的平衡被扰动,比值发生变化即会出现细胞免疫亢进或者体液免疫亢进。Th1细胞和细胞因子诱导细胞免疫。Th2细胞和细胞因子亚群功能变化主要表现为诱导体液免疫[22]。本研究中,在OLP 患者治疗前血清Th1型细胞因子TNF-α表达升高,Th2型细胞因子IL-4、IL-6也显著升高,提示在OLP 患者发病过程中Th1、Th2细胞均有参与OLP 的病理变化。而治疗前,由于TNF-α/IL-4比值下调,说明OLP患者外周血中免疫平衡向Th2偏移,属于Th2呈现优势的免疫应答[23]。由此可推测OL 患者外周血中体液免疫亢进,所形成的免疫复合物引发了口腔的局部病损。病损黏膜的沉积物刺激局部上皮细胞及T淋巴细胞诱导Th1淋巴细胞活化,引起病损处细胞免疫功能亢进,出现固有层淋巴细胞带状浸润、基底细胞空泡液化。
清藓饮由白藓皮、皂角刺、白芍、僵蚕、连翘等中药组成,组方中白藓皮苦寒,清热、祛风解毒为治癣要药;皂角刺消肿排脓;僵蚕祛风止痉、软坚散结、温行血脉;连翘清热解毒、消痈散结;百合安心、益志、清心安神。诸药相合共奏通络、散结、祛邪、逐瘀的功效[24]。本研究结果提示,OLP患者服用“清藓饮”治疗后,病损局部白色角化条纹(斑块)的质地、厚度、面积等症状和体征均明显改善,黏膜糜烂面及充血发红点消失。因此提示“清藓饮”的作用机制可能在于改变了患者体内Thl/Th2 漂移趋势。但清藓饮方剂降低TNF-α、IL-4、IL-6等细胞因子水平的作用机制、信号转导通路及其作用的靶细胞有待进一步研究探讨。
[1] Tabolli S,Bergamo F,Alessandroni L,et al.Quality of life and psychological problems of patients with oral mucosal disease in dermatological practice[J].Dermatology,2009,218(4):314-320.
[2] 罗亮,王冬平,蔡扬,等.口腔扁平苔藓患者外周血Th1/Th2型细胞因子表达及意义[J].重庆医科大学学报,2015,40(5):743-746.
[3] Sheikh S, Gupta D, Pallagatti S, et al. Role of topical drugs intreatment of oral mucosal diseases. A literature review[J]. NY State Dent J,2013,79(6):58-64.
[4] Cheng YS, Jordan L, Rees T, et al. Levels of potential oral cancer salivary mRNA biomarkers in oral cancer patients in remission andoral lichen planus patients[J]. Clin Oral Investig,2014,18(3):985-993.
[5] Mahdavi O, Boostani N. Use of low level laser therapy for oral lichen planus: report of two cases[J]. J Dent (Shiraz),2013,14(4):201-204.
[6] 延欣虹,张波.白芍总苷对糜烂型口腔扁平苔藓患者外周血中IFN-γ及IL-10表达的影响研究[J].口腔医学研究,2016,32(5):534-537.
[7] Fitzpatrick SG, Hirsch SA,Gordon SC. The malignant transformationof oral lichen planus and oral lichenoid lesions: a systematic review[J].J Am Dent Assoc,2014,145(1):45-56.
[8] 华红,刘宏伟,陈谦明,等.口腔黏膜病学[M].北京:北京大学医学出版社,2014:107.
[9] 中华口腔医学会口腔黏膜病专业委员会.口腔扁平苔藓(萎缩型、糜烂型)疗效评价标准(试行)[J].中华口腔医学杂志,2005,40(2):92-93.
[10] 刘丽,臧磊,吕晓丹,等.Egr-1在口腔扁平苔藓及口腔鳞状细胞癌中的表达及意义[J].宁夏医科大学学报,2010,32(2):204-206.
[11] Nafarzadeh S, Ejtehadi S, Amini Shakib P, et al. Comparative study of expression of smad3 in oral lichen planus and normal oral mucosa [J].Int J Mol Cell Med,2013, 2(4):194-198.
[12] Crispian Scully.Oral mucosal disease:Lichen planus[J].British Journal of Oral and Maxillofacial Surgery,2008(46):15-21.
[13] Sugeman PB, Savagen W, Walsh LJ,et al.The pathogenesis of oral lichen planus[J].Crit RevOral BiolMed,2002,13(4):350-365.
[14] Khan A, Farah CS, Savage NW, et al.Th1 cytokines in oral lichen planus[J].J Oral Pathol Med, 2003,2(2):77-83.
[15] Rhodus NL,Cheng B,Myers S,et al.A comparison of thepro- inflammatory, NF-κB-dependent cytokines:TNF-alpha, IL-1-alpha, IL-6,and IL-8 in different oral fluids from oral lichen planus patients[J].Clin Immunol,2005,114(3):278-283.
[16] Rhodus NL, Cheng B, Ondrey F. Th1/Th2 Cytokine Ratio in Tissue Transudates from Patients with Oral Lichen Planus[J]. Mediators Inflamm, 2007:19845.
[17] Khan A, Farah CS, Savage NW, et al. Th1 cytokines in oral lichen planus[J]. J Oral Pathol Med, 2003, 32(2):77-83.
[18] Whiteside TL, Letessier E, Hirabayashi H, et al. Evidence for local and systemic activation of immune cells by peritunoral injections of interleukin2 in patients with advanced squmaous cell carcinoma of head and neck[J].Cancer Res,1993,53(23): 5654-5662.
[19] 龚非力.医学免疫学[M].北京:科学出版社,2008:102-119.
[20] Tao XA,Li CY,Rhodus NL,et al.Simultaneous detection of IFN-gamma and IL-4 in lesional tissues and whole unstimulated saliva from patients with oral lichen planus [J].J Oral Pathol Med,2008,37(2):83-87.
[21] 卢锐,周刚.辅助性T淋巴细胞极化相关细胞因子在口腔扁平苔藓中的研究进展[J].国际口腔医学杂志,2008,35(6):627-629.
[22] Ursaciuc C, Surcel M, Ciotaru D. Regulatory T cells andTH1/TH2 cytokines as immunodiagnosis keys in systemic autoimmune diseases[J]. Roum Arch Microbiol Immunol,2010, 69(2):79-84.
[23] Singh V, Pal M, Gupta S, et al. Plaque control improves the painful symptoms of oral lichen planus gingival lesions.A short-term study[J].Br Dent J,2014,216(6):355.
[24] 杨续艳,王玲姝,谢振梁,等.清藓饮对糜烂型口腔扁平苔藓患者外周血IFN-γ和IL-10表达的影响研究[J].中医药学报,2016,44(5):64-66.

《中医药信息》2016年版中国科技期刊引证报告(核心版)
国家自然科学基金青年科学基金项目(No.81403441);黑龙江省博士后资助项目(No.LBH-Z11016);黑龙江中医药大学校基金项目(No.201010)
杨续艳(1979-),女,黑龙江中医药大学中药学博士后科研流动站在站博士后。
刘树民*(1963-),男,教授,博士研究生导师,主要研究方向:中药药性理论研究。
2016-07-31
R285.6
A
1002-2406(2016)06-0045-04
修回日期:2016-08-10

