花旗泽仁对胰岛素抵抗大鼠胸主动脉血管张力、血清一氧化氮含量以及骨骼肌胰岛素受体mRNA基因表达的影响
葛鹏玲,张宇驰,韩东卫,郭文超
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
花旗泽仁对胰岛素抵抗大鼠胸主动脉血管张力、血清一氧化氮含量以及骨骼肌胰岛素受体mRNA基因表达的影响
葛鹏玲,张宇驰,韩东卫,郭文超*
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
目的:观察花旗泽仁对2型糖尿病胰岛素抵抗大鼠胸主动脉血管张力、一氧化氮(NO)含量以及大鼠骨骼肌组织中胰岛素受体(INSR)mRNA基因表达的影响,探讨花旗泽仁改善2型糖尿病血管内皮功能损伤及其抗2型糖尿病胰岛素抵抗作用的分子机制。方法:用连续灌胃脂肪乳配合双次腹腔注射链脲佐菌素的方法复制2 型糖尿病胰岛素抵抗大鼠模型。将造模成功大鼠随机分为模型对照组、花旗泽仁组和阳性对照组。花旗泽仁组灌胃给予花旗泽仁中药煎煮液,阳性对照组灌胃给予罗格列酮药液,模型对照组和空白对照组灌胃给予相应体积的蒸馏水。灌胃4周后,检测空腹血糖(FBG)及空腹血清胰岛素(FINS),并计算胰岛素敏感指数(ISI);采用离体血管灌流法检测大鼠主动脉内皮舒张力反应,用硝酸还原酶法检测血清NO含量,同时取各组大鼠骨骼肌组织,采用实时荧光定量PCR(qRT-PCR)技术检测胰岛素受体(INSR)mRNA基因表达水平。结果:与正常对照组比较,模型对照组大鼠的空腹血糖(FBG)及空腹胰岛素(FINS)水平显著升高(P<0.001),血管张力明显降低(P<0.01),胰岛素敏感指数(ISI)、NO含量以及胰岛素受体mRNA基因表达水平显著下调(P<0.001);与模型对照组比较,花旗泽仁组的FBG及FINS水平显著降低(P<0.001),ISI、血管张力明显上升(P<0.01),NO含量及INSR mRNA基因表达水平显著上调(P<0.001);同时与模型对照组比较,阳性对照组大鼠FBG及FINS水平显著降低(P<0.001),ISI、血管张力上升(P<0.05),NO含量显著升高(P<0.001),INSR mRNA基因表达水平明显上调(P<0.01)。结论:花旗泽仁可改善2型糖尿病胰岛素抵抗大鼠血管张力,其机制可能与上调活性因子NO含量有关;同时花旗泽仁能促进2型糖尿病胰岛素抵抗大鼠骨骼肌组织胰岛素受体(INSR)mRNA基因表达水平的上调,这可能是其降血糖并改善组织胰岛素敏感性的作用机制之一。
花旗泽仁;2型糖尿病;胰岛素抵抗;血管张力;胰岛素受体(INSR)
2型糖尿病是严重危害人类健康的重大疾病之一[1]。心脑血管疾病是2型糖尿病患者死亡的主要原因,而血管病变发生的前提是血管内皮功能损伤[2-3]。血液中的一系列生物分子和细胞因子调控失衡从而产生各种血管并发症。一氧化氮(NO)是血管内皮细胞行使其正常生理功能的重要信息分子,具有舒张血管的功能,血液中NO含量降低可能造成血管收缩舒张功能障碍[4-5]。本研究通过观察大鼠血管张力收缩幅度及NO含量变化,探讨花旗泽仁对2型糖尿病血管内皮功能损伤的保护作用。
骨骼肌对人体内的糖脂代谢起着重要的调节作用,同时也是胰岛素作用的主要靶器官之一。胰岛素与胰岛素受体(INSR)结合后,并与胰岛素受体底物-2(IRS-2)结合,形成信号蛋白复合物,以介导胰岛素信号的传导[6]。近年来在2型糖尿病的研究中发现,胰岛素受体(INSR)数量减少可形成胰岛素抵抗[7]。在前期研究工作的基础上,本研究应用实时荧光定量PCR技术,检测大鼠骨骼肌中胰岛素受体(INSR)mRNA基因的表达,为花旗泽仁抗2型糖尿病胰岛素抵抗的分子机制提供新依据。
1 材料与方法
1.1 实验动物
健康Wistar大鼠30只,雄性,体质量(200±20)g,购自黑龙江中医药大学实验动物中心,动物合格证号:SCXK(黑)2013-004。分笼饲养,房间温度(20±2) °C,相对湿度50%左右,自由摄食、饮水,适应喂养1周。
1.2 药物
花旗泽仁复方(西洋参、泽泻和薏苡仁,购于黑龙江中医药大学附属第一医院中药局);链脲佐菌素STZ(BIOSHARP公司,批号S0130);丙硫氧嘧啶(精华制药集团股份有限公司,国药准字H32020795,批号31131202);马来酸罗格列酮(天津葛兰素史克有限公司,国药准字H20020475,批号10025102);诺和灵R生物合成人胰岛素(丹麦诺和诺德公司,国药准字J20070043,批号BVG0363);谷氨酸钠(中国惠世生化试剂有限公司,批号20131127)。
1.3 主要试剂
罗康全活力型血糖试纸(德国罗氏诊断有限公司);ELISA试剂盒(南京建成生物工程研究所);一氧化氮(NO)测试盒(南京建成生物工程研究所);Krebs-Henseleit缓冲液(北京中科迈晨科技有限公司);TRIzol Reagen(Invitroge公司);DEPC焦炭酸二乙酯(Amresco公司);AccuPower RocketScript RT PreMix、AccuPower GreenStar qPCR PreMix(Bioneer公司);RNase-free water (去离子水加入0.01%的DEPC,Sigma公司);引物设计使用Primer 5.0软件(苏州金唯智生物科技有限公司合成);无水乙醇、氯仿、异丙醇(天津市致远化学试剂有限公司)。
1.4 仪器
Infinite M200 Pro多功能酶标仪(瑞士帝肯);生物机能实验系统BL-420S(成都泰盟科技);Mircro 17R型号微量台式低温离心机(Thermo公司);UV-2550紫外分光光度计(日本岛津有限公司);S1000型号Bio-RAD梯度单头PCR仪、CFX96型号Bio-RAD Real-time PCR仪(美国伯乐公司)。
1.5 造模与分组
在艾静和魏伟等[8-9]建立2型糖尿病胰岛素抵抗模型基础上加以改进,复制2型糖尿病胰岛素抵抗模型。将Wistar大鼠随机分为模型对照组(24只)和空白对照组(6只),模型对照组大鼠灌胃脂肪乳10 ml/(kg·d),连续灌胃20天后,禁食12 h,水正常给予,腹腔注射链脲佐菌素(STZ)40 mg/(kg·d),连续注射2天,每次腹腔注射STZ 15 min后,给大鼠腹腔注射胰岛素0.4 U,并于2.5 h和5 h后分别灌胃给予25 %葡萄糖10 ml/kg。最后一次注射STZ 72 h后,空腹血糖值≥ 16.7 mmol/L,且胰岛素敏感指数(Insulin Sensitivity Index,ISI)与空白对照组比较具有显著差异的大鼠作为胰岛素抵抗模型大鼠。
取建模成功大鼠24只随机分成三组,即模型对照组(6只)、花旗泽仁组(6只)和阳性对照组(6只)。
1.6 给药
花旗泽仁组按5.4 g/kg剂量灌胃给药;阳性对照组按0.4 mg/kg剂量灌胃给药;空白对照组和模型对照组给予等体积蒸馏水10 ml/kg,共灌胃4周。
1.7 取材
4周后,各组大鼠眼眶静脉丛取血,滴于血糖仪上,检测空腹血糖(FBG)。然后腹腔注射戊巴比妥(30 mg/kg)进行麻醉,腹主动脉取血,血液静置30 min后,4℃ 3000 rpm离心15 min,吸取上清液,-80℃保存待测;迅速分离胸主动脉,小心剔去结缔组织后制成长2.5~3.0 mm动脉环,立即投入预冷的营养液(Krebs-Henseleit缓冲液)中待测,并持续通入95% O2+5% CO2混合气体;最后分离大鼠左右两侧股四头肌,用PBS缓冲液洗去血迹,并剔除明显的结缔组织、污染物等,将骨骼肌组织放入冻存管,液氮冻存待测。
1.8 空腹血糖(FBG)、空腹胰岛素(FINS)及胰岛素敏感指数(ISI)检测
采用血糖仪检测FBG。取适量血清,按胰岛素放射免疫分析试剂盒说明书方法进行操作,检测FINS。用李光伟法[10]计算胰岛素敏感指数(ISI)。
ISI=ln[1/(FBG×FINS)]
1.9 血管张力及一氧化氮(NO)含量的检测
将血管环悬挂于持续通有95% O2+5% CO2混合气体且37 °C恒温的麦氏槽中,连接张力传感器,将血管张力变化用生物信号定量记录分析系统对实验数据进行分析。调整静息张力为1.0 g,平衡60 min。加入KCl 溶液(使浴槽中终浓度为30 mmol/L)预刺激2次。血管条张力平衡后,于浴槽中加入浓度为5×10-8mol/L的去甲肾上腺素,记录血管张力G1。待动脉环收缩达峰值后,加入浓度分别为1×10-8mol/L、1×10-7mol/L、1×10-6mol/L和1×10-5mol/L的乙酰胆碱诱导血管舒张。观察血管的舒张反应,达到稳定浓度记录血管环张力G2,计算血管环收缩幅度(G2/G1×100%)。
根据一氧化氮(NO)试剂盒说明书操作方法,采用硝酸还原酶法检测各组血清一氧化氮(NO)含量。
1.10 胰岛素受体(INSR)mRNA实时荧光定量PCR检测
解冻后,将骨骼肌组织用研钵研磨至粉末状。取50 mg骨骼肌组织粉末移入预冷的1.5 ml离心管中,采用TRIzol方法提取后,用AccuPower RocketScript RT PreMix试剂盒将RNA逆转录合成cDNA。在配套的PCR反应管中加入样本溶液以及相应的试剂,将溶液混合并按30℃ 5 min,60℃ 60 min,95℃ 5 min和4℃ 5 min的条件进行反转录反应。以逆转录所得cDNA为模板进行PCR的扩增,cDNA样本2.0 μl,2×Greenstar Master Mix 12.5 μl,引物F-primer(内参β-actin F 10 pM)、引物R-primer(内参β-actin R 10 pM)各1.0 μl,DEPC溶液 8.5 μl共25.0 μl。将溶液混合并按95℃ 10 min,95℃ 10 s和47℃ 30 s条件进行PCR反应,40个循环周期。引物序列见表1。
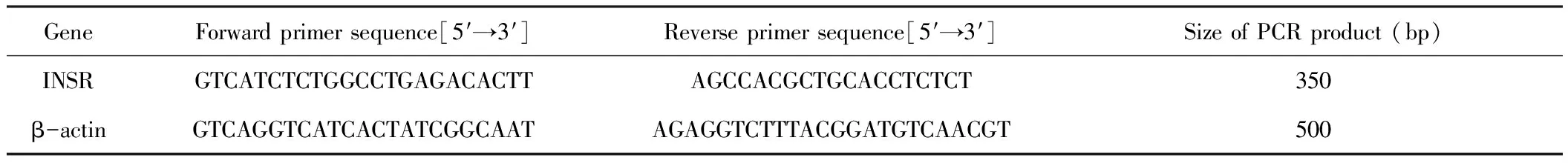
表1 PCR引物序列
1.11 统计学分析

2 结果
2.1 花旗泽仁对大鼠体质量、空腹血糖(FBG)、空腹胰岛素(FINS)及胰岛素敏感指数(ISI)的影响
如表2、图1所示,与空白对照组比较,模型对照组大鼠体质量减少,具有显著差异(P<0.01);与模型对照组比较,花旗泽仁组及阳性对照组大鼠体质量升高,但不具有显著性差异(P>0.05)。
如表2、图2、图3和图4所示,与空白对照组比较,模型对照组大鼠血糖(FBG)和胰岛素(FINS)水平明显升高,胰岛素敏感指数(ISI)显著降低(P<0.001);与模型对照组比较,花旗泽仁组和阳性对照组的空腹血糖(FBG)和空腹胰岛素(FINS)水平明显下降,胰岛素敏感指数(ISI)显著升高(P<0.001)。

表2 花旗泽仁对各组大鼠体质量、空腹血糖、胰岛素和胰岛素敏感指数的影响
注:与空白对照组比较,△△△P<0.001,△△P<0.01;与模型对照组比较,***P<0.001,**P<0.01,*P<0.05。
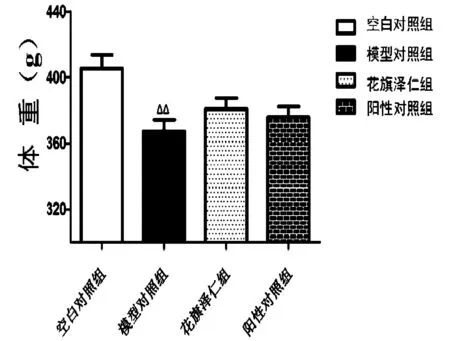
图1 花旗泽仁对大鼠体质量的影响
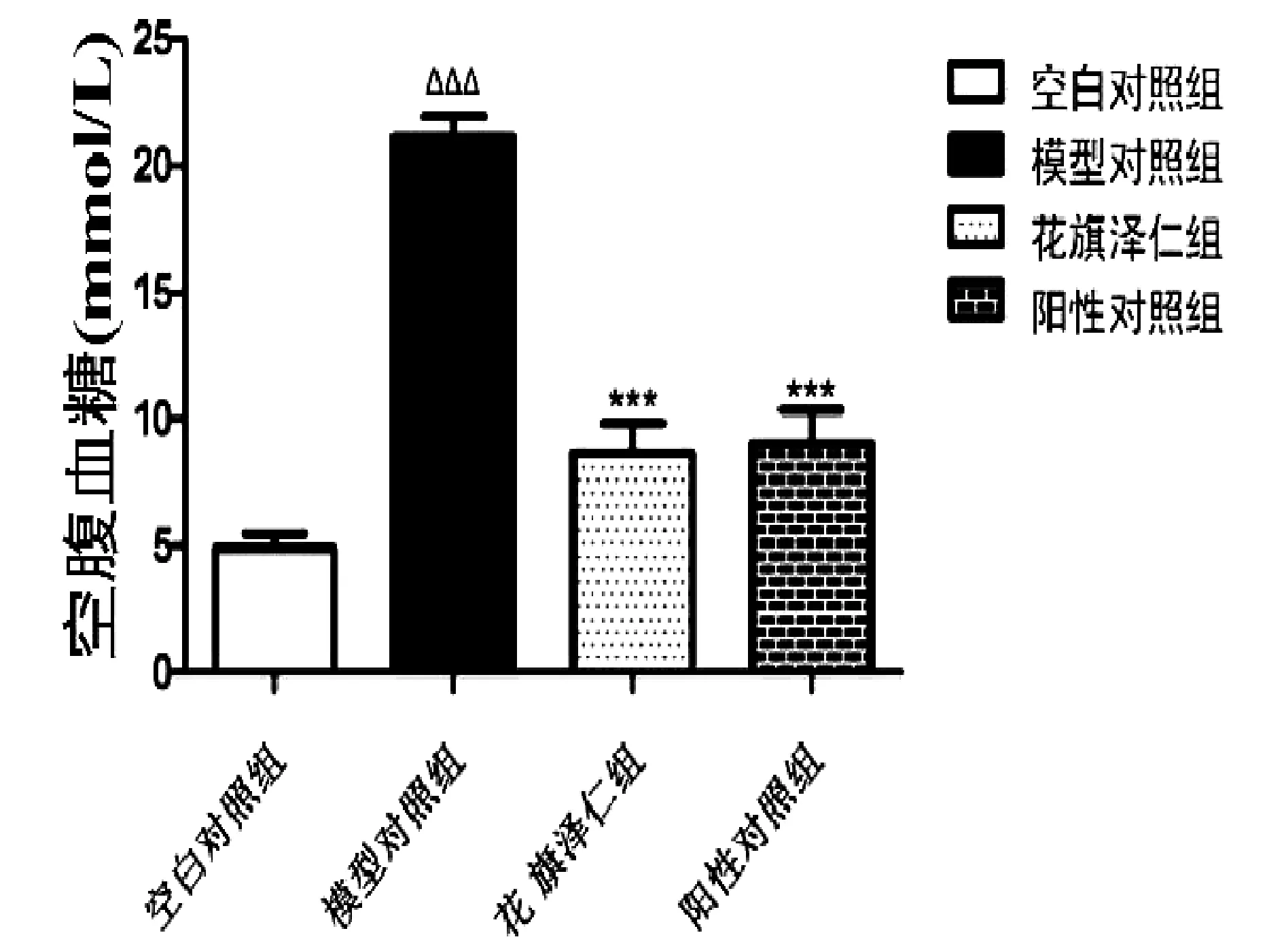
图2 花旗泽仁对大鼠空腹血糖(FBG)的影响
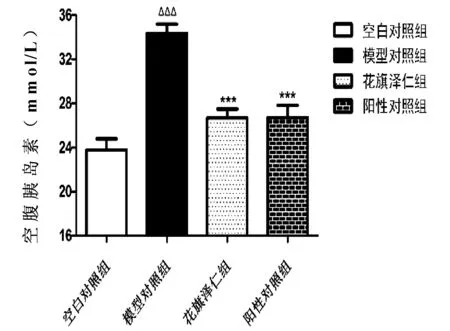
图3 花旗泽仁对大鼠空腹胰岛素(FINS)的影响
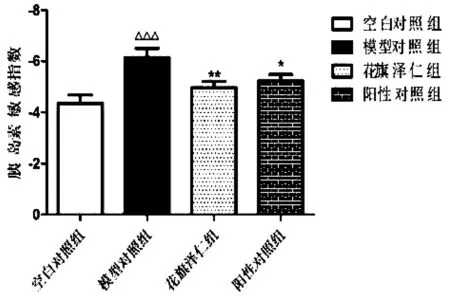
图4 花旗泽仁对大鼠胰岛素敏感指数(ISI)的影响
2.2 花旗泽仁对大鼠血管内皮功能的影响
离体血管环收缩功能结果如表3显示,与正常对照组比较,模型对照组血管张力显著降低(P<0.001);与模型对照组相比,随着乙酰胆碱浓度升高,花旗泽仁组及阳性对照组血管张力明显升高,且显著性越来越明显。

表3 花旗泽仁对大鼠血管收缩幅度的影响
注:与正常对照组比较,△△△P<0.001;与模型对照组比较,***P<0.001,*P<0.05。

表4 花旗泽仁对大鼠NO含量的影响
注:与正常对照组比较,△△△P<0.001;与模型对照组比较,***P<0.001。
血清一氧化氮(NO)含量实验结果如表4显示,与正常对照组比较,模型对照组一氧化氮(NO)含量显著降低(P<0.001);与模型对照组相比,花旗泽仁组及阳性对照组NO含量显著升高(P<0.001),且趋于正常对照组。
2.3 花旗泽仁对胰岛素受体(InSR)mRNA基因表达水平的影响
研究结果如表5所示,在骨骼肌组织中,与空白对照组比较,模型对照组胰岛素受体(INSR)mRNA表达水平显著下调(P<0.001);与模型对照组比较,花旗泽仁组及阳性对照组INSR mRNA的表达水平显著上调(P<0.001,P<0.01)。

表5 花旗泽仁对胰岛素受体(InSR)mRNA
注:与正常对照组比较,△△△P<0.001;与模型对照组比较,***P<0.001,**P<0.01。
3 讨论
在2型糖尿病早期内皮功能紊乱现象就可发生,他既是2型糖尿病血管并发症发生的前兆,也是其产生的主要病理基础[11]。已有研究发现,2型糖尿病时乙酰胆碱引起的内皮依赖性血管舒张功能严重受损[12-13]。乙酰胆碱引起的血管内皮依赖性舒张主要由一氧化氮(NO)等活性因子调节,其中NO是最主要的内皮依赖性舒张因子,其作用是舒张血管。血液中NO水平显著下降也可以作为血管内皮细胞损伤的标志物之一[14]。血液中NO含量减少或生物活性降低是导致胸主动脉内皮依赖性舒张功能损伤、内皮功能障碍和血管并发症的主要原因之一。本研究中,与正常大鼠对比,脂肪乳联合双次腹腔注射链脲佐菌素的方法复制的2 型糖尿病胰岛素抵抗大鼠血管张力显著下降,血清NO含量明显降低,提示2型糖尿病胰岛素抵抗大鼠可能存在内皮功能损伤现象。在给予花旗泽仁干预4周后,花旗泽仁组大鼠NO含量明显上升,血管张力显著升高。但有关花旗泽仁改善内皮功能障碍的机制尚需进行更深入的探讨。
2型糖尿病的主要特征是存在胰岛素抵抗及胰腺β细胞分泌功能异常[15],其原因与胰岛素和胰岛素受体结合后信号向细胞内转导所引起的一系列代谢过程有关[16-20]。胰岛素受体(INSR)是胰岛素信号转导过程中的关键分子[21-22]。胰岛素信号通路中关键分子表达降低、磷酸化水平下降等都可引起胰岛素信号转导障碍。从而导致胰岛素抵抗,继而引发2型糖尿病[23]。现已有大量研究表明,胰岛素受体功能改变与2型糖尿病胰岛素抵抗的发生、发展有密切关系[24]。花旗泽仁具有降低空腹血糖,提高胰岛素敏感性,抗氧化应激,改善胰岛素抵抗等作用[25-26]。通过本研究结果显示,2型糖尿病胰岛素抵抗大鼠INSR的mRNA基因表达水平较正常对照组显著降低,花旗泽仁组INSR的mRNA基因表达水平较模型对照组显著增高,表明花旗泽仁有上调2型糖尿病胰岛素抵抗大鼠INSR mRNA基因表达水平的作用。提示花旗泽仁对2型糖尿病胰岛素抵抗的改善作用可能通过胰岛素受体,改善胰岛素信号转导障碍,从而提高胰岛素敏感性。
[1] Tripathy D,Mohanty P,Dhindsa S,et al. Elevation of free fatty acids induces inflammation and impairs vascular reactivity in healthy subjects[J].Diabetes,2003,52(12):2882-2887.
[2] Morcos M1, Sayed AA, Bierhaus A, et al. Activation of tubular epithelial cells in diabetic nephropathy[J].Diabetes, 2002, 51(12): 3532-3544.
[3] Calles-Escandon J, Cipolla M. Diabetes and endothelial dysfunction: a clinical perspective[J]. Endocr Rev,2001,22(1):36-52.
[4] Kaneto H,Nakatani Y,Kawamori D,et al.Role of oxidative stress,endoplasmic reticulum stress ,and c-Jun Nterminal kinase in pan-creatic beta-cell dysfunction and insulin resistance[J]. Int J Bio-chem Cell Biol,2005,37:1595-1598.
[5] Reed MJ, Meszaros K, Entes LJ, et al. A new rat model of type 2 diabetes: the fat-fed, streptozotocin-treated rat[J].Metabolism,2000,49:1390-1394.
[6] 于东,赵立娜,郝丽萍,等.长期酒精摄入引起大鼠胰岛素抵抗及其分子机制[J].营养学报,2008,30(6):584-587.
[7] 彭定琼,郭晓蕙,陈宇,等.胰岛素受体底物2在2型糖尿病大鼠肌肉、脂肪、肝脏中的蛋白表达及其意义[J].中国预防医学杂志,2006,7(5):405-407.
[8] Jing Ai, Ning Wang, Mei Yang, et al. Development of Wistar rat model of insulin resistance[J].World J Gastroenterol,2005,11(24):3675-3679.
[9] 魏伟,吴希美,李元建.药理实验方法学[M].4版.北京:人民卫生出版社,2010:1698.
[10] 李光伟,潘孝仁.检测人群胰岛素敏感性的一项新指数[J].中华内科杂志,1993,32(10):656-660.
[11] King GL,Shiba T,Oliver J,et al.Cellular and molecular abnormalities in the vascular endothelium of diabetes mellitus[J]. Annu RevMed,1994,45:179.
[12] Fu GS, Huang H, Chen F, et al. Carvedilol ameliorates endothelial dysfunction in streptozotocin-induced diabetic rats [J]. Eur J Pharmacol, 2007,567(3):223-30.
[13] Tawfik HE,El-Remessy AB,Matragoon S,et al.Simvastatin improves diabetes-induced coronary endothelial dysfunction [J].J Pharmacol Exp Ther,2006, 319(1): 386-395.
[14] Vanhoutte PM,Shimokawa H,Tang EH,et al.Endothelial dysfunction and vascular disease [J]. Acta Physiol (Oxf),2009,196(2):193-222.
[15] Kahn BB.Type 2 diabetes:when insulin secretion fails to compensate for insulin resistance[J].Cell,1998,92:593-596.
[16] 李士颖,朱铁虹.肝胰岛素抵抗的研究进展[J].中国慢性病预防与控制,2008,16(2):206-208.
[17] 葛鹏玲,李庆云,旺健伟,等.花旗泽仁对胰岛素抵抗大鼠脂代谢的影响[J].中医药信息,2012,29(5):87-89.
[18] 张敏霞,王昊泉,胡竹元,等.补肾益气活血法对老年2型糖尿病颈动脉硬化和内皮功能的影响[J].中医药学报,2014,42(5):138-140.
[19] 王亚威,王鑑威.养阴健脾汤对胰岛素抵抗的2型糖尿病患者的影响[J].中医药学报,2016,44(2):87-88.
[20] 任岩海,刘洪凤,韩智学.桑叶多糖对2型糖尿病大鼠血糖血脂的影响[J].中医药学报,2013,41(1):20-21.
[21] Kyuichi K, Keisuke S, Itsuko F, et al. Prenylated chalcone 4-hydroxyderricin and xanthoangelol stimulate glucose uptake in skeletal muscle cells by inducing GLUT4 translocation[J].Nutr Food Res,2011,55:467-475.
[22] 董培良,韩华,舒尊鹏,等.复方灵芝降糖胶囊对2 型糖尿病大鼠骨骼肌GluT-4及脂肪组织胰岛素受体mRNA基因表达的影响[J].中医药信息,2014,31(3):123-125.
[23] Isa NM, Abdelwahab SI, Mohan S, et al. In vitro anti-inflammatory, cytotoxic and antioxidant activities of boesenbergin A, a chalcone isolated from Boesenbergia rotunda (L.) (fingerroot)[J].Braz J Med Biol Res,2012,45:524-530.
[24] 马建,姚秀明,赵娜,等.祛胰抵方对2型糖尿病胰岛素抵抗大鼠PI-3K的影响[J].中医药学报,2013,41(5):50-53.
[25] 葛鹏玲,刘萍,马育轩,等.花旗泽仁对胰岛素抵抗大鼠胰岛素敏感性的影响[J].中医药信息,2012,29(6):99-101.
[26] 葛鹏玲,赵静,阚玉娜,等.花旗泽仁对2型糖尿病胰岛素抵抗大鼠氧化应激的影响[J].中医药信息,2014,31(5):1-4
国家科技重大专项(No.2012ZX09103201-018);国家自然科学基金资助项目(No.81273650);黑龙江中医药大学“优秀创新人才支持计划”项目(No.2012RCD19);黑龙江省博士后落地科研启动金项目(No.LBH-Q15136);黑龙江中医药大学科研基金项目(No.201515);黑龙江中医药大学研究生创新科研项目(No.yjscx2016016)
葛鹏玲(1974-),女,教授,博士研究生导师,主要研究方向:中药防治2型糖尿病的现代药理学研究。
郭文超*(1988-),女,黑龙江中医药大学硕士研究生在读,主要研究方向:中药防治2型糖尿病的现代药理学研究。
2016-05-12
R285.5
A
1002-2406(2016)06-0023-05
修回日期:2016-06-10

