动物源性成分鉴别的样品制备方法研究
——应用于PCR及荧光定量PCR方法的样品制备
李 洁 陆仲斐 童 锐 李向伟 周 凌(上海凡测质量检测有限公司,上海市长宁区 005;上海必诺检测技术服务有限公司,上海市静安区 0046;上海市闵行区疾病预防控制中心 00)
动物源性成分鉴别的样品制备方法研究
——应用于PCR及荧光定量PCR方法的样品制备
李 洁1陆仲斐2童 锐3李向伟1周 凌1(1上海凡测质量检测有限公司,上海市长宁区 200335;2上海必诺检测技术服务有限公司,上海市静安区 200436;3上海市闵行区疾病预防控制中心 201101)
为减少因样本选择引起的误差,把抽样可能存在的片面性问题的风险降到最低,确保制备后的DNA质量,对动物源性成分鉴别样品的前处理方法进行了研究,将用同样采集方法得到的粗样品,经四分法均匀化和非均匀化的不同预处理后,以同样的提取和检测方法,与制备的标准对照品一起进行了检测。结果表明,市售的32份样品经均匀化后的检测结果符合率在93.7%以上。表明本实验研究及建立的动物源性成分鉴别样品的取样及预处理方法是有效可行的,能满足实时荧光PCR实验对样品均匀性的要求。
动物源性成分鉴别样品;荧光定量PCR;取样;预处理;方法
荧光定量PCR作为一种检测食品中细菌及其他成分的方法,具有简便、快速、敏感性高、特异性强等优点,自20世纪90年代以来,就被广泛应用于食品及临床和环境样品的检测。荧光定量PCR方法用于肉类成分鉴别时,在灵敏度、准确性和重复性等重要性能参数上,具有无可比拟的优势,不仅是该领域的主流检测技术,还是仲裁方法和司法鉴定的理想技术类型,更是现行国家和行业标准中指定的方法之一。在检测实践中发现,多种因素会对PCR的检测结果造成影响,且关于送测样品的取样和预处理方法对其影响较大,但目前却尚未有研究报道。为此,通过对目前荧光定量检测中有关肉类与肉制品(动物源性成分鉴别样品)的抽样方法及相关标准的调查,结合实验测试,根据肉类与肉制品的特点,就肉类与肉制品样品的取样及预处理方法进行了研究,并提出了比较有效可靠的荧光定量检测方法中动物源性成分样品取样及预处理的操作方法,以供相关检测同行参考。
1 材料与方法
1.1 试剂及仪器
主要试剂为蛋白酶K、RNA酶、dNTPs、10×PCR缓冲液、MgCl2、Taq DNA聚合酶、2000bp ladder DNAmarker、血液/细胞/组织基因组DNA。提取试剂盒、DNA琼脂糖凝胶回收试剂盒等均购自爱思进生物技术(杭州)有限公司;鸭、牛、羊源性成分实时荧光试剂盒均由上海凡测质量检测有限公司提供;引物、探针的合成及序列测定均由上海立菲生物技术有限公司完成。
主要仪器为CZ-18全自动打浆机(广州晨雕机械设备有限公司)、JFYZ分样器(西安唯信检测设备有限公司)、ABI梯度PCR扩增仪、荧光PCR扩增仪(Life Technologies公司)、GenoSens1880凝胶成像系统(上海勤翔科学仪器有限公司)、电泳系统(伯乐生命医学产品(上海)有限公司)、Sigma台式离心机(上海珂淮仪器有限公司)。
1.2 取样方法
1.2.1 原始样品的采集[1、2]
依据GB/T 9695.19-2008[1]和CCGF 113-2010进行肉类(鲜肉、冻肉)及肉制品原始样品采样。具体操作如下:(1)鲜肉。若为成堆产品,根据货物堆放的形状可在四角+中间设采样点,依据每点分上、中、下三层或上、中上、中、中下、下或/和“W”5点方式或梅花点方式等,确定取样位置,取若干小块混为一份样品;若为零散产品,则随机从3~5片胴体上取若干小块混为一份样品。每份样品重量500~1 500 g。(2)冻肉。小包装冻肉同批同质随机取3~5包混合,每份样品总重量不得少于1 000 g。冻肉取样方法参见鲜肉。(3)肉制品。大片肉制品的取样方法参见鲜肉;每件重量500 g以上的产品,同批同质随机从3~5件上取若干小块混合,每份样品重量500~1 500 g;每件重量500 g以下的产品,同批同质随机取3~5件混合,每份样品总重量不得少于1 000 g;小块碎肉,从堆放平面的四角和中间取样混合,每份样品重量500~1 500 g。
1.2.2 DNA抽提前的样品采集
将送测的500~1 500 g样品用生理盐水清洗后,在粉碎打浆机中充分搅拌并打成肉浆后备用。
1.3 预处理方法
1.3.1 均匀化样本的制备[3]
(1)将上述肉浆充分搅拌均匀备用。(2)把分样器内部清理干净,关上漏斗开关,放好承接器,将(1)样品从高于分样器口5 cm处均匀地注入漏斗内,刮平样品后打开漏斗开关,样品即分别流入,两个承接器内的样品同时倒入漏斗内,继续混合2次,然后取出一个承接器,仍按上述操作方法继续分样,直至一个承接器的样品接近所需试样的重量为止(设定为总重量的1/16,即30~100 g)。每个样品分样完毕后,清洗干净分样器内外部后再进行第2个样品的制备。(3)将(2)制备好的样品,称取20 g,再平分成10份,其中3份检测、3份复检、4份备查。
1.3.2 非均匀化样品的采集及制备[3]
将1.2.1的样品随机称取100 g左右,打成肉浆,再称取20 g,平分成10份,其中3份检测、3份复检、4份备查。1.3.3 样本的抽提和检测
样品抽提及检测参照SN/T 2051-2008、SN/T 2727-2010进行。
1.4 前处理方法的应用比较
采用市售牛、羊和猪肉,按照一定比例混合,依据上述1.2及1.3方法进行样品前处理制备,制备方案(见表1)[4~6]。

表1 标准样品制备方案
为进一步验证建立的取样和预处理方法的有效性及准确性, 对上海各区进行了样品的随机采集。对小吃摊、超市、火锅店、市场的羊肉卷、牛排、猪排等进行随机取样。对采集的样品采用1.2及1.3方法进行前处理以及未进行四分法前处理的,分别提取DNA,其中采集羊肉制品12份、牛肉制品12份、猪肉制品8份。
2 结果与分析
2.1 标准样品的检测结果
检测结果表明(见表2),采用表1方案制备的样品检测结果接近真实添加量,证实采用本研究的前处理方法确实可行。
2.2 抽检样品不同前处理方法的检测结果
检测结果表明(见表3),两种前处理方法的样品检测结果差异显著(P>0.05)[7]。
综合表2、3可知,检测结果的差异并不是由于抽样误差所造成的,而是由于样品前处理方法的不同所致。
3 结论与讨论
检测结果表明:(1)采用1.2和1.3的样品前处理方法,样品间没有显著性差异,且样品的均匀性较好,能满足实时荧光PCR实验对样品均匀性的要求。(2)某些平行样品之间的检测结果相差较大,说明可能还有其他因素影响PCR的检测结果。如附着在牛羊猪肉制品表面或中间的淀粉等非动物源性物质,会影响到实际取得的样品重量,从而影响抽提效果,但这些非动物源性物质的影响有多在还有待今后进一步研究探讨。同时,对本次实验来说,测定样品、操作人员、操作手法均相同,因此,对PCR结果的影响是随机的,对本次统计学结果没有影响。(3)目前针对食品的PCR检测中,样品前处理方法尚无相应的国家标准,且在行业标准中也未见明确规定,在实际操作过程中如何前处理长期存在意见不统一现象,因此,笔者提出的动物源性成分鉴别样品前处理方法可为今后此类国家标准的出台提供参考。
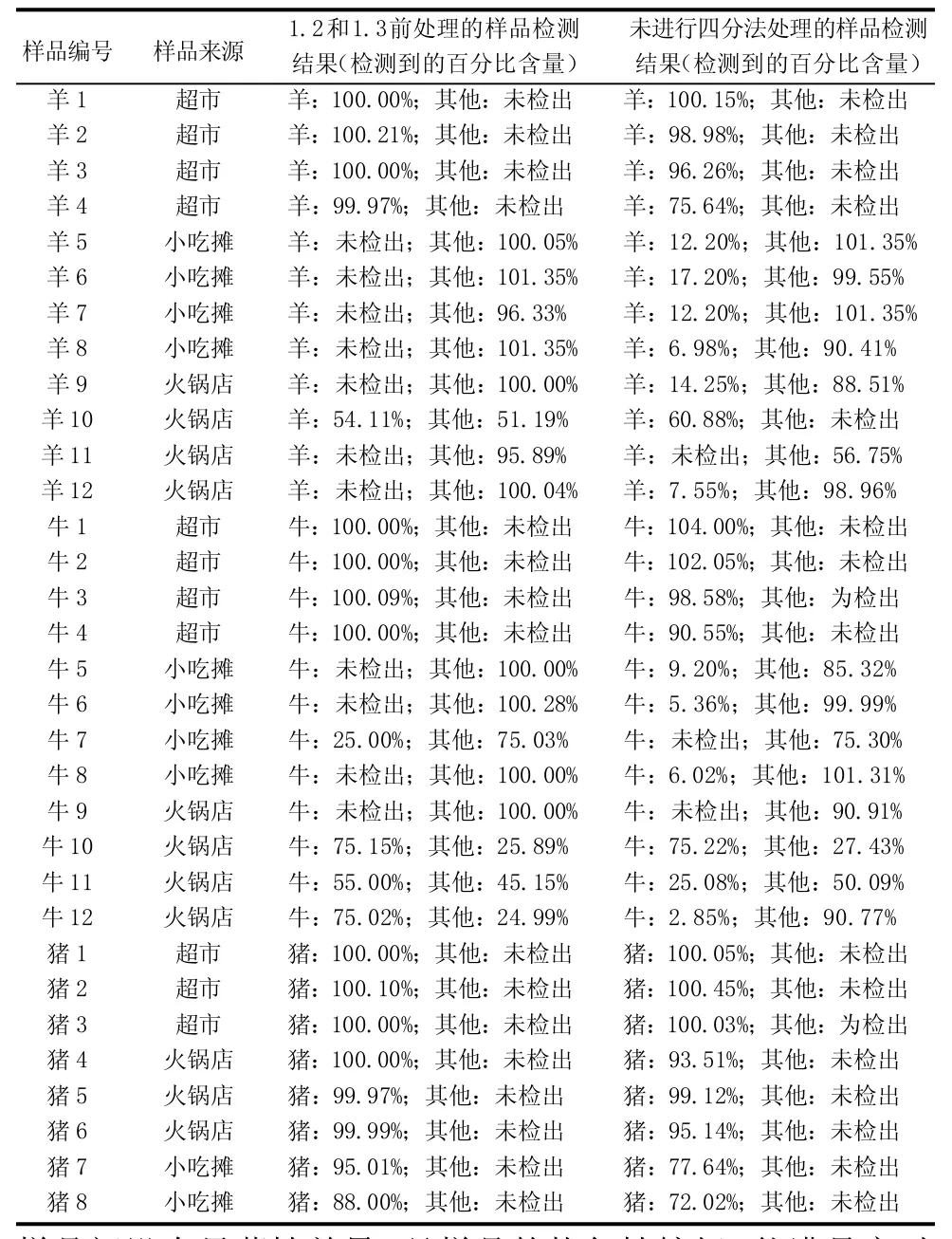
表3 市场抽检样品不同前处理方法的检测结果分析
[1] GB/T 9695.19-2008肉与肉制品 取样方法[S].2008.
[2] 杨君娜,李家鹏,周彤,等.适于肉种掺杂比例实时荧光PCR测定的样品前处理方法[J].肉类研究,2011(12):25-28.
[3] 卢行安,郑江,曹志军,等.微生物能力验证样品均匀性试验的研究[J].中国微生态学杂志,2003,l5(1):33-34.
[4] SN/T 2727-2010饲料中禽源性成分检测方法 实时荧光PCR方法[S].2010.
[5] SN/T 2051-2008 食品、化妆品和饲料中牛羊猪源性成分检测方法 实时PCR法[S].2008.
[6] 郭凤柳,熊蕊,刘晓慧,等.应用PCR技术检测掺假肉类[J].食品安全质量检测学报,2014(2):541-545.
[7] 王钦德,杨坚.食品试验设计与统计分析[M].北京:中国农业大学出版社.2005.
2016-07-04

