超声波提取香樟果皮黄酮类化合物的工艺研究
李聪丽,张志林, 王立华*,杨 婷, 史红安, 李国元
(1.湖北工程学院 特色果蔬质量安全控制湖北省重点实验室,湖北 孝感432000;2.湖北大学 生命科学学院,湖北 武汉430062)
超声波提取香樟果皮黄酮类化合物的工艺研究
李聪丽1,2,张志林1, 王立华1*,杨 婷1, 史红安1, 李国元1
(1.湖北工程学院 特色果蔬质量安全控制湖北省重点实验室,湖北 孝感432000;2.湖北大学 生命科学学院,湖北 武汉430062)
为提高香樟果皮黄酮类化合物的提取利用率,以乙醇为溶剂,利用超声波的方法提取香樟果皮中黄酮类化合物,考察乙醇浓度、料液比、超声时间三因素对香樟果皮中黄酮类化合物提取量的影响。结果表明,利用L9(34)正交试验得到最佳提取工艺条件为乙醇浓度40 %、超声时间35 min、料液比1:35 g/ml。在此优化条件下,香樟果皮黄酮类化合物的提取量为3.285 mg/g。
香樟果皮;黄酮类化合物;正交设计;超声波法
我国樟树资源丰富,共20属430种,其中特有种355余种[1]。香樟(Cinnamomumcamphora)属常绿乔木,原产于我国东南沿海地区,与楠树、梓树、梧桐树被誉为江南四大名木。由于其经济价值、药用价值和生态价值使得香樟的种植面积不断扩大。香樟籽具有散寒祛湿、行气止痛、治吐泻、胃寒、腹痛、腹泻、脚气、肿毒、降血脂及降胆固醇等功效[2-3]。樟树单棵年产籽量约为百斤[4],但未能得到合理开发利用[5]。王福海等[6]利用超声波法提取香樟果中总黄酮,在乙醇的体积分数为40%,温度为50 ℃,超声波功率为300 W,液料比为1:20,时间为0.5 h的条件下,提取率可为2.504%。而黄木兰[7]利用超声波-微波联用的方法其提取率为1.390%。
黄酮类化合物具有抗氧化、抗炎、抗肿瘤、抗癌、抗菌、抗病毒、抗动脉粥样硬化、利胆、抗过敏、抗衰老、抗突变或抑制血小板凝聚、免疫调节、解痉、强心镇痛、清除人体自由基等多种生物学活性和作用[8-9],使其成为研究的热潮。提取黄酮类化合物的方法主要为酶法、碱性水提取、微波法、超滤法、超声法、有机溶剂提法等[10-11],而超声波提取法因操作简单、节能、适应性广、提取率高,在黄酮类化合物的提取中被广泛应用[12]。
近年来,关于香樟籽油提取工艺的文献报道较多,但鲜有香樟果皮中黄酮类化合物工艺研究的报道。因此,本文以香樟果皮为试验材料,利用超声波提取法对黄酮类化合物进行提取量的研究,采取正交实验等方法来优化提取的工艺条件,为香樟果皮资源的深度开发和有效利用提供理论及技术参考。
1 材料、仪器与试剂
1.1 材料
香樟籽紫籽于2014年10月采自湖北工程学院校园内。
1.2 仪器与试剂
仪器:202-2型干燥箱(上海市实验仪器总厂),FSJ-114万用植物样品粉碎机粉碎机,DL-480B智能超声波清洁器(上海之信仪器有限公司),SHZ-D(Ⅱ)型循环水真空泵(上海亚荣生化仪器厂),752N紫外可见分光光度计(上海精密科学仪器有限公司)。
试剂:芦丁(≥ 98%),购于北京百灵威科技有限公司;氢氧化钠、无水乙醇、亚硝酸钠、硝酸铝均为分析纯,购于国药集团化学试剂有限公司。
2 试验方法
2.1 样品的处理
将采摘的新鲜香樟籽洗净,沥干水分,剥下果皮置于干燥箱40 ℃烘至恒重,后粉碎过60目筛,保存备用。
2.2 标准曲线回归方程的建立
准确称取0.0244 g芦丁标准品,装入100 ml的容量瓶中,加入适量50%乙醇使其完全溶解,后用50%乙醇定容、摇匀,即得芦丁标准液。精密吸取芦丁标准液0.0 ml、2.0 ml、4.0 ml、6.0 ml、8.0 ml、10.0 ml、12.0 ml,分别置于100 ml容量瓶中,标准曲线的制作参照杨碧仙[13]的方法。用752型可见分光光度计在510 nm处以空白试剂为参比测定其吸光度,回归方程为:
Y=12.13X+0.0025,R2=0.9976。
2.3 香樟果皮中黄酮类化合物提取量的测定
精确称取香樟果皮粉末1.000 g,按一定的料液比浸泡,固定温度45 ℃、超声功率90 W,在一定条件下进行超声波提取,提取液真空抽滤,定容至100 ml。准确吸取1.5 ml样品液,在最大吸收峰波长510 nm处测定吸光度,按如下公式计算香樟果皮中黄酮类化合物提取量。
黄酮类化合物提取量 (mg/g) =提取液中黄酮类化合物含量 (mg)/样品的质量(g)
2.4 单因素试验
2.4.1 乙醇浓度对香樟果皮中黄酮类化合物提取量的影响
准确称取1.000 g香樟果皮粉末,按料液比1:35,分别加入40%、50%、60%、70%、80%乙醇35.0 ml,室温下浸泡2 h,在超声温度45 ℃,超声时间35 min,超声功率90 W的条件下,进行超声提取,提取液经真空抽滤后,将各水平下的待测液收集至100 ml容量瓶中,分别用与提取剂同浓度的乙醇溶液定容。在最大吸收峰波长510 nm处测定吸光度,试验进行3次。计算香樟果皮中黄酮类化合物的提取量,选取最优的浸提剂浓度。
2.4.2 超声时间对香樟果皮中黄酮类化合物提取量的影响
准确称取1.000 g香樟果皮粉末,按料液比1:35,加入50%乙醇35.0 ml,浸泡2 h,固定超声温度45 ℃,超声功率90 W,选取超声波处理时间分别为20、25、30、35、40 min进行提取试验,提取液经真空抽滤后,将各水平下的待测液收集至100 ml容量瓶中、定容。在最大吸收峰波长510 nm处测定吸光度,试验进行3次。以黄酮类化合物提取量为指标,考察超声时间对黄酮类化合物提取量的影响。
2.4.3 料液比对香樟果皮中黄酮类化合物提取量的影响
准确称取1.000 g香樟果皮粉末,按不同的料液比分别加入50%乙醇10.0、15.0、20.0、25.0、30.0、35.0、40.0 ml,室温下浸泡2 h,在超声温度45 ℃,超声时间35 min,超声功率90 W条件下,进行超声提取试验,提取液经真空抽滤后,将各水平下的待测液收集至100 ml容量瓶中,定容。在最大吸收峰波长510 nm处测定吸光度,试验进行3次。以黄酮类化合物提取量为指标,考察料液比对黄酮类化合物提取量的影响。
2.5 正交试验设计
根据单因素实验结果,以测得样品中黄酮类化合物含量为考察指标,选取直接影响黄酮类化合物含量的乙醇浓度、料液比、超声时间作为试验因素,选用L9(34)进行正交试验设计,对香樟果皮中黄酮类化合物含量的最佳提取条件进行研究。
2.6 数据处理与统计
采用SPSS 19.0软件进行试验数据分析P < 0.05,Origin 8.0绘图。
3 结果与分析
3.1 单因素试验结果
3.1.1 乙醇浓度对香樟果皮中黄酮类化合物提取量的影响
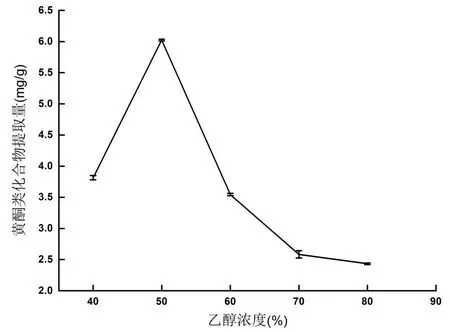
图1 乙醇浓度对香樟果皮中黄酮类化合物提取量的影响
从图1可知,随乙醇浓度增加,黄酮类化合物提取量增加,但乙醇浓度大于50%,提取量呈下降趋势。乙醇浓度为50%时,提取量最高,为2.947 mg/g。其次乙醇浓度为40%提取量为2.365 mg/g,乙醇浓度为60%提取量为1.870 mg/g。因此,本实验选乙醇浓度为40%、50%、60%进行正交试验。
3.1.2 超声时间对香樟果皮中黄酮类化合物提取量的影响

图2 超声时间对香樟果皮中黄酮类化合物提取量的影响
从图2可知,随着超声时间的延长,黄酮类化合物的提取量逐渐增加,超声时间为35 min时,提取量最高,为2.988 mg/g。但处理时间超过35 min后,提取量降低。超声时间30 min时提取量为2.947 mg/g,40 min时提取量为2.935 mg/g。因此,本实验选超声时间为30 min、35 min、40 min做正交试验。
3.1.3 料液比对香樟果皮中黄酮类化合物提取量的影响
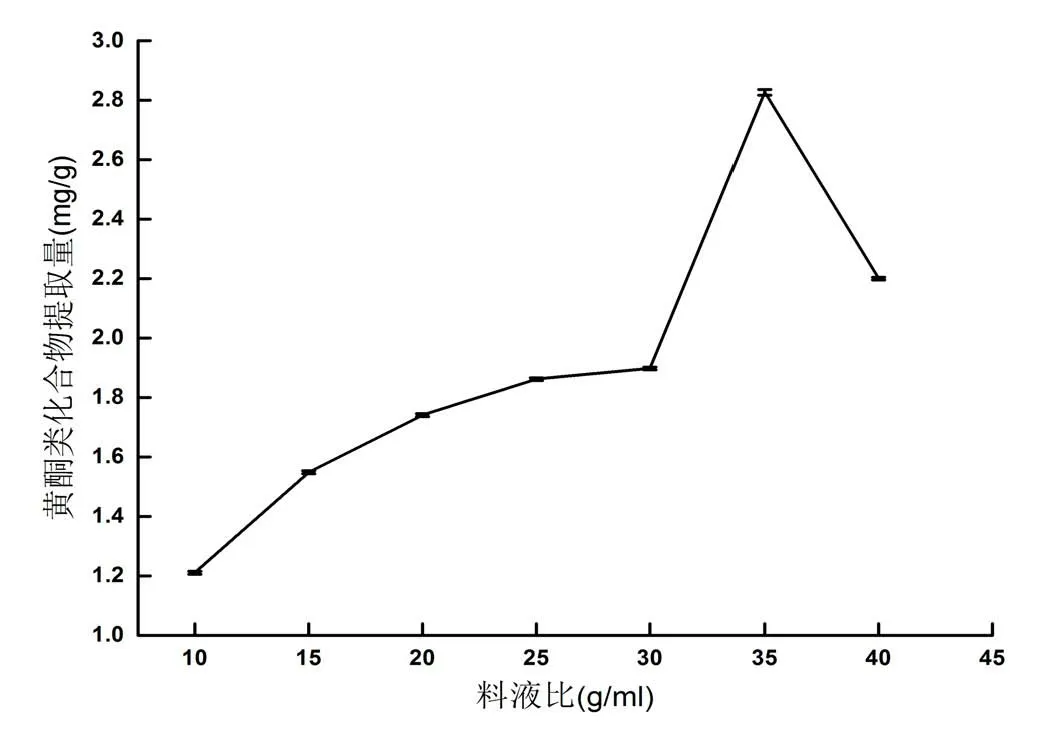
图3 料液比对香樟果皮中黄酮类化合物提取量的影响
从图3可知,随料液比的增加,黄酮类化合物提取量也增加。料液比为1:35时,黄酮类化合物提取量最高,为2.832 mg/g。随料液比的增大,提取量下降。其次料液比为1:40时提取量为2.197 mg/g,料液比为1:30时提取量为1.892 mg/g。因此,本实验选料液比为1:30、1:35、1:40进行正交试验。
3.2 正交试验及结果分析
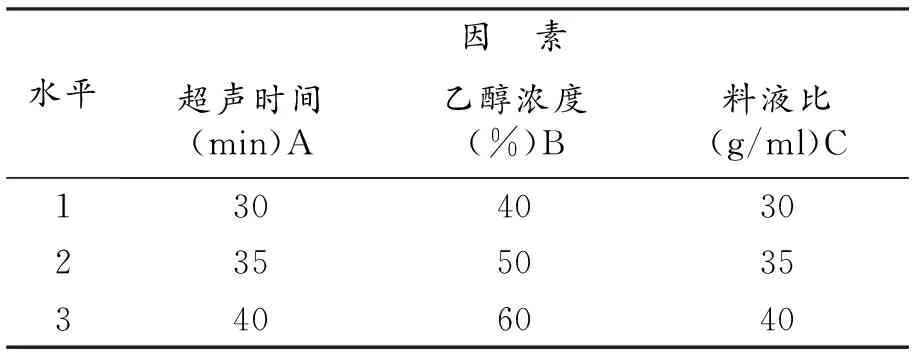
表1 L9(34)正交试验水平因素
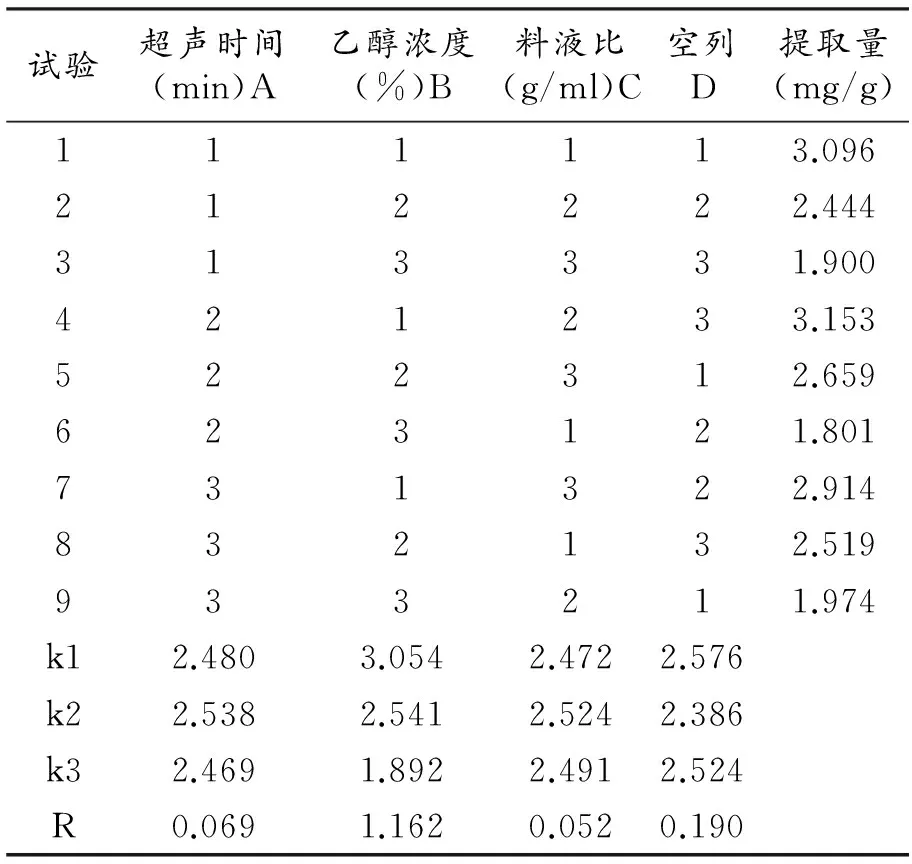
表2 正交试验设计及结果
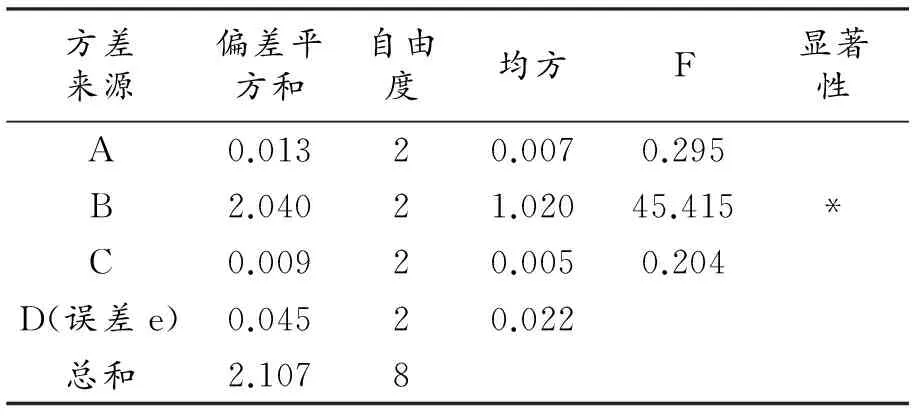
表3 正交试验结果方差分析表
注:F0.01(2, 2) = 99;F0.05(2,2)= 19;F0.10(2,2)= 9;“*”表示差异显著。
由表2中的极差分析结果可知,3种因素对黄酮类化合物提取量的影响依次为乙醇浓度B>超声时间A>料液比C。其中对超声时间A因素有K2>K1>K3,对乙醇浓度B因素有K1>K2>K3,对料液比C因素有K2>K3>K1。从表3可知,在影响香樟果皮黄酮类化合物提取量的各因素中,因素B对黄酮类化合物提取含量的影响显著(F>F0.05),因素A和因素C对黄酮类化合物的提取含量无显著影响(F 3.3 验证试验 在超声温度45℃,超声功率90 W的条件下,按最优组合A2B1C2的条件下进行三次平行试验,黄酮类化合物提取量分别为3.312 mg/g、3.255 mg/g、3.288 mg/g,结果与正交试验最优组合3.153 mg/g结果相近,并高于表2中其他组合的试验结果。 用乙醇溶液作为提取试剂,正交分析结果表明,提取香樟果皮中黄酮类化合物的最佳提取组合为:乙醇浓度为40%,超声时间为35 min,料液比为1:35 g/ml,在此条件下得到的黄酮类化合物平均提取量为3.285 mg/g。利用上述最优组合,黄酮类化合物提取率比王福海[6]和黄木兰[7]报道中的高。 本实验只对香樟紫籽果皮中黄酮类化合物的提取进行了研究,下一步实验将选用青籽和其他更多水平的组合,以找出更佳的香樟果皮黄酮类化合物的提取方法。本工艺具有绿色环保、生产成本低、操作简单、提取率高、适应性广、安全性高等优点,为香樟果皮资源的开发利用提供理论依据和技术参考。 [1] 邱米,覃子海,关继华,等.芳樟型樟树果挥发油成分研究[J].广西植物,2013,33(6):887-890. [2] 耿敬章,刘军海.香樟籽油的响应面优化提取及其抗氧化研究[J].中国粮油学报,2014,29(2):57-61. [3] 张玲,付佳,高军刚,等. 香樟籽油的超声波辅助提取工艺研究[J].安徽农业科学,2010,38(1):352-353. [4] 李卫林.樟树籽中生物活性物质的研究进展[J].武夷学院学报,2012,31(2):37-40. [5] 姜国芳,占俊峰,谢宗波,等.微波辅助水酶法提取樟树籽油的工艺研究[J].食品科技,2015(3):255-258. [6] 王福海,徐慧琴,黄敏.超声波法提取香樟果中总黄酮的研究[J].广州化工,2015,43(5):114-116. [7] 黄木兰. 超声波-微波联用提取香樟果中黄酮类化合物的研究[J].西部教育研究,2015,15(4):66-68. [8] Patil K K, Meshram R J, Dhole N A, et al. Role of dietary flavonoids in amelioration of sugar induced cataractogenesis[J].Archives of biochemistry and biophysics, 2016, 593:1-11. [9] Rauf A, Uddin G, Siddiqui B S, et al. Antinociceptive and anti-inflammatory activities of Flavonoids isolated from Pistacia integerrima galls[J].Complementary Therapies in Medicine, 2014, 25:132-138. [10] 赵子龙,薛培凤,倪佩东,等.天然药物中总黄酮的提取工艺研究进展[J].内蒙古医学院学报,2013,34(6):512-516. [11] 张吉祥,欧来良.正交试验法优化超声提取枣核总黄酮[J].食品科学,2012,33(4):18-21. [12] 张广文,李爱梅,葛婧,等.正交试验优化超声波辅助乙醇法提取米团花黄色素工艺[J].食品科学,2013,34(10):27-30. [13] 杨碧仙,滚兴圣,袁德刚,等. 超声波辅助提取香樟根中总黄酮的工艺优化[J].湖北农业科学,2013,52(12):2894-2896. (责任编辑:熊文涛) Ultrasonic Assisted Extraction of Flavonoids from Camphor Seed Peel Li Congli1,2, Zhang Zhilin1, Wang Lihua1*,Yang Ting1,Shi Hongan1, Li Guoyuan1 (1.HubeiKeyLaboratoryofQualityControlofCharacteristicFruitsandVegetables,HubeiEngineeringUniversity,Xiaogan,Hubei432000,China;2.SchoolofLifeSciences,HubeiUniversity,Wuhan,Hubei430062,China) The extraction technology of flavonoid was optimized from camphor seed peel under ultrasonic conditions. The influences of ethanol concentration, solid-liquid ratio, ultrasonic time were investigated on the extraction yield of flavonoids, and the ethanol was used as an extraction reagent in this experiment. The results showed that the optimum extraction condition was ethanol concentration 40%, ultrasonic time 35 min, the ratio of solid and liquid 1:35(g/ml) with L9(34) orthogonal design. Under the above conditions, the flavonoids yield was 3.285 mg/g. camphor seed peel; flavonoids; orthogonal design; ultrasonic extraction 2016-08-20 李聪丽(1991- ),女,湖北麻城人,湖北工程学院特色果蔬质量安全控制湖北省重点实验室硕士研究生。 王立华(1963- ),男,湖北天门人,湖北工程学院特色果蔬质量安全控制湖北省重点实验室教授,博士,本文通信作者。 Q949.747.5 A 2095-4824(2016)06-0029-044 结论与讨论

