YAP调控肾癌细胞迁移的机制研究
吕 伟,徐 珊,2,杨 政,范义增,李 磊,2,吴开杰,2,贺大林,2,郭 鹏,2
(1.西安交通大学第一附属医院泌尿外科,陕西西安 710061; 2.西安交通大学环境和疾病相关基因教育部重点实验室,陕西西安 710061)
·基础研究·
YAP调控肾癌细胞迁移的机制研究
吕 伟1,徐 珊1,2,杨 政1,范义增1,李 磊1,2,吴开杰1,2,贺大林1,2,郭 鹏1,2
(1.西安交通大学第一附属医院泌尿外科,陕西西安 710061; 2.西安交通大学环境和疾病相关基因教育部重点实验室,陕西西安 710061)
目的 探究YAP对肾癌细胞迁移的影响及其调控机制。方法 查找TCGA数据库进行YAP表达与肾癌发生发展相关性分析;慢病毒感染建立YAP敲低稳克隆细胞系,并通过Western blot和RT-PCR方法检测YAP蛋白和 mRNA的表达;Transwell实验研究YAP敲低对肾癌细胞迁移的影响;鬼笔环肽免疫荧光染色法检测YAP敲低对细胞伪足F-actin的影响。结果 分析TCGA数据库资料得到,YAP mRNA表达量升高与肾癌T4期存在显著相关且具有统计学意义(P<0.05); 敲低YAP显著降低肾癌细胞伪足的形成,从而影响细胞的迁移能力。结论 YAP通过影响细胞F-actin形成以调控肾癌细胞的迁移能力。
YAP;肾癌细胞;F-actin;迁移能力
原发性肾细胞癌是最常见的肾脏恶性肿瘤,在所有恶性肿瘤男女性排名分别为第7及第9位,尽管包括靶向治疗等新兴治疗方法的出现,转移性肾癌的5年生存率仍低于10%[1-3]。Hippo信号通路是目前研究较为清楚的有关调节细胞增殖与凋亡作用的信号传导通路,转录共激活因子YAP(yes-associated protein)是Hippo通路的关键效应因子[4]。异常的YAP表达促进细胞生长并且引导体外细胞的致癌性转化,并可促进上皮间质转化。SCHUTTE等[5]发现在肾癌细胞系通过敲低YAP的表达可以明显抑制肾癌细胞的生长及迁移能力。F-actin是构成细胞骨架的主要成分,在肿瘤细胞中与肿瘤迁移密切相关。本研究旨在探讨在肾癌细胞中敲低YAP后对F-actin的以及对细胞形态及迁移能力的影响,进一步探究YAP调控肾癌细胞迁移能力的机制。
1 材料与方法
1.1 材料 YAP敲低慢病毒载体由上海吉玛公司构建;人肾癌786-O细胞系购买于美国典型培养物保藏中心(American Type Culture Collection,ATCC),肾癌RCC42细胞系由美国德克萨斯大学达拉斯西南医学中心Jer-Tsong Hsieh馈赠;RPMI1640培养基购自Gibco公司;胎牛血清购自四季青公司;胰酶购自Sigma公司;兔抗人YAP多克隆抗体购自Cell Signaling Technology;鬼笔环肽购自Sigma公司;4′,6-二脒基-2-苯基吲哚(DAPI)染色液购自Sigma公司;嘌呤霉素购自Sigma公司;Milicell小室,24-wells购自Millipore公司;普通细胞爬片购自西安润德生物科技有限公司;IRDye 680RD 标记的山羊抗小鼠二抗、IRDye 800CW标记的山羊抗兔二抗、Odyssey 双色红外激光成像系统( LI-COR公司);激光共聚焦显微镜购自Nikon公司。PrimeScriptTMRT Master Mix试剂盒、SYBR®Primix Ex TaqTMII试剂盒购买于TaKaRa 公司。
1.2 方法
1.2.1 细胞培养 用含100 mL/L胎牛血清的1640培养基置于37 ℃、50 mL/L CO2培养箱中培养。细胞呈贴壁生长,2~3 d换液,2.5 g/L胰酶传代。每次换液或传代均向所有培养皿中滴加2 μL/mL嘌呤霉素以筛选稳定转染的细胞。
1.2.2 慢病毒侵染肾癌细胞 接种细胞至24-well,密度为5 000/well,加入0.5 mL完全培养基,37 ℃、50 mL/L CO2培养箱内过夜。第2日移去细胞培养液,加入稀释病毒液0.5 mL,同时建立正常对照组(normal control,NC)组。第3日移去细胞侵染后病毒液加入0.5 mL完全培养基,37 ℃、50 mL/L CO2培养箱内过夜。第4日收集细胞进行下一步实验。
1.2.3 Western blot 病毒转染786-O,RCC42细胞72 h后,RIPA裂解液裂解细胞获取总蛋白[6],50 μg/孔上样,12% SDS-PAGE电泳、110 V电压转膜,5%脱脂牛奶室温封闭1 h,加兔抗人YAP多克隆抗体和兔抗人GAPDH抗体(1∶1 000稀释),4 ℃过夜,TBST漂洗5 min×6次,再加入辣根过氧化酶标记的羊抗兔IgG(1∶1 000稀释),再次TBST漂洗后使用Oddessy近红外扫描系统处理,目标蛋白荧光强度值与对照组相比较,量化蛋白表达的相对表达水平,并以相对荧光强度值为纵坐标,以不同细胞系为横坐标作图。
1.2.4 实时荧光定量PCR 病毒转染786-O,RCC42细胞48 h后收集细胞,按照飞捷RNAfast200试剂说明书提取RNA,cDNA模板通过RNA反转录获得,反转录体系参照TaKaRa PrimeScriptTMRT Master Mix 试剂说明书。YAP的mRNA表达检测使用TaKaRa SYBR®Primix Ex TaqTMII反应体系,上游引物序列为:TAGCCCTGCGTAGCCAGTTA,下游引物序列为:TCATGCTTAGTCCACTGTCTGT。采用GAPDH 作为内参照物,上游引物序列为:GCACCGTCAAGGCTGAGAAC,下游引物序列为:GCCTTCTCCATGGTGGTGAA。mRNA表达水平采用△△Ct计算方法分析。
1.2.5 细胞迁移实验 常规培养786-O NC、786-O YAP、RCC42 NC、RCC42 YAP 细胞,待细胞长满至70%左右,胰酶消化、离心,细胞计数并采用无血清培养基重悬至1.5×105个/mL,将Millicell放入24孔板,上室加入200 μL 细胞悬液,下室加入900 μL含100 mL/L胎牛血清的1640培养基,常规培养24 h后取出上室,PBS洗涤3次,4%多聚甲醛固定,PBS洗涤3次,1%结晶紫染色15 min,用棉签擦去微孔膜上层细胞。在倒置显微镜下计数并做数据统计分析。
1.2.6 免疫荧光染色检测细胞内F-actin的表达 将灭菌后的细胞爬片(18 mm ×18 mm)置于6孔板内,接种786-O NC、786-O YAP、RCC42 NC、RCC42 YAP 细胞,常规培养使细胞长满至60%左右后取出细胞爬片。用PBS洗3次,40 g/L多聚甲醛固定细胞15 min,PBS洗3次,1 g/L Triton X-100 打孔5 min,BSA封闭30 min,5 μg/mL鬼笔环肽染色30 min,PBS洗3次,DAPI 核染色5 min,PBS洗3次,共聚焦显微镜观察细胞核形态变化,拍照并保存图片。
1.2.7 统计学分析 实验结果经SPSS 16. 0统计软件分析,t检验对两组间差异进行统计学分析,采用单因素方差分析(ANOVA) 进行多组间差异比较,P<0.05表示有统计学意义。
2 结 果
2.1 YAP mRNA表达水平与肾癌分期的相关性 癌症基因组计划(The Cancer Genome Atlas, TCGA)[7]是目前最大的癌症基因信息数据库,按照美国抗癌联合会(American Joint Committee Cancer,AJCC)对肾癌T1~T4的分期[8],探究YAP 的表达与肾癌分期间关系。通过查找TCGA数据库,按照T1~T4分期分别找到268、69、178、11例患者数据,通过SPSS16.0统计软件进行YAP表达与肾癌分期相关性分析,发现在T4期YAP mRNA的表达明显高于T1、T2、T3期(图1)。
2.2 肾癌YAP KD稳克隆细胞系建立及鉴定 慢病毒转染786-O,RCC42细胞48 h后收集NC(negative control),YAPKD(YAP knock down)组细胞,经飞捷RNAfast200试剂提取细胞总mRNA并反转录后通过实时荧光定量PCR(Real-time Quantitative PCR,QT-PCR)检测YAP mRNA表达水平。结果显示转染48 h后YAPKD组 YAP mRNA表达明显少于NC 组(图2A)。病毒转染72 h收集细胞,RIPA裂解液裂解细胞获取总蛋白进行Western blot法检测。实验采用GAPDH为内参,Western blot分析显示,病毒转染72 h后YAPKD组中YAP蛋白比NC组显著下降,差异显著(P<0.05),且NC组同时可以检测到YAP蛋白的同分异构体TAZ蛋白(图2B)。证实786-O YAPKD与RCC42 YAPKD细胞系建立成功。
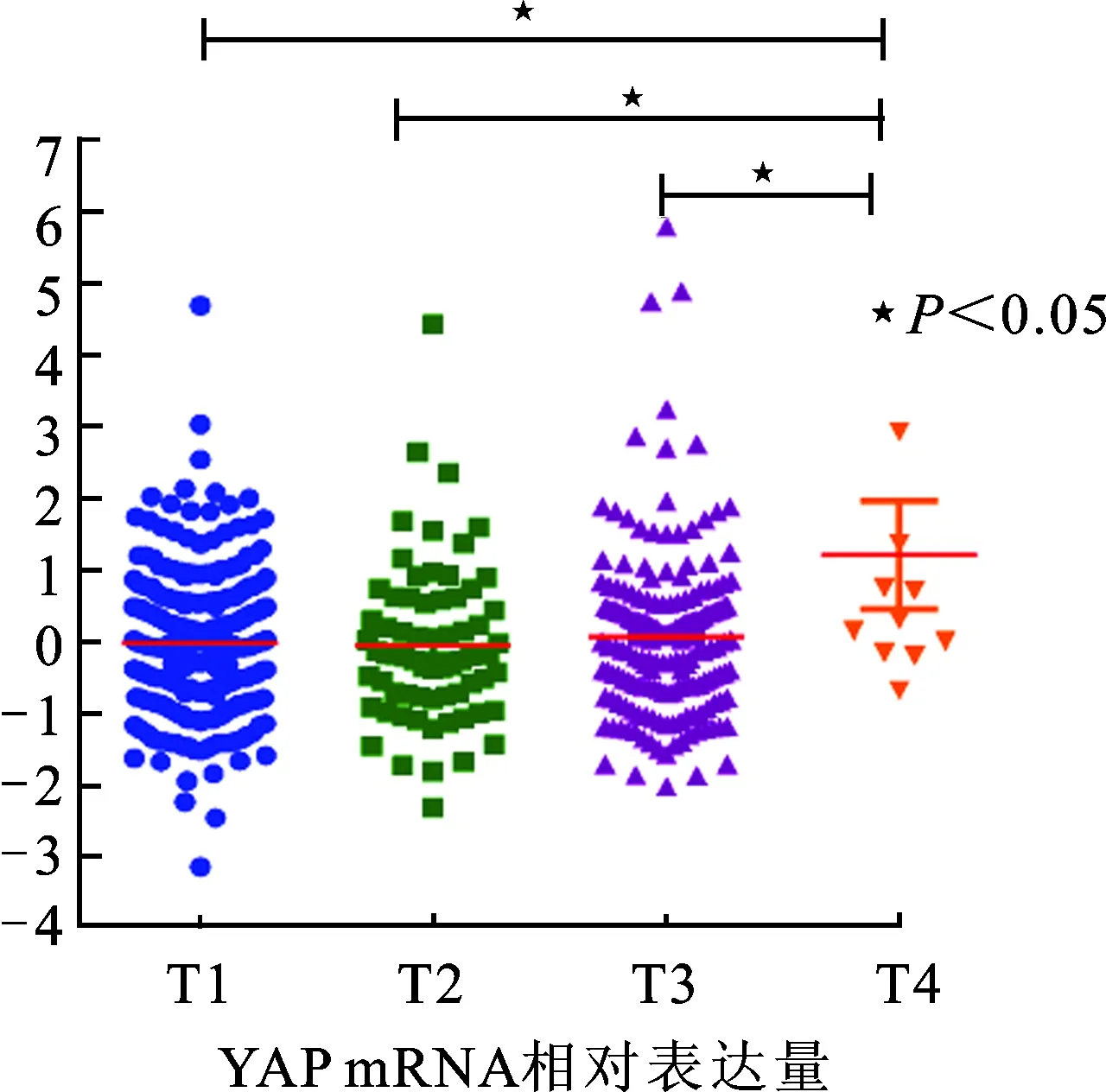
图1 TCGA数据库中在不分期下YAP mRNA的表达情况
2.3 YAP对细胞迁移能力的影响研究 将786-O NC、786-O YAP、RCC42 NC、RCC42 YAP 细胞计数并重悬至1.5×105个/mL,各加入200 μL 细胞悬液于上室,下室加入900 μL含100 mL/L胎牛血清的1640培养基,常规培养24 h后取出上室。经清洗、固定、染色后轻擦去微孔膜上层细胞,放置于显微镜下,人工计数5 个随机视野内穿过小室8 μm孔径膜细胞数,计平均数,786-O与RCC细胞系,NC组及YAPKD组分别为316、355个和114、117个(图3),通过SPSS统计数据YAP 敲低组穿膜细胞数显著少于对照组,差异有统计学意义(P<0.01),提示下调细胞内YAP 表达,可抑制肿瘤细胞的迁移能力。
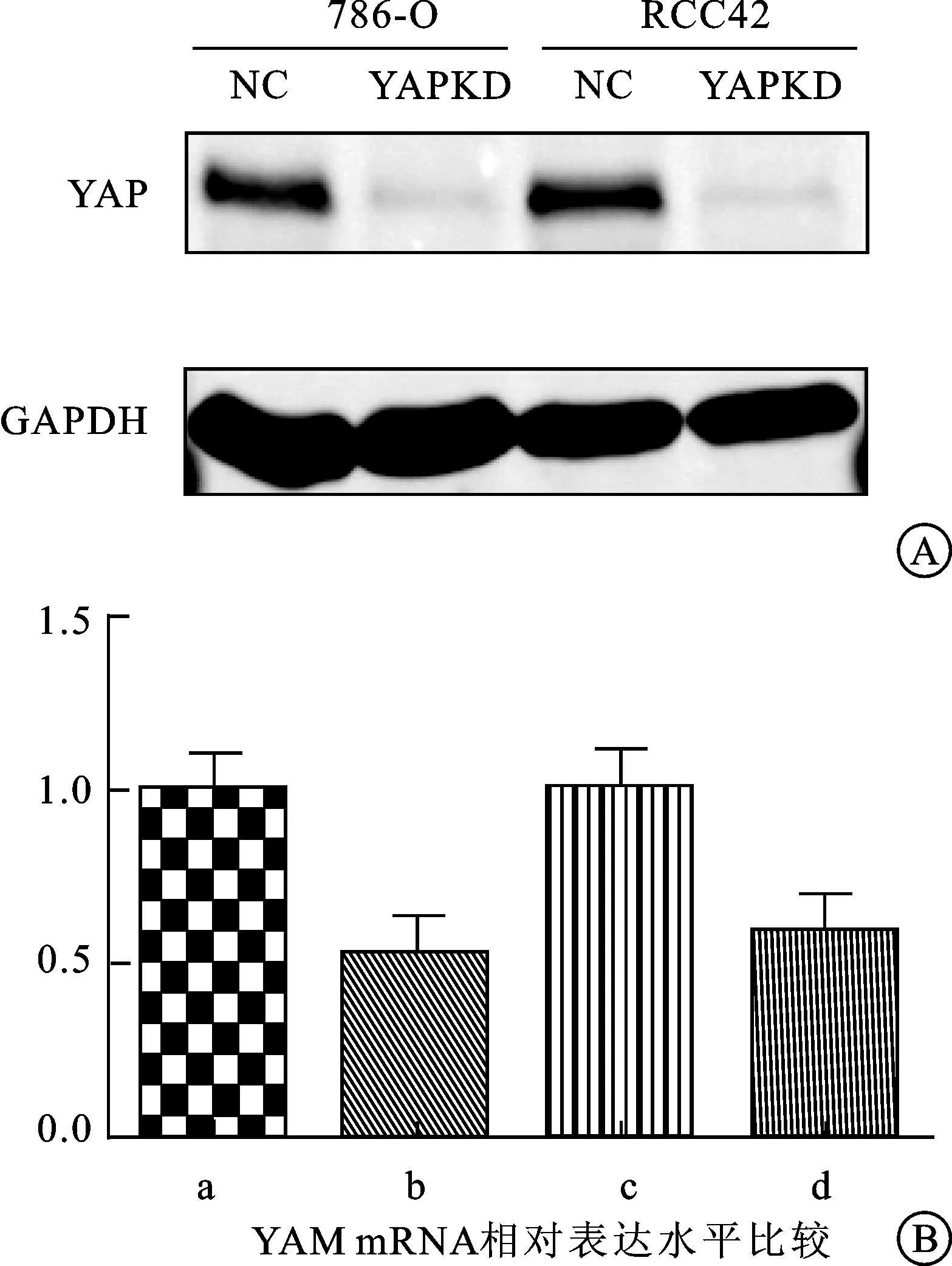
图2 YAPKD与NC组中YAP蛋白及mRNA表达量
A:Western blot示YAPKD组YAP蛋白表达明显下降; B:qRT-PCR结果表明YAPKD组 mRNA表达明显降低a、b、c、d:分别为786 O NC、786 O YAPKD、RCC42 NC、RCC42 YAPKD。
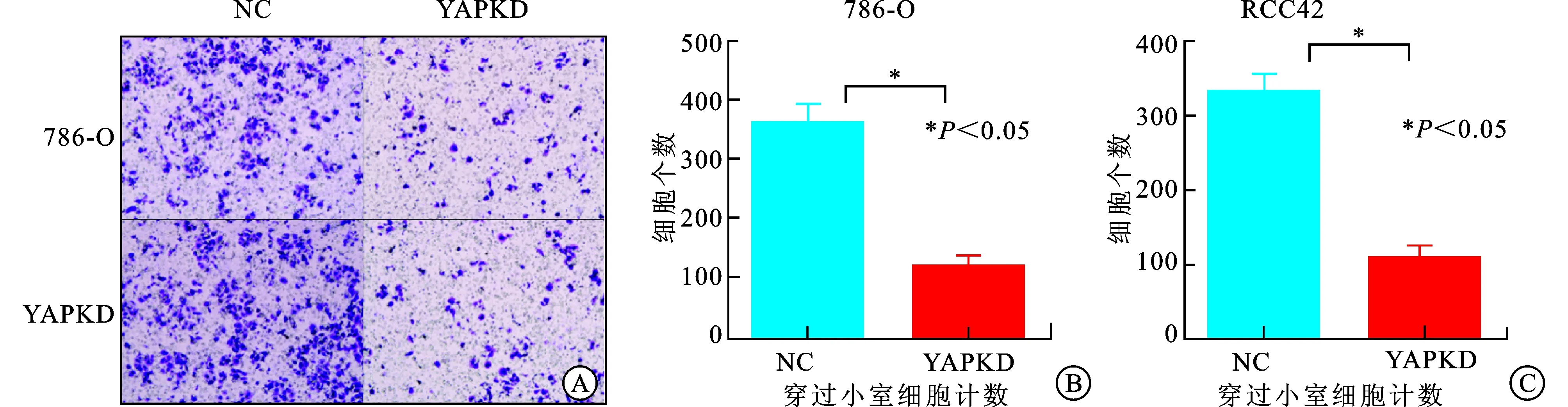
图3 Transwell实验研究YAP敲低对肾癌细胞迁移的影响
A:Transwell实验;B:786-O组穿过小室计数;C:RCC42组穿过小室计数。
2.4 YAP对细胞骨架F-actin的影响 F-actin作为细胞骨架对维持细胞的正常形态非常重要,与肿瘤的侵袭转移密切相关[9-10]。为了观察YAP对细胞F-actin表达影响,通过将细胞爬片(18 mm×18 mm)置于6孔板内,接种786-O NC、786-O YAP、RCC42 NC、RCC42 YAP 细胞,常规培养使细胞长满至60%左右后取出细胞爬片,经PBS清洗、4%多聚甲醛固定,以及F-actin鬼笔环肽染色及DAPI核染色激光共聚焦显微镜观察细胞核形态变化。我们发现敲低YAP后,细胞生长状态及形态发生一定改变,YAPKD组细胞形态变化显著,呈现F-actin明显减少,胞质固缩,伪足减少,与周围细胞连接不紧密等改变,而NC组无相应改变,细胞形态正常(图4)。结果证明YAP可以调控F-actin的表达。
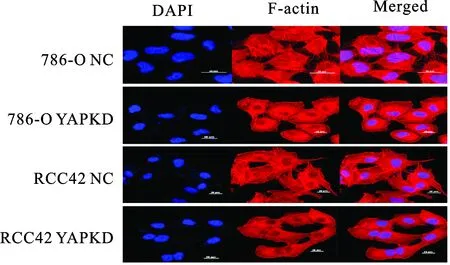
图4 鬼笔环肽染色后激光共聚焦显微镜下观察F-actin变化情况
3 讨 论
肾癌是泌尿系统最常见的恶性肿瘤之一,向远处侵袭转移是肾癌患者死亡的主要原因,由于肾癌细胞的侵袭转移机制尚不完全清楚,晚期肾癌的治疗效果仍不理想,预后较差。YAP是Hippo-pathway通路关键蛋白,作为转录激活因子,通过其WW区域特异地与PXYY区域结合激活下游信号转导[11]。其促进肿瘤生长的作用已经在包括胰腺癌[12-13]、肺癌[14]、乳腺癌[15]等实体肿瘤中得到证实。
本次实验通过在TCGA数据库中检索,发现在T4期肾癌中YAP mRNA表达明显高于其他分期,说明YAP的高表达可能与肿瘤的进展存在密切关系。CAO等[16]通过对肾癌患者组织切片染色发现YAP蛋白在已发生转移、分化差的组织中高表达。这与数据库中结果相符合,为进一步研究YAP与肾癌进展及转移提供了线索。本次实验通过慢病毒载体成功建立RCC42以及786-O YAPKD细胞系。Western blot、QT-PCR检测蛋白及mRNA表达确定细胞系建立成功。分析Western blot时,我们在NC组内也发现了YAP蛋白的同分异构体TAZ蛋白。TAZ在多种肿瘤中也被证实为促癌基因[17]。通过细胞爬片,经鬼笔环肽F-actin染色及DAPI核染色,激光共聚焦显微镜观察,我们发现在YAPKD组F-actin明显减少。据此推测F-actin可能是YAP通路的下游目的蛋白之一。F-actin是细胞骨架中重要结构,与肿瘤的侵袭转移密切相关有,学者认为可以通过F-actin的表达水平来预测细胞迁移能力[18-19]。 我们在实验中亦发现YAPKD组细胞穿过小室细胞数明显少于NC组,据此我们推测YAP蛋白通过调低F-actin的表达降低细胞迁移能力。这与SCHUTTE等[5]的研究结果相同,同时他们也发现YAP的低表达细胞系表现更强的侵袭能力,但是具体机制尚未阐明。DAI 等[20]发现Lats1/2的磷酸化可以在激活YAP向核内转移的同时导致AMOT磷酸化从而抑制F-actin聚合。REGUE等[21]在实验中发现通过GPCRs信号通路激活的F-action聚合可以促进Lats1/2的磷酸化导致YAP向核内转移激活下游基因转录,REDDY等[22]发现actin细胞骨架是Hippo通路上游的一种调节因子,能够激活YAP并且增强其下游CCN生长因子的表达。可见Hippo通路激活下YAP与F-actin亦可独立参与肿瘤迁移的过程。结合本次实验结果,我们推测YAP与F-actin之间可能存在一个环状信号通路,相互促进调节共同调控肾癌细胞的迁移能力。
本次实验证实YAP通过调节F-actin的表达来调控肾癌细胞迁移能力,为进一步靶点于YAP的肾癌治疗提供了理论基础。
[1] ALLORY Y, CULINE S, DE LA TAILLE A. Kidney cancer pathology in the new context of targeted therapy[J]. Pathobiology, 2011, 78 (2):90-98.
[2] CELLA D, GRUNWALD V, NATHAN P, et al. Quality of life in patients with advanced renal cell carcinoma given nivolumab versus everolimus in CheckMate 025:a randomised, open-label, phase 3 trial[J]. Lancet Oncol, 2016, 17 (7):0994-1003.
[3] CHOUEIRI TK, POMERANTZ MM, SIGNORETTI S. Renal-cell carcinoma:a step closer to a new classification[J]. Lancet Oncol, 2013, 14 (2):105-107.
[4] OVERHOLTZER M, ZHANG J, SMOLEN GA, et al. Transforming properties of YAP, a candidate oncogene on the chromosome 11q22 amplicon[J]. Proc Natl Acad Sci USA, 2006, 103 (33):12405-12410.
[5] SCHUTTE U, BISHT S, HEUKAMP LC, et al. Hippo signaling mediates proliferation, invasiveness, and metastatic potential of clear cell renal cell carcinoma[J]. Transl Oncol, 2014, 7 (2):309-321.
[6] ZENG J, SUN Y, WU K, et al. Chemopreventive and chemotherapeutic effects of intravesical silibinin against bladder cancer by acting on mitochondria[J]. Mol Cancer Ther, 2011, 10 (1):104-116.
[7] MCLENDON R, FRIEDMAN A, BIGNER D,et al.Comprehensive genomic characterization defines human glioblastoma genes and core pathways[J]. Nature, 2008, 455 (7216):1061-1068.
[8] MOCH H, ARTIBANI W, DELAHUNT B, et al. Reassessing the current UICC/AJCC TNM staging for renal cell carcinoma[J]. Eur Urol, 2009, 56 (4):636-643.
[9] KPETEMEY M, CHAUDHARY P, VAN TREUREN T, et al. MIEN1 drives breast tumor cell migration by regulating cytoskeletal-focal adhesion dynamics[J]. Oncotarget, 2016.http://www.impactjournals.com/oncotarget/misc/linkedout.php?pii=10798
[10] GRINTSEVICH EE, YESILYURT HG, RICH SK, et al. F-actin dismantling through a redox-driven synergy between Mical and cofilin[J]. Nature Cell Biology, 2016, 2016 (18):876-885.
[11] ZENG Q, HONG W. The emerging role of the hippo pathway in cell contact inhibition, organ size control, and cancer development in mammals[J]. Cancer Cell, 2008, 13 (3):188-192.
[12] CEBOLA I, RODRIGUEZ-SEGUI SA, CHO CH, et al. TEAD and YAP regulate the enhancer network of human embryonic pancreatic progenitors[J]. Nat Cell Biol, 2015, 17 (5):615-626.
[13] KONG D, ZHAO Y, MEN T, et al. Hippo signaling pathway in liver and pancreas:the potential drug target for tumor therapy[J]. J Drug Target, 2015, 23 (2):125-133.
[14] WANG H, LU B, CASTILLO J, et al. Tankyrase inhibitor sensitizes lung cancer cells to endothelial growth factor receptor(EGFR) inhibition via stabilizing angiomotins and inhibiting YAP Signaling[J]. J Biol Chem, 2016, 291 (29):15256-15266.
[15] KIM HM, JUNG WH, KOO JS. Expression of Yes-associated protein (YAP) in metastatic breast cancer[J]. Int J Clin Exp Pathol, 2015, 8 (9):11248-11257.
[16] CAO JJ, ZHAO XM, WANG DL, et al. YAP is overexpressed in clear cell renal cell carcinoma and its knockdown reduces cell proliferation and induces cell cycle arrest and apoptosis[J]. Oncol Rep, 2014, 32 (4):1594-1600.
[17] ZHOU Z, HAO Y, LIU N, et al. TAZ is a novel oncogene in non-small cell lung cancer[J]. Oncogene, 2011, 30 (18):2181-2186.
[18] WANG D, GAO CQ, CHEN RQ, et al. Focal adhesion kinase and paxillin promote migration and adhesion to fibronectin by swine skeletal muscle satellite cells[J]. Oncotarget, 2016.
[19] CURRELI S,WONG BS,LATINOVIC O,et al.Class 3 semaphorins induce F-actin reorganization in human dendritic cells:Role in cell migration[J].J Leukoc Biol, 2016.http://www.jleukbio.org/content/early/2016/07/07/jlb.2A1114-534R.long.
[20] DAI X, SHE P, CHI F, et al. Phosphorylation of angiomotin by Lats1/2 kinases inhibits F-actin binding, cell migration, and angiogenesis[J]. J Biol Chem, 2013, 288 (47):34041-34051.
[21] REGUE L, MOU F, AVRUCH J. G protein-coupled receptors engage the mammalian Hippo pathway through F-actin:F-Actin, assembled in response to Galpha12/13 induced RhoA-GTP, promotes dephosphorylation and activation of the YAP oncogene[J]. Bioessays, 2013, 35 (5):430-435.
[22] REDDY P, DEGUCHI M, CHENG Y, et al. Actin cytoskeleton regulates Hippo signaling[J]. PLoS One, 2013, 8 (9):e73763.
(编辑 何宏灵)
Effect of YAP expression on the mirgation of renal cancer cells and its mechanism
LÜ Wei1, XU Shan1,2, YANG Zheng1, FAN Yi-zeng1, LI Lei1,2, WU Kai-jie1,2, HE Da-lin1,2,GUO-Peng1,2
(1. Department of Urology, the First Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710061; 2. Key Laboratory of Environment and Disease-Related Genes of the Chinese Ministry of Education, Xi’an Jiaotong University, Xi’an 710061, China)
Objective To explore the effect of YAP on the migration of renal cancer cells and its mechanism. Methods The correlation between expression of YAP and T stages of renal cell carcinoma was detected in TCGA database. Stable YAP low expression cell lines were constructed with Lentivirus vector. The YAP protein and mRNA expressions were detected with Western blot and quantitative real-time PCR (QT-PCR). The effect of YAP low expression on the migration ability of renal cancer cells was detected with Transwell assay. The effect of YAP low expression on F-actin was detected with Rhodamine phalloidin staining.Results The high expression of YAP was significantly correlated with T4 stages of renal cell carcinoma (P<0.05). Knocking down of the YAP decreases the formation of F-actin, leading to lower migration ability of renal cell carcinoma cells. Conclusion YAP affects the migration ability of renal cancer cells by affecting the formation of F-actin.
Yes-associated protein; renal cancer cells; F-actin; migration
2016-01-21
2016-07-27
国家自然科学基金(No.81602244;No.81372279)
贺大林,教授.E-mail:hedl@mail.xjtu.edu.cn 郭鹏,教授.E-mail:guopeng661@mail.xjtu.edu.cn.系共同通讯作者
吕伟(1991-),男(汉族),在读硕士研究生;研究方向:泌尿系肿瘤. E-mail:llvwei@qq.com 徐珊(1984-),女(汉族),硕士学位,助理研究员;研究方向:泌尿系肿瘤.E-mail:shanhuxs@163.com.系共同第一作者
R737
A
10.3969/j.issn.1009-8291.2016.11.014

