甘草酸二铵干预兔基底动脉瘤形成的实验研究
桂铮,汪子文,张鹏飞,赵文可,于耀宇
甘草酸二铵干预兔基底动脉瘤形成的实验研究
桂铮,汪子文,张鹏飞,赵文可,于耀宇△
目的探讨甘草酸二铵(DG)干预兔基底动脉瘤发生的作用机制。方法新西兰白兔40只,按照随机数字表法分为对照组、动脉瘤(IA)组、生理盐水(NS)组、DG组,每组10只。其中对照组不做任何处理,其余各组结扎双侧颈总动脉建立基底动脉瘤形成模型。在造模后的第1~7天,IA组不做处理,DG组给予DG[20 mg/(kg·d)]静脉注射,NS组注入等剂量生理盐水。使用免疫组化染色方法检测基底动脉尖核转录因子核因子kappa B(NF-κB)、基质金属蛋白酶9(MMP-9)表达情况,使用免疫荧光染色方法检测基底动脉尖α-平滑肌细胞肌动蛋白(α-SMA)表达情况。结果IA组和NS组NF-κB和MMP-9表达均高于对照组,α-SMA表达量低于对照组(P<0.05);IA组和NS组差异无统计学意义(P>0.05)。DG组NF-κB和MMP-9表达低于IA组和NS组(P<0.05),而α-SMA表达量高于IA组和NS组(P<0.05)。结论DG可抑制NF-κB和MMP-9的表达,减轻血管壁内炎症反应,抑制颅内动脉瘤的形成。
颅内动脉瘤;炎症;NF-κB;基质金属蛋白酶9;肌动蛋白类;血管壁破坏性重构
颅内动脉瘤(intracranial aneurysm,IA)是颅内血管管壁的异常膨出,是一种严重的致死性疾病。其形成的机制尚未完全阐明,目前研究表明,血流动力学引发内皮细胞破坏性重塑并诱发炎症反应可能是引起该病的重要途径[1]。结扎双侧颈总动脉制作兔基底动脉瘤起始模型排除了血流动力学因素以外其他因素的干扰,适用于颅内动脉瘤发生过程分子机制的研究。本研究即采用该模型,并经耳缘静脉注射甘草酸二铵(DG),观察DG对兔基底动脉尖动脉瘤发生过程的干预效果并探讨其机制。
1 材料与方法
1.1 实验材料清洁级新西兰白兔40只,购自军事医学科学院实验动物中心,雌雄不分,体质量2.0~2.5 kg。DG注射液(连云港正大天晴)。一抗:兔抗兔转录因子核因子kappa B(NF-κB)p65抗体(Abcam,ab90532),小鼠抗兔基质金属蛋白酶9(MMP-9)抗体(Abcam,ab58803),小鼠抗兔α-平滑肌细胞肌动蛋白(α-SMA)抗体(Abcam,ab7817)。荧光二抗:罗丹明标记山羊抗小鼠IgG(北京中杉金桥,ZF0313),SP-9000免疫组化试剂盒、DAB试剂盒(北京中杉金桥)。
1.2 方法
1.2.1 动物分组及造模实验动物按照随机数字表法分为4组:对照组、动脉瘤(IA)组、生理盐水(NS)组、DG组,每组10只。对照组不做任何处理,其余各组结扎双侧颈总动脉建立基底动脉瘤形成模型。造模时肌内注射速眠新Ⅱ0.2 mL,后耳缘静脉注射2.5%戊巴比妥钠(30 mg/kg)进行麻醉。麻醉后将动物固定,颈部备皮,行颈部正中切口,分别分离双侧颈总动脉后用4-0丝线结扎。缝合皮肤及软组织。实验动物造模后第1~7天,IA组不做处理,DG组给予DG 20 mg/(kg·d)静脉注射,NS组注入等量生理盐水。
1.2.2 实验动物取材造模后第7天时过量麻醉处死动物,断头取脑,固定,修剪组织,制作基底动脉尖部组织蜡块,脱水包埋制备基底动脉尖部血管纵切面玻片。
1.2.3 基底动脉尖NF-κB和MMP-9免疫组化染色组织玻片常规脱蜡至水,3%H2O2溶液孵育后高压热修复,用山羊血清孵育,加兔抗兔NF-κB p65(1∶200)或小鼠抗兔MMP-9(1∶500),4℃过夜。按照试剂盒说明书进行二抗孵育及DAB显色。常规苏木素复染、盐酸乙醇分化液分化、梯度乙醇脱水、二甲苯透明,中性树胶封片后在200倍镜下观察并计算NF-κB和MMP-9阳性表达细胞百分比。
1.2.4 基底动脉尖α-SMA免疫荧光染色组织玻片常规脱蜡至水,0.1%Triton-100TM破膜后高压热修复,用山羊血清孵育,加入小鼠抗兔α-SMA(1∶200),4℃过夜。避光加入山羊抗小鼠IgG(1∶100),室温孵育后避光加入DAPI(1∶100),孵育后用50%碳酸甘油缓冲液封片,在Leica DMI 3000B荧光显微镜下观察,计算α-SMA阳性表达面积百分比(阳性表达面积/管壁区域面积)。
1.3 统计学方法应用SPSS 19.0软件进行统计分析,计量资料采用均数±标准差表示,多组间比较采用单因素方差分析,组间多重比较行LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 基底动脉尖NF-κB、MMP-9的免疫组化结果与对照组相比,IA组和NS组NF-κB和MMP-9表达均增高(P<0.05);IA组和NS组差异无统计学意义(P>0.05)。与NS组和IA组相比,DG组两指标表达均下降(P<0.05)。见表1,图1、2。
Tab.1Comparison of NF-κB,MMP-9 and α-SMA expressions between four groups表1 各组NF-κB和MMP-9阳性表达细胞百分比和α-SMA阳性表达面积百分比比较(n=10,%,)
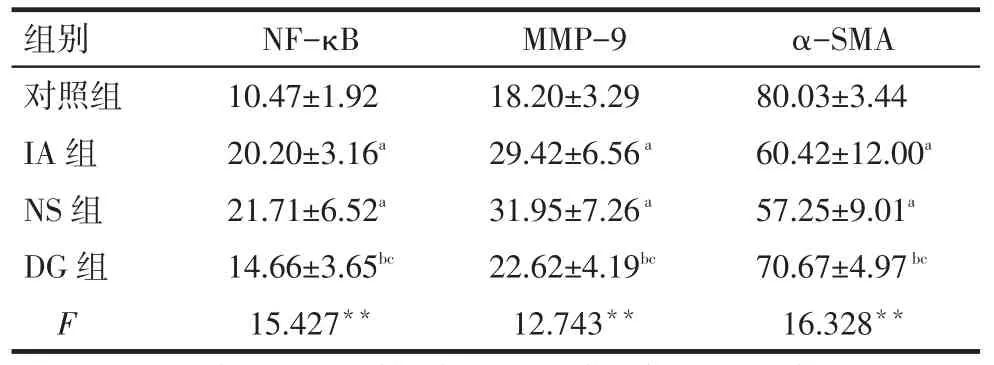
Tab.1Comparison of NF-κB,MMP-9 and α-SMA expressions between four groups表1 各组NF-κB和MMP-9阳性表达细胞百分比和α-SMA阳性表达面积百分比比较(n=10,%,)
**P<0.01;a与对照组比较,b与IA组比较,c与NS组比较,P<0.05
NF-κB 10.47±1.92 20.20±3.16a 21.71±6.52a 14.66±3.65bc 15.427**组别对照组IA组NS组DG组F MMP-9 18.20±3.29 29.42±6.56a 31.95±7.26a 22.62±4.19bc 12.743**α-SMA 80.03±3.44 60.42±12.00a 57.25±9.01a 70.67±4.97bc 16.328**
2.2 基底动脉尖α-SMA免疫荧光染色结果与对照组相比,IA组和NS组α-SMA表达均下降(P<0.05);IA组和NS组差异无统计学意义(P>0.05)。与NS组和IA组相比,DG组α-SMA表达增高(P<0.05)。见表1、图3。
3 讨论
3.1 颅内动脉瘤起始模型可行性分析结扎兔双侧颈总动脉法是制作颅内动脉瘤动物模型的经典方法之一,该方法最早由Hassler报道[2]。Meng等[3]采用相同方法对20只新西兰白兔进行处理,27周后存活的17只全部出现基底动脉尖部以内弹力层损伤、动脉中层变薄以及管壁向外膨出为特点的破坏性重塑,这些特点也是颅内动脉瘤血管管壁的特征性改变。Mandelbaum等[4]和Metaxa等[5]研究也得出同样的特征性改变,可见使用该方法制作兔基底动脉瘤形成模型切实有效,且该模型适用于颅内动脉瘤发生阶段病理机制的研究。本研究中,使用该方法同样在7 d后出现兔基底动脉尖部血管壁的损伤,证明该模型可行且有效。
3.2 NF-κB、MMP-9等在颅内动脉瘤形成过程中的作用炎症反应是颅内动脉瘤形成的重要环节,NF-κB介导的炎症通路尤为重要[6]。颅内动脉瘤形成过程中血流动力学的变化可引起内皮细胞NF-κB激活[7]。单核细胞趋化因子(MCP)-1、MMPs、白细胞介素(IL)-1β等表达增多也与NF-κB的激活有关[8]。本研究中,结扎兔双侧颈总动脉改变了基底动脉尖部的血流动力学状况,结扎7 d后,IA组和NS组NF-κB表达量明显增高,该结果与Aoki等[9]研究结果一致。血流动力学变化引起NF-κB激活的途径很多,如环氧化酶2(COX-2)-NF-κB正反馈机制[10]等。本研究中,IA组和NS组MMP-9表达也增高,MMP-9升高可能与PI3K/Akt/NF-κB通路激活有关[11]。动脉瘤组织中大量表达的MMP-9可降解细胞外基质(ECM)。ECM是维持管壁细胞稳态的重要成分,大量ECM降解可引起管壁结构损伤,造成管壁薄弱。维持颅内动脉管壁的强度和形态的另一种成分是收缩表型平滑肌细胞,而α-SMA是收缩表型平滑肌细胞的重要标志。本研究中,IA组和NS组α-SMA表达低于对照组,说明收缩表型平滑肌细胞含量降低,即平滑肌细胞出现凋亡或表型转化。平滑肌细胞表型转化主要由肿瘤坏死因子(TNF)-α和Kruppel样因子-4(KLF-4)进行调控[12],而NF-κB则可以影响这两种分子的表达。
3.3 DG对颅内动脉瘤形成的干预作用DG是中药单体,分子式C42H68N2O16,相对分子质量为857.01。DG具有广泛的抗炎作用,目前主要用于肝病的治疗。DG可通过多种途径抑制NF-κB的转录、表达以及激活[13-14]。本研究中,DG组NF-κB和MMP-9的表达低于IA组和NS组,说明DG可抑制基底动脉尖部NF-κB的表达或激活。NF-κB表达受抑制后,受NF-κB调控的MMP-9表达也出现降低。NF-κB和MMP-9表达的降低可以减轻基底动脉尖部炎症反应的发生以及ECM的降解,从而减轻管壁结构受损的程度。此外,DG组α-SMA的表达高于IA组和NS组,说明DG组平滑肌细胞的凋亡或表型转化比例较少,大量存在的收缩表型平滑肌细胞使血管壁强度和形态得以维持。总之,DG可以通过抑制NF-κB介导的炎症通路,降低MMP-9的表达以及平滑肌细胞凋亡或表型转化的数量,减轻颅内动脉管壁的炎症反应和损伤程度,达到干预颅内动脉瘤形成的目的。
(图1~3见插页)
[1]Turjman AS,Turjman F,Edelman ER.Role of fluid dynamics and inflammation in intracranial aneurysm formation[J].Circulation,2014,129(3):373-382.doi:10.1161/CIRCULATIONAHA.113. 001444.
[2]Hassler O.Experimental carotid ligation followed by aneurysmal formation and other morphological changes in the circle of Willis[J].J Neurosurg,1963,20:1-7.doi:10.3171/jns.1963.20.1.0001.
[3]Meng H,Metaxa E,Gao L,et al.Progressive aneurysm development following hemodynamic insult[J].J Neurosurg,2011,114(4):1095-1103.doi:10.3171/2010.9.JNS10368.
[4]Mandelbaum M,Kolega J,Dolan JM,et al.A critical role for proinflammatory behavior of smooth muscle cells in hemodynamic initiation of intracranial aneurysm[J].PLoS One,2013,8(9):e74357.doi:10.1371/journal.pone.0074357.
[5]Metaxa E,Tremmel M,Natarajan SK,et al.Characterization of critical hemodynamics contributing to aneurysmal remodeling at the basilar terminus in a rabbit model[J].Stroke,2010,41(8):1774-1782.doi:10.1161/STROKEAHA.110.585992.
[6]Cheng WT,Wang N.Correlation between MMP-2 and NF-κ B expression of intracranial aneurysm[J].Asian Pac J Trop Med,2013,6(7):570-573.doi:10.1016/S1995-7645(13)60098-X.
[7]Li M,Tan Y,Stenmark KR,et al.High pulsatility flow induces acute endothelial inflammation through overpolarizing cells to activate NF-κB[J].Cardiovasc Eng Technol,2013,4(1):26-38. doi:10.1007/s13239-012-0115-5.
[8]Sadamasa N,Nozaki K,Hashimoto N.Disruption of gene for inducible nitric oxide synthase reduces progression of cerebral aneurysms[J].Stroke,2003,34(12):2980-2984.doi:10.1161/01. STR.0000102556.55600.3B.
[9]Aoki T,Kataoka H,Shimamura M,et al.NF-κB is a key mediator of cerebral aneurysm formation[J].Circulation,2007,116(24):2830-2840.doi:10.1161/Circulationaha.107.728303.
[10]Aoki T,Nishimura M,Matsuoka T,et al.PGE2-EP2 signalling in endothelium is activated by haemodynamic stress and induces cerebral aneurysm through an amplifying loop via NF-κB[J].Br J Pharmacol,2011,163(6):1237-1249.doi:10.1111/j.1476-5381.2011.01358.x.
[11]Chen S,Chen W,Zhang X,et al.Overexpression of KiSS-1 reduces colorectal cancer cell invasion by downregulating MMP-9 via blocking PI3K/Akt/NF-κB signal pathway[J].Int J Oncol,2016,48(4):1391-1398.doi:10.3892/ijo.2016.3368.
[12]Ali MS,Starke RM,Jabbour PM,et al.TNF-α induces phenotypic modulation in cerebral vascular smooth muscle cells:implications for cerebral aneurysm pathology[J].J Cereb Blood Flow Metab,2013,33(10):1564-1573.doi:10.1038/jcbfm.2013.109.
[13]Cherng JM,Lin HJ,Hung MS,et al.Inhibition of nuclear factor kappaB is associated with neuroprotective effects of glycyrrhizic acid on glutamate-induced excitotoxicity in primary neurons[J]. Eur J Pharmacol,2006,547(1/3):10-21.doi:10.1016/j. ejphar.2006.06.080.
[14]Xiong H,Xu Y,Tan G,et al.Glycyrrhizin ameliorates imiquimodinduced psoriasis-like skin lesions in BALB/c mice and inhibits TNF-α-induced ICAM-1 expression via NF-κB/MAPK in HaCaT cells[J].Cell Physiol Biochem,2015,35(4):1335-1346.doi: 10.1159/000373955.
(2016-03-07收稿2016-08-26修回)
(本文编辑李鹏)
The intervention effect of diammonium glycyrrhizinate on the formation of basilar artery aneurysm in rabbits
GUI Zheng,WANG Ziwen,ZHANG Pengfei,ZHAO Wenke,YU Yaoyu△
Department of Neurosurgery,the Affiliated Hospital,Logistics College,Armed Police Command,Tianjin 300162,China△
ObjectiveTo explore the mechanism and intervention effects of diammonium glycyrrhizinate(DG)on the formation of intracranial aneurysm(IA)in rabbits.MethodsForty New Zealand rabbits were randomly divided into four groups:control group,IA group,normal saline(NS)groupandDG group,10rabbits for eachgroup. Except for the control group,rabbits in other three groups were operated with bilateral common carotid artery ligation to produce basilar artery aneurysm formation model.DG group was injected intravenously with DG[20 mg/(kg·d)]from the first day to the seventh day after operation,NS group was given same volume of normal saline,while IA group was injected nothing.The expressions of NF-κB and MMP-9 were detected by immunohistochemical staining,while α-SMA was stained with immunofluorescence.ResultsThe expressions of NF-κB and MMP-9 were significantly higher in IA group and NS group than those of control group,while α-SMA expression was significantly lower than that of control group (P<0.01).There were no significant differences in expressions of NF-κB and MMP-9 between IA group and NS group(P>0.05).The expressions of NF-κB and MMP-9 were significantly lower in DG group than those of IA group and NS group(P<0.05).The expression of α-SMA was significantly higher in DG group than that of IA group and NS group(P<0.05). ConclusionDG can downregulate the expression levels of NF-κB and MMP-9 in intracranial aneurysm,suppress inflammatory in artery wall and reduce the pathological changes and have intervention effect on intracranial aneurysm formation.
intracranial aneurysm;inflammation;NF-kappa B;matrix metalloproteinase 9;actins;destructive remodeling of vascular wall
R743.9
A
10.11958/20160102
武警后勤学院附属医院基金重点项目(FYZ201507)
武警后勤学院附属医院神经外科(邮编300162)
桂铮(1989),男,硕士,初级职称,主要从事神经介入临床及基础研究
△通讯作者E-mail:yuyaoyu666@aliyun.com

