金丝桃苷对大鼠脑基底动脉的舒张作用及其作用机制
丁 兰,陈志武,郭 岩
◇药学研究◇
金丝桃苷对大鼠脑基底动脉的舒张作用及其作用机制
丁 兰,陈志武,郭 岩
目的 研究金丝桃苷(Hyp)对大鼠脑基底动脉舒张作用及可能的作用机制。方法 采用微血管张力测定仪检测Hyp对血栓素A2受体激动剂(U46619)和KCl预收缩的大鼠脑基底动脉环的舒张作用;研究去内皮、大电导钙激活钾通道(BKCa)阻断剂、蛋白激酶C(PKC)激动剂或抑制剂对其血管舒张作用的影响。结果 Hyp(10-5~10-3mol/L)浓度依赖性地舒张U46619(10-7mol/L)和KCl(60 mmol/L)预收缩的大鼠脑基底动脉(P<0.001);去除内皮后,Hyp的舒张血管作用减弱(P<0.01);BKCa阻断剂(IBTX,10-7mol/L)、PKC激动剂(PMA,3×10-7mol/L)均能抑制Hyp的舒血管作用(P<0.01,P<0.001);而PKC阻断剂(Bis-1,3×10-6mol/L)能促进Hyp的血管舒张作用(P<0.05)。结论 Hyp对大鼠脑基底动脉有舒张作用,其作用机制可能与激活BKCa通道、抑制PKC有关。
金丝桃苷;基底动脉;血管舒张;大电导钙激活钾通道;蛋白激酶C
脑血管疾病是严重威胁人类健康及生存质量的疾病,其中缺血性脑血管疾病占75%~85%,尤其近几年来,趋于年轻化。因此,对缺血性脑损伤病理分子机制及药物的研究探索一直是医学界的重要课题与热点。金丝桃苷(Hyperin,Hyp)系从锦葵科植物黄蜀葵花朵中提取的一种黄酮醇类化合物,研究[1-2]发现Hyp对抗自由基、拮抗过氧化损伤,减轻脑水肿,降低脑血管阻力、增加脑血流量从而对抗脑缺血。但Hyp对脑血管的舒缩作用及其离子通道机制的研究并不清楚。大电导钙激活钾通道(large-conductance Ca2+-activated K+channels, BKCa)广泛分布在哺乳动物各种组织(不含心肌细胞)中,特别是在血管平滑肌中,BKCa通道是最主要的钾离子通道之一[3],并参与血管张力调节、细胞的兴奋及代谢调节、细胞内信号传导等过程[4]。因其能够调节血管张力,所以BKCa通道是治疗高血压、糖尿病、冠心病及缺血性脑中风等疾病的潜在药物靶点。有研究[5]显示蛋白激酶C(protein kinase C, PKC) 在BKCa通道调节血管张力过程中有重要意义。该研究以大鼠脑基底动脉为研究对象,采用血管张力测定技术,探讨Hyp对血管张力的影响以及与BKCa通道、PKC的关系,为临床应用 Hyp治疗脑血管疾病提供药理学基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康清洁级SD大鼠,雌雄各半,250~300 g,均由安徽医科大学实验动物中心提供。
1.1.2 实验试剂 Hyp(批号:MUST-15082112)购自成都曼斯特生物科技有限公司,纯度98%。二甲基亚砜(DMSO)溶解Hyp现配现用,且DMSO终体积分数低于0.1×10-2对实验无影响;乙酰胆碱(Ach,批号:064K1209)、DMSO(批号:BCBN8235V)、BKCa通道开放剂NS16199(批号:STBD0427V)、PKC激动剂PMA(批号:SLBH6902V)购自美国Sigma公司;血栓素A2受体激动剂(U46619,批号:5)、BKCa通道阻断剂IBTX(批号:22A)购自德国TOCRIS公司;PKC阻断剂Bis-1(批号:D00161187)购自德国Merck Millipore公司。
1.1.3 实验仪器 微血管张力测定仪(丹麦DMT公司,620M);PowerLab生物信号采集系统(澳大利亚AD公司);电热恒温水浴锅(上海医疗器械厂);XTS-20连续变倍体视显微镜(北京泰克仪器有限公司)。
1.2 方法
1.2.1 大鼠脑基底动脉的制备 SD大鼠用10%水合氯醛腹腔注射麻醉后断头迅速取脑,放入通氧的预冷(4℃)PSS缓冲液中,PSS缓冲液含(mmol/L):NaCl 130, KCl 4.7, KH2PO41.18, MgSO4·7H2O 1.18, NaHCO315, Glucose 5.5, Ethylenediaminetetraacetic acid tetrasodium salt hydrate 0.03, CaCl21。显微镜下仔细分离大脑基底动脉,去除血管外周的脂肪和结缔组织,将动脉断离成大约2 mm的环供使用,将两根金属丝(40 μm)穿过血管管腔,固定于浴槽内。离体基底动脉环具体的制备、张力的记录方法、血管活性和内皮完整检测方法同文献[6]。
1.2.2 Hyp对U46619或KCl预收缩大鼠脑基底动脉环的舒张作用 在正式实验前用60 mmol/L KCl预收缩血管,当收缩曲线达到平台后,用PSS缓冲液冲洗2~3次至基线,15 min后,重复上述实验步骤,KCl刺激收缩良好的血管方可进行正式实验。在静息状态下向浴槽内加入60 mmol/L KCl或者10-7mol/L U46619预收缩血管,当血管收缩达到平台后,再向浴槽内累积加入Hyp,使其在浴槽内的终浓度依次递增为10-5、10-4.5、10-4、10-3.5、10-3mol/L。制作Hyp的对数浓度-血管舒张效应曲线,观察Hyp对预收缩血管环张力的影响。溶剂对照组用等体积DMSO,对照组不含Hyp,其它与实验组一致,以排除溶剂对实验结果的影响。
1.2.3 去内皮对Hyp舒张血管的影响 先用钢丝在血管腔内来回摩擦几次去除基底动脉环血管内皮[7],再向浴槽内加入10-7mol/L U46619使血管收缩,待血管收缩稳定后,依次加入上述浓度的Hyp,观察去内皮对Hyp舒张U46619预收缩基底动脉作用的影响。
1.2.4 各个阻断剂或激动剂对Hyp舒张血管的影响 在静息状态下,向浴槽中分别加入BKCa阻断剂IBTX、PKC抑制剂Bis-1、PKC激动剂PMA孵育血管20 min,使其分别在浴管内的终浓度为10-7、3×10-6、3×10-7mol/L。待血管张力平稳后,再加入U46619诱发血管收缩,当血管收缩平稳后依次加入上述梯度浓度Hyp,观察各个阻断剂或激动剂对Hyp舒张作用的影响。

2 结果
2.1 Hyp对U46619预收缩大鼠脑基底动脉环张力的影响 Hyp(10-5~10-3mol/L)浓度依赖性的舒张U46619(10-7mol/L)预收缩内皮完整的基底动脉环,Hyp的IC50是7.30×10-4mol/L,Imax是(60.68±6.15)%,等体积DMSO溶剂对照组无明显的舒张作用,Hyp给药组与溶剂对照组比较差异有统计学意义(F=195.0,P<0.001)。见图1。

图1 Hyp对U46619预收缩基底动脉环的舒张作用
2.2 Hyp对KCl预收缩大鼠脑基底动脉环张力的影响 累加浓度的Hyp(10-5~10-3mol/L)对 KCl(60 mmol/L)预收缩内皮完整的血管环有舒张作用,并呈现浓度依赖性,其IC50为1.28×10-3mol/L,Imax为(44.26±12.95)%,溶剂对照组张力没有明显变化,Hyp给药组的血管舒张作用与溶剂对照组比较,差异有统计学意义(F=98.8,P<0.001)。见图2。
2.3 去内皮对 Hyp舒张U46619预收缩大鼠基底动脉环作用的影响 与去内皮溶剂对照组相比,去除内皮后Hyp仍能浓度依赖性舒张血管(F=408.8,P<0.01),其IC50为2.22×10-3mol/L,Imax为(26.66±2.77)%;Hyp在内皮完整组与去内皮组之间的舒张程度差异有统计学意义(F=50.4,P<0.01)。见图3。
2.4 BKCa通道阻滞剂IBTX对Hyp舒张血管作用的影响 IBTX(10-7mol/L)预孵育大鼠脑基底动脉环后,Hyp对U46619(10-7mol/L)预收缩血管的舒张作用与无IBTX组(Hyp组)相比明显减弱,差异有统计意义(F=12.2,P<0.01),其IC50为1.51×10-3mol/L,Imax是(35.09±15.27)%。见图4。与溶剂对照组相比,BKCa通道开放剂NS1619(5×10-5mol/L)、Hyp(10-3.5、10-3mol/L)能够显著舒张U46619预收缩的血管环,差异有统计学意义(F=2.0、80.5、358.6,P<0.001)。NS1619的最大舒张率Imax为(98.10±1.38)%,Hyp(10-3.5、10-3mol/L)的Imax分别是(23.15±6.39)%和(60.14±8.16)%。见图5。
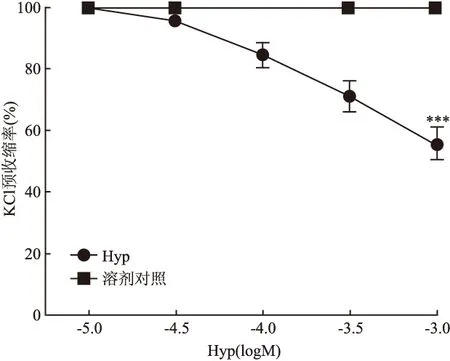
图2 Hyp对KCl预收缩大鼠脑血管环的舒张作用

图3 去内皮对Hyp舒张血管作用的影响
与内皮完整组比较:**P<0.01;与去内皮溶剂对照组比较:△△P<0.01
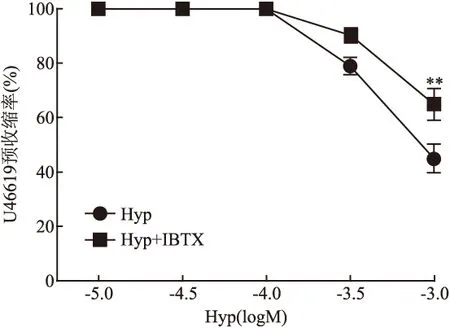
图4 IBTX对Hyp舒张U46619预收缩大鼠基底动脉环作用的影响±s,n=7)
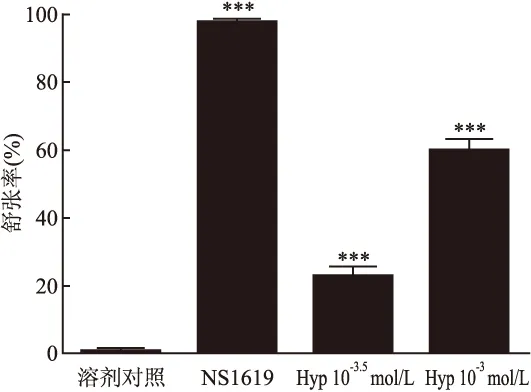
图5 NS1619对U46619预收缩血管环张力的影响与溶剂对照组比较:***P<0.001
2.5 PKC激动剂PMA对Hyp舒血管的影响 PMA(3×10-7mol/L)孵育大鼠脑基底动脉环后,Hyp对预收缩血管的舒张作用减弱(F=290.9,P<0.001),其IC50是3.07×10-3mol/L,Imax从未加激动剂处理组(Hyp组)的(60.68±6.15)%下降到(19.94±4.13)%。见图6。
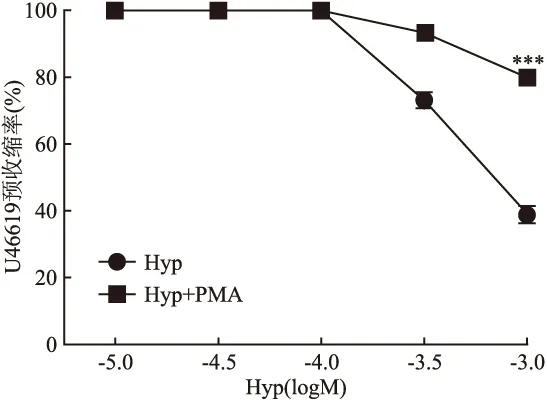
图6 PMA对Hyp介导的大鼠基底动脉环舒张作用的影响±s,n=7)
2.6 PKC阻滞剂Bis-1对Hyp舒血管的影响 预先孵育PKC阻断剂Bis-1(3×10-6mol/L)后, Hyp对U46619(10-7mol/L)预收缩脑基底动脉环的舒张作用增强(F=18.1,P<0.05),其IC50是6.85×10-4mol/L,Imax是(65.73±10.79)%。见图7。
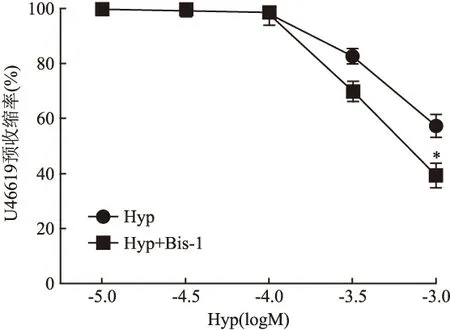
图7 Bis-1对Hyp舒张U46619预收缩基底动脉作用的影响
3 讨论
脑基底动脉可以显著影响脑血管阻力,对微血管压力起到决定性作用,其功能的紊乱可加重缺血性脑损伤,在维持正常脑血液循环中担任重要角色。本研究利用离体血管舒缩实验研究Hyp对大鼠脑基底动脉张力的影响,结果显示60 mmol/L的KCl和10-7mol/L U46619预收缩的大鼠脑基底动脉上,Hyp可以产生浓度依赖性的舒张作用,其舒张脑血管作用可能与内皮、BKCa通道、PKC有关。
Hyp作为一种黄酮醇类单体化合物,研究[1,8]显示其对多种脑损伤模型有较好的保护作用。血管内皮在调节血管阻力方面有着重要作用,内皮组织释放血管内皮活性物质,其最终影响血管平滑肌的电生理和舒缩活动。内皮源性血管活性物质包括松弛因子和收缩因子。一氧化氮(nitric oxide,NO)和前列腺环素(prostacyclin, PGI2)是有代表性的内皮源性血管舒张因子。实验表明无论是内皮完整还是去内皮的血管环,Hyp均对其有浓度依赖性的舒张作用,提示Hyp的舒张血管作用, 部分是通过血管内皮实现的,另一部分可能直接作用于血管平滑肌。以往研究[9-10]表明Hyp可以明显地舒张主动脉或脑动脉,其舒张作用部分依赖于内皮。研究[11-12]显示脑基底动脉预孵育NO合酶抑制剂L-NAME和PGI2合酶抑制剂Indo后,Hyp的舒血管作用有所减弱,但舒张作用依然存在,说明Hyp舒张作用涉及内皮源性舒张因子如NO、PGI2。这些结果均表明Hyp舒张基底动脉是内皮依赖性的。另外,血管去除血管内皮后,虽然Hyp舒张血管作用明显减弱,但仍具备一定的舒张功能,提示Hyp对血管平滑肌也有非内皮依赖性的舒张作用。
本实验主要研究Hyp对脑基底动脉环张力的影响以及与BKCa通道的关系。在血管平滑肌细胞中,钾离子通道开放导致膜超极化,并进一步引起电压依赖性钙离子通道关闭,钙离子内流减少,最终血管舒张。其中最为重要的是 BKCa通道,因其电导最大,广泛分布于血管平滑肌,直接参与血管张力的调节,有较大的生理意义。Hyp可诱导大鼠脑血管产生浓度依赖性的舒张作用和血管平滑肌细胞膜的超极化作用,并且这种Hyp对脑血管的舒张效应能够被非特异性钙激活钾通道(KCa)抑制剂TEA所抑制[10-12],以上结果说明Hyp的舒脑血管作用与KCa通道的激活有关,但涉及到具体哪种KCa通道,尚需要进一步研究。本研究显示,BKCa阻断剂IBTX可抑制Hyp的舒血管作用,说明Hyp舒张脑基底动脉作用可能与其激活BKCa通道有关。
调节脑血管平滑肌收缩的胞内信号转导途径包括肌球蛋白轻链激酶(MLCK)途径和蛋白激酶C途径,PKC可介导血管平滑肌钙依赖性收缩[13],尤其脑缺血时,PKC可引起血管平滑肌异常收缩,最终加重缺血损伤,因此PKC在调节血管平滑肌舒缩过程中发挥重要作用。在培养的家兔门静脉细胞[14]、猪冠状动脉平滑肌细胞[15]上,PKC的激动剂PMA对KCa通道表现出不同程度的阻断作用,也有研究[16]表明:在鼠的肺动脉平滑肌细胞上,经由不同的信号转导途径,PKC可阻断BKCa通道的开放;也可激活BKCa通道。以上说明PKC在BKCa通道调节血管张力过程中具有重要意义。本研究显示,大鼠脑基底动脉预孵育PKC激动剂PMA能够部分抑制Hyp的舒血管作用,而PKC抑制剂Bis-1却能够促进Hyp舒张脑血管。因此,得出这样的结论,PKC参与Hyp舒血管过程,也就是说Hyp通过抑制PKC舒张脑血管,可能是Hyp经PKC激活BKCa通道,最终导致血管舒张,其具体机制尚需许进一步探讨。
综上所述,Hyp可浓度依赖性地舒张大鼠脑基底动脉,其舒张机制可能与内皮细胞、BKCa通道、PKC有关。
[1] 陈红艳, 王建华, 任振学,等.金丝桃苷对大鼠局灶性脑缺血再灌注损伤的防护作用[J].中西医结合学报, 2006, 4(5):526-9.
[2] 韩 军, 宣佳利, 胡浩然,等.金丝桃苷对脑缺血再灌大鼠大脑中动脉舒张作用的机制研究[J]. 中国药学杂志, 2015, 50(7):595-601.
[3] Eichhorn B, Dobrev D. Vascular large conductance calcium-activated potassium channels: functional role and therapeutic potential[J].Naunyn Schmiedebergs Arch Pharmacol, 2007, 376(3):145-55.
[4] Cui J, Yang H, Lee U S. Molecular mechanisms of BK channel activation[J]. Cell Mol Life Sci, 2009, 66(5):852-75.
[5] Barman S A, Zhu S, White R E. Protein kinase C inhibits BKCachannel activity in pulmonary arterial smooth muscle[J]. Am J Physiol Lung Cell Mol Physiol, 2004, 286(1):149-55.
[6] Liu Y, Niu L, Cui L, et al. Hesperetin inhibits rat coronary constriction byinhibiting Ca(2+) influx and enhancing voltage-gated K(+) channel currents ofthe myocytes[J]. Eur J Pharmacol,2014,73(5):193-201.
[7] Lam F F, Deng S Y, Ng E S, et al. Mechanisms of the relaxant effect of a danshen and gegen formulation on rat isolated cerebral basilar artery[J]. J Ethnopharmacol, 2010, 132(1):186-92.
[8] 陈志武, 马传庚, 赵维忠. 金丝桃甙对脑缺血再灌损伤保护作用的实验研究[J]. 药学学报, 1998, 33(1): 14-7.
[9] 王启海, 陈志武. 金丝桃苷对离体大鼠腹主动脉的舒张作用及其机制研究[J]. 中草药, 2010,41(5):766-70.
[10]韩 军, 宣佳利, 胡浩然,等. 金丝桃苷对大鼠离体大脑中动脉血管内皮功 能的影响及其内在机制的研究[J]. 中国中药杂志, 2014, 39(24): 4849-55.
[11]Fan Y F, Chen Z W, Guo Y, et al. Cellular mechanisms underlying Hyperin-induced relaxation of rat basilar artery[J]. Fitoterapia, 2011, 82(4): 626-31.
[12]范一菲. 金丝桃苷抗脑缺血再灌注损伤作用及其EDHF机制[D]. 中国硕士学位论文数据库. 合肥:安徽医科大学, 2010.
[13]Kitazawa T, Kitazawa K. Size-dependent heterogeneity of contractile Ca2+sensitization in rat arterial smooth muscle[J]. J Physiol, 2012, 590(21):5401-23.
[14]Schubert R, Noack T, Serebryakov V N.Protein kinase C reduces the KCacurrent of rat tail artery smooth muscle cells[J]. Am J Physiol, 1999, 276(3):648-58.
[15]Minami K, Fukuzawa K, Nakaya Y. Protein kinase C inhibits the Ca(2+)-activated K+channel of cultured porcine coronary artery smooth muscle cells[J]. Biochem Biophys Res Commun, 1993, 190(1):263-9.
[16]Barman S A, Zhu S, White R E. PKC activates BKCachannels in rat pulmonary arterial smooth muscle via cGMP-dependent protein kinase[J]. Am J Physiol Lung Cell Mol Physiol, 2004, 286(6):1275-81.
Vasodilatation and mechanism of hyperin on rat cerebral basilar artery
Ding Lan, Chen Zhiwu, Guo Yan
(DeptofPharmacology,AnhuiMedicalUniversity,Hefei230032)
ObjectiveToinvestigatethevasodilatationofhyperin(Hyp)onratcerebralbasilararteryanditsrelatedmechanism.MethodsRatcerebralbasilararteryringswereprecontractedwith9,11-Dideoxy-9a,11a-methanoepoxyprostaglandinF2a(U46619)orKClandthevasodilatationofHyponthearteryringswasrecordedwiththeMultiWireMyographSystemModle,Mechanicalremovaloftheendothelium,Large-conductanceCa2+-activatedK+channels(BKCa)inhibitor.ProteinkinaseC(PKC)activatororinhibitoronthebasilararteryringswereusedtoinvestigatethevasorelaxingmechanismofHyp.ResultsHyp(10-5~10-3mol/L)concentration-dependentlyrelaxedtheendothelium-intactringsprecontractedwithU46619(10-7mol/L)orKCl(60mmol/L)(P<0.001).MechanicalremovaloftheendotheliumproducedasignificantinhibitiononHyp-inducedvasodilatorresponse(P<0.01).Hyp-inducedrelaxationwasattenuateddrasticallybyIBTX(BKCachannelinhibitor, 10-7mol/L)andPMA(PKCactivator, 3×10-7mol/L)(P<0.01,P<0.001),whileBis-1(PKCinhibitor,3×10-6mol/L)promotedtheHyp-inducedvasorelaxation(P<0.05).ConclusionHyprelaxescontractedratbasilarartery.ActivationofBKCaandInhibitionofPKCmaybeinvolvedinunderlyingmechanismofHyp-inducedvasodilatation
hyperin;basilarartery;vasodilatation;BKCachannel;proteinkinaseC
安徽省自然科学基金(编号:1408085MH171)
安徽医科大学药理学教研室,合肥 230032
丁 兰,女,硕士研究生;郭 岩,女,副教授,硕士生导师,责任作者,E-mail:guoyanzx@126.com
http://www.cnki.net/kcms/detail/34.1065.R.20161012.1323.016.html
R 285.5;R 329.251;R 962.1;R 972.4;R 743
A
1000-1492(2016)11-1625-05
10.19405/j.cnki.issn1000-1492.2016.11.016
2016-06-22接收

